Ein Virus als Prototyp für infektiös getriggerte Autoimmunerkrankungen in der Dermatologie – Hepatitis C und Autoimmunität
KONTEXT: Bakterielle bzw. virale Erreger gelten heute neben anderen Faktoren als mögliche Auslöser von Autoimmunerkrankungen. Dafür gibt es eine Vielzahl an Beispielen, bei denen ein Zusammenhang zwischen Infektion und Autoimmunität identifiziert werden konnte und heute als gesichert gilt (Lyme-Borreliose durch Borrelien, M. Reiter durch Chlamydien, reaktive Arthritiden bei Neisserien, Staphylokokken, Streptokokken etc.). Bis dato gibt es vereinzelte Studien, in denen die Induktion von Antiphospholipid-Antikörpern sowie folglich auch das gehäufte Auftreten von Thrombosen im Zuge einer Infektion (CMV, HIV, EBV, Adenovirus, Parvovirus, Hepatitis B und C) festgestellt wurde. Bei Patienten mit SLE werden in der Literatur sowohl eine CMV- als auch eine EBV-Infektion als mögliche Auslöser diskutiert. Neben einer Infektion als möglicher Auslöser von Autoimmunität stellen sich zunehmend auch Impfstoffe als Trigger für Autoimmerkrankungen heraus (z.B. Hepatitis-B-Impfung und multiple Sklerose). Das Hepatitis-C-Virus (HCV) gilt als Prototyp für die Fähigkeit eines Virus, Autoimmunität zu induzieren. Die pathogenetischen Mechanismen sind zumeist noch unklar, jedoch legen die heutigen Ergebnisse eine Dysregulation des gesamten Immunsystems im Rahmen einer HCV-Infektion nahe (s. Abb. 1).

Weltweit sind derzeit ca. 200 Millionen Menschen mit dem Hepatitis- C-Virus infiziert. In Österreich sind bis dato etwa 80.000 Infizierte gemeldet. Meistens ahnen die Infizierten zu Beginn nichts von ihrer Erkrankung, da die akute HCV-Infektion klinisch unbemerkt verläuft und daher bis zu 90 % in eine chronische Form übergehen. Nicht selten stellt eine extrahepatische Manifestation das erste klinische Zeichen einer HCV-Infektion dar. Rund 60 % der Patienten mit chronischer HCV-Infektion entwickeln im Langzeitverlauf mindestens eine extrahepatische Manifestation; meist handelt es sich dabei um Autoimmunerkrankungen sowie in weiterer Folge auch um Lymphome.
Daher ist das Wissen um die Möglichkeit, dass Patienten eine extrahepatische Manifestation im Rahmen einer HCV-Infektion entwickeln können, von großer Bedeutung – nicht nur für den Internisten, sondern vor allem auch für alle Fachdisziplinen, die sich mit der Diagnostik und Abklärung von Autoimmunerkrankungen beschäftigen. Im Folgenden möchten wir einen kurzen Überblick über die möglichen extrahepatischen Manifestationen, mit denen der Dermatologe konfrontiert ist, geben.
HCV-induzierte Kryoglobulinämie und kryoglobulinämische Vaskulitis
Kryoglobuline sind Immunglobuline, die bei Wärme in gelöster Form im Serum vorliegen und bei Kälte reversibel präzipitieren. Entsprechend Brouet werden Kryoglobuline heute in drei Subtypen eingeteilt. 60–90 % aller gemischten Kryoglobulinämien (Typ II, III) werden durch eine Infektion mit dem Hepatitis-C-Virus hervorgerufen. Bei etwa 50 % aller Patienten mit einer HCV-Infektion sind gemischte Kryoglobulinämien nachweisbar, jedoch nur bei ca. 10 % dieser Patienten treten Symptome auf.
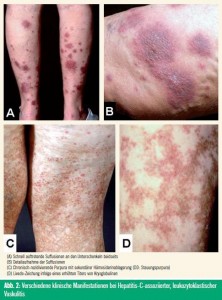
Die kryoglobulinämische Vaskulitis ist durch die so genannte Meltzer-Trias gekennzeichnet: Purpura, Müdigkeit und Arthralgien. Die folgenden Organe sind am häufigsten betroffen: Haut, Gelenke, Nerven und Nieren. Im Rahmen einer kryoglobulinämischen Vaskulitis entwickeln die Patienten zumeist palpable, nicht wegdrückbare Purpura im Bereich der unteren Extremität (Abb. 2). Histologisch sind klassische Zeichen einer leukozytoklastischen Vaskulitis feststellbar sowie in der Immunfluoreszenz Ablagerungen von C3, IgM und IgG im Bereich der Gefäße. Daneben kann sich eine kryoglobulinämische Vaskulitis auch in Form eines Raynaud-Syndroms, einer Akrozyanose mit daraus resultierenden digitalen Nekrosen und Ulzera manifestieren.
Die Arthritiden, die im Zusammenhang mit einem kryoglobulinämischen Syndrom beobachtet werden, sind meist nicht-erosive, asymmetrische Monooder Oligoarthritiden.
Die häufigste renale Manifestation im Rahmen einer kryoglobulinämischen Vaskulitis ist die membranoproliferative Glomerulonephritis. Ihr Vorhandensein per se scheint ein negativer prognostischer Faktor für den Verlauf der Erkrankung zu sein, da sie nicht nur zur Dialysepflichtigkeit führt, sondern auch mit einer erhöhten Morbidität und Mortalität einhergeht.
Über mikroangiopathische Veränderungen der Vasa nervorum kann eine Kryoglobulinämie auch zu einer peripheren Neuropathie führen. Klinisch manifestiert sich diese Neuropathie vor allem als sensorische Mono- oder Polyneuropathie, die mit Kribbeln, brennenden Schmerzen und Pruritus einhergeht. Motorische Defizite treten meist erst im späteren Verlauf auf. Seltenere Symptome können gleichwohl von erheblicher Bedeutung sein und müssen als Vaskulitismanifestationen erkannt werden, wie beispielsweise eine akut dekompensierte Herzinsuffizienz im Rahmen einer Beteiligung der Koronararterien, eine Psychose bei ZNS-Vaskulitis oder ein akutes Abdomen bei intestinaler Vaskulitis.
Diagnose und Therapie der kryoglobulinämischen Vaskulitis
Zur Diagnostik einer kryoglobulinämischen Vaskulitis werden serologische, his topathologische und klinische Kriterien herangezogen. Bei Nachweis einer gemischten Kryoglobulinämie, einem Komplementverbrauch, einer kutanen leukozytoklastischen Vaskulitis mit palpablen, nicht wegdrückbaren Purpura gilt die Diagnose einer symptomatischen kryoglobulinämischen Vaskulitis als gesichert (Tab.). Die Transaminasen (GOT, GPT) sind bei ca. 50 % der Patienten nicht oder nur intermittierend leicht erhöht trotz zum Teil schwerer histologischer Veränderungen in der Leberbiopsie. Daher schließt eine fehlende Transaminasenerhöhung eine HCVassoziierte kryoglobulinämische Vaskulitis nicht aus. Ein hoch positiver Rheumafaktor ist in der klinischen Routine ein etablierter Surrogatparameter für das Vorliegen einer Kryoglobulinämie.
Die Therapie einer kryoglobulinämischen Vaskulitis ist vom Stadium der Erkrankung abhängig. Prinzipiell ist vor dem Hintergrund der Ätiopathogenese der Kryoglobulinämie die Eradikation der chronischen HCV-Infektion mittels der etablierten Kombinationstherapie (Interferon-_ und Ribavirin) die Behandlung der ersten Wahl. Insgesamt ist die Therapie jedoch eine große Herausforderung, da standardisierte Therapieprotokolle nicht existieren, eine hohe Rezidivquote besteht sowie bei fulminanten Manifestationen bzw. Kontraindikationen bzgl. einer Interferon-α-basierten, antiviralen Behandlung alternative therapeutische Optionen (Immunsuppressiva und/oder Plasmapherese) in Erwägung gezogen werden müssen. Dabei muss immer bedacht werden, dass es unter Immunsuppression – abgesehen vom Benefit für die Therapie der symptomatischen Kryoglobulinämie – zu einer Virusvermehrung kommen kann.
Lymphome
HCV-induzierte Lymphome können mit oder ohne Kryoglobulinämie auftreten. Analog zur Helicobacter-pylori-Infektion besteht ein gesicherter kausaler Zusammenhang zwischen der chronischen HCV-Infektion und der Entwicklung von Non-Hodgkin-Lymphomen (NHL). Patienten mit einer HCV-induzierten Kryoglobulinämie haben ein 35-fach höheres Risiko, ein NHL zu entwickeln, verglichen mit der Normalbevölkerung. Im Allgemeinen sind niedrig maligne Lymphome häufiger mit einer HCV-Infektion assoziiert. Für den Übergang der benignen polyklonalen/oligoklonalen B-Zell-Proliferation zum manifesten Lymphom wird ein schrittweiser Prozess mit mehreren genetischen Abberationen angenommen (s. Abb. 1). Als Therapie wird bei niedrig malignen Lymphomen erneut die kausale Kombinationstherapie (Interferon-α und Ribavirin) empfohlen sowie bei intermediären bzw. malignen Lymphomen eine initiale Chemotherapie mit anschließender antiviraler Kombinationstherapie. Die Verwendung von Rituximab hat sich sowohl als Monotherapie als auch in Kombination mit der antiviralen Therapie bisher als sehr effektiv bei Patienten mit niedrig malignen Lymphomen erwiesen.
Systemischer Lupus erythematodes (SLE)
Die chronische HCV-Infektion kann klinische sowie laborchemische Merkmale (Arthralgien, Panzytopenie, Nephropathien, ANA) induzieren, die in Kombination die ACR-Kriterien 1982 eines SLE erfüllen. Eine Hepatitis-Serologie sollte daher generell bei allen Patienten mit der Verdachtsdiagnose eines SLE abgenommen werden, vor allem bei Patienten mit niedrigem ANA-Titer, hohem Rheumafaktor, Leberbeteiligung bzw. erhöhten Transaminasen, einem Komplementverbrauch und positiven Kryoglobulinen. Bisher wurde bei diesen Patienten eine Hautmanifestation als Ausschlusskriterium beschrieben, jedoch wurde an unserer Klinik erst kürzlich ein HCV-getriggerter SCLE diagnostiziert und mit Rituximab erfolgreich behandelt. Erschwerend bei diesen Patienten ist vor allem die Wahl der Therapie, da eine kausale Behandlung der Hepatitis C mit Interferon-α einen Schub des SLE auslösen kann.
Sjögren-Syndrom
Klinisch ist ein HCV-induziertes, sekundäres Sjögren-Syndrom fast nicht von einem primären Sjögren-Syndrom zu unterscheiden. Der Unterschied zwischen den beiden besteht wiederum einerseits im laborchemischen Profil mit gehäuftem Auftreten von Kryoglobulin-assoziierten Markern bei einem HCV-induzierten, sekundären Sjögren-Syndrom. Selten werden bei diesen Patienten die charakteristischen SS-A/Ro- oder SS-B/La-Antikörper detektiert. Klinisch haben nur 10 % dieser Patienten subjektiv eine Sicca-Symptomatik, während bei drei Viertel der Patienten entweder ein passender his tologischer Befund oder ein pathologischer Test (Sialometrie, Schirmer-Test) vorliegt. Über die Effektivität einer antiviralen Therapie beim HCV-induzierten, sekundären Sjögren-Syndrom gibt es bisher keine Berichte in der Literatur.
Antiphospholipid-Syndrom
Das Auftreten von Antiphospholipid-Antikörpern im Rahmen einer HCV-Infektion wurde bereits in mehreren Studien untersucht. Bezüglich der klinischen Relevanz besteht eine widersprüchliche Datenlage. Einerseits wurde bei diesen Patienten keine erhöhte Inzidenz an Thrombosen festgestellt und das Auftreten von Antiphospholipid-Antikörpern als Epiphänomen im Rahmen der HCV-Infektion interpretiert, während andererseits ein vermehrtes Auftreten von intraabdominellen Thrombosen, Myokardinfarkten und Insulten festgestellt werden konnte. Eine generelle Empfehlung hinsichtlich einer oder keiner Antikoagulation dieser Patienten gibt es nicht.
Dermatomyositis
Bis dato gibt es nur wenige Berichte hinsichtlich einer Dermatomyositis als extrahepatische Manifestation einer HCV-Infektion. Wiederholt wurde bei diesen Patienten neben einer HCV-Infektion ein gleichzeitig bestehendes hepatozelluläres Karzinom diagnostiziert. Daher sollte bei einer Dermatomyositis im Rahmen einer HCV-Infektion eher an ein paraneoplastisches Syndrom gedacht werden.
Rheumatoide Arthritis
Arthralgien treten häufig im Rahmen einer HCV-Infektion auf. Klinisch kann man entsprechend der Gelenkbeteiligung zwei Typen unterscheiden: die erosive Polyarthritis mit Beteiligung der kleinen Gelenke sowie die non-erosive Oligoarthritis vor allem der mittleren und großen Gelenke. Erstere ist sehr häufig und diese Patienten erfüllen meist die ACR-Kriterien. Bei Vorliegen von morgendlicher Steifigkeit, rheumatischen Knoten, einer erosiven Arthritis und Anti-CCP-Antikörpern kann die Diagnose einer co-existierenden rheumatoiden Arthritis gestellt werden. Bei einem atypischen Verlauf der Arthritis, insbesondere in Form einer Oligoarthritis, muss stets eine HCV-Infektion mit ins diagnostische Kalkül gezogen werden. Die Oligoarthritis spricht gut auf NSAR, niedrig dosierte Kortikosteroide bzw. Hydroxychloroquin an. Bei der Kryoglobulin-assoziierten Arthritis hat sich die Elimination des HCV-Virus mittels antiviraler Kombinationstherapie bewährt. Standardisierte Therapierichtlinien gibt es auch hier keine, weshalb die Therapie im Einzelfall individuell anzupassen ist.
Zusammenfassung
Die Frage, ob im Zuge einer HCV-Infektion eine Autoimmunerkrankung im Sinne einer extrahepatischen Manifestation nur imitiert wird oder ob das Hepatitis-C-Virus eine Autoimmunerkrankung auslöst, kann derzeit meist nicht beantwortet werden. Als charakteristisches Merkmal einer HCV-induzierten Autoimmunerkrankung wird von manchen Autoren das häufigere Auftreten von Kryoglobulin-assoziierten (Kryoglobuline, Rheumafaktor, Komplementverbrauch) gegenüber krankheitsspezifischen Laborparametern (ENA, AntidsDNA-Antikörper, Anti-CCP-Antikörper) angesehen. Zusammenfassend gilt, dass bei allen Patienten mit chronischer Müdigkeit und begleitenden unklaren rheumatischen, hämatologischen, endokrinologischen oder dermatologischen Krankheitsbildern eine HCV-Infektion in Betracht gezogen werden muss.
Literatur: www.hepatitis.at
– Böckle BC, Sepp N. Hepatitis C virus and autoimmunity. Autoimmunity Highlights 2010; 1(1), 23-35
– Böckle BC, Baltaci M, Ratzinger G, Graziadei I, Vogel W, Sepp N. Hepatitis C and autoimmunity – search for the clone! Journal of Internal Medicine 2011; in press
– Ferri C. Mixed cryoglobulinemia. Orphanet J Rare Dis 2002; 3: 25
– Münz C, Lünemann JD, Getts MT, Miller SD. Antiviral immune responses: Triggers of or triggered by autoimmunity? Nat Rev Immunol 2009 Apr; 9(4): 246-58
– Wraith DC, Goldman M, Lambert PH. Vaccination and autoimmune disease: What is the evidence? Lancet 2003 Nov 15; 362(9396): 1659-66
– Uthmann IW, Gharavi AE. Viral infections and antiphospholipid antibodies. Sem Arth & Rheum 2002; Vol 31, 4(2): 256-263
– Ramos-Casals M, Munoz S, Medina F, Jara LJ, Rosas J, Calvo-Alen J, et al., Systemic autoimmune diseases in patients with hepatitis C virus infection: Characterization of 1020 cases (The HISPAMEC Registry). J Rheumatol 2009; 36(7): 1442-1448