Die Bedeutung des Sentinel-Lymphknotens beim malignen Melanom
Trotz der Entwicklung neuartiger Therapiekonzepte in der Behandlung des metastasierenden Melanoms ist die Lebenserwartung nach Diagnose einer Metastasierung nach wie vor deutlich reduziert. Da die initiale Metastasierung überwiegend lymphogen erfolgt, gab es schon früh Bestrebungen, die Entfernung der regionalen Lymphknoten in die operative Versorgung des malignen Melanoms zu integrieren. Hierzu wurde eine selektive Lymphadenektomie durchgeführt; es wurden alle Lymphknoten der vermeintlich anatomisch zugeordneten Lymphknotenstation entfernt. Allerdings haben nahezu sämtliche Studien gezeigt, dass diese oft sehr invasiven chirurgischen Maßnahmen keinen positiven Einfluss auf die Lebenserwartung und das Überleben der Patienten haben.1 Darüber hinaus sind diese Eingriffe oft von beträchtlichen Nebenwirkungen wie z. B. Serombildung oder dem Auftreten von Lymphfisteln begleitet.
Um diese Morbiditäten zu reduzieren, hat sich in der chirurgischen Behandlung des primären Melanoms die Sentinel-Lymphknoten-Biopsie (SLN-Biopsie) durchgesetzt und gilt heute als etabliertes Verfahren, das in allen wissenschaftlichen Guidelines angeführt wird.
Die erstmalige Verwendung des Begriffes „glands sentinel“ geht auf das frühe 20. Jahrhundert zurück. Jedoch erst nach 1945 setzten die ersten Versuche ein, den SLN zu definieren und zu identifizieren. Die ersten Untersuchungen zur Darstellung des SLN mittels Farbstoff betrafen Penis- und Mammakarzinom2. Die ersten Untersuchungen der Darstellung des SLN beim Melanom wurden in den 1990er-Jahren von Morton und Mitarbeitern beschrieben und publiziert3.
Methodik der Darstellung des Sentinel-Lymphknotens
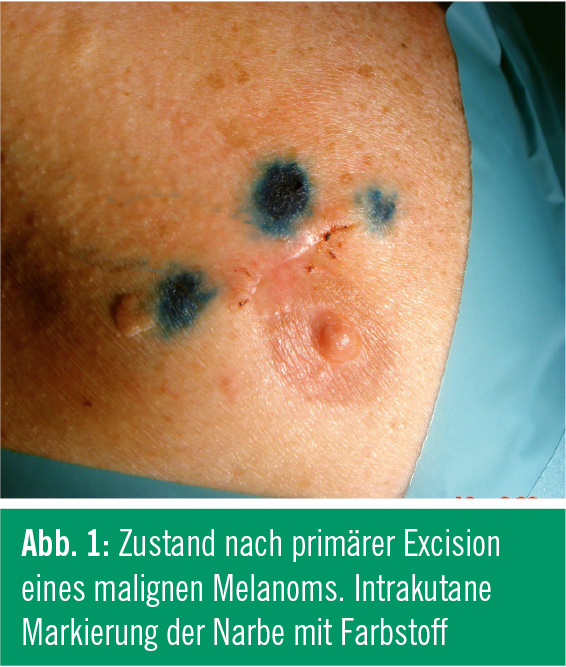
Grundsätzlich sind derzeit zwei Verfahren zur Darstellung des SLN in Anwendung. Einerseits wird ein geeigneter Farbstoff, z. B. Patentblau, intrakutan um den Tumor injiziert und dessen Abtransport über die Lymphe beobachtet (Abb.1).
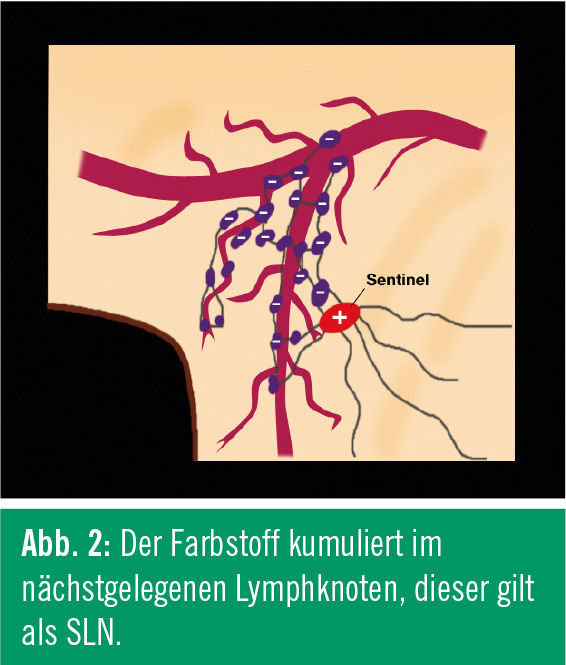
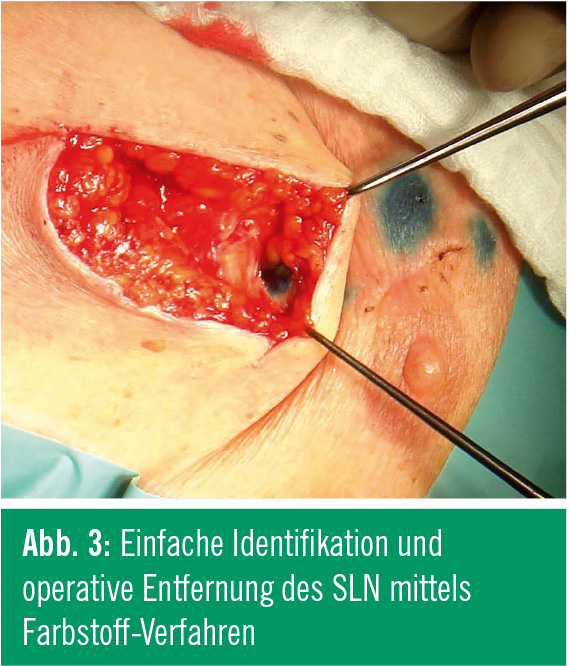
Der Farbstoff soll anschließend im nächstgelegenen Lymphknoten kumulieren. Dieser gilt als SLN (Abb. 2). Dieses Verfahren ermöglicht es, den SLN einfach zu identifizieren und operativ zu entfernen (Abb. 3).
Publikationen4, die bis heute Gültigkeit haben, zeigen, dass auch mit Technetium (Nukleotid 99Tc) beladene Nanokolloide (humanes Albumin) mit einer Partikelgröße von 20–80 nm die Rolle des Tracers übernehmen können. Dabei wird der Tracer bis zu 24 Stunden vor der Operation intrakutan um den Tumor appliziert. Der Vorteil besteht darin, dass mit einer Gammakamera präoperativ die Lymphknotenstation identifiziert wird und so die Hautoberfläche für den Chirurgen markiert werden kann, wodurch sich eine wesentliche Erleichterung für das chirurgische Vorgehen ergibt. Intraoperativ wird eine Gammasonde zur Identifikation des markierten SNL eingesetzt. Der so aufgefundene SLN wird chirurgisch abgesetzt, entfernt und einer histologischen Aufarbeitung zugeführt (Abb. 4).
Dieses Verfahren hat eine höhere Sensitivität als die Markierung mit einem Farbstoff. Die Erfolgsquote zur Auffindung des SLN mit Farbstoff alleine liegt bei etwa 85 % und steigt bei Kombination mit dem nuklearmedizinischen Tracer auf 99 %. Die Erfolgsquote mit nuklearmedizinischem Tracer alleine liegt bei 96 %. Sie gilt heute als Standard.
Die applizierte Strahlendosis bei Anwendung des Nukleotides liegt für den Patienten bei etwa 80 MBq. Die Strahlenbelastung für Operateur und OP-Team liegt hier bei weniger als 0,5 mSv pro Patient5.
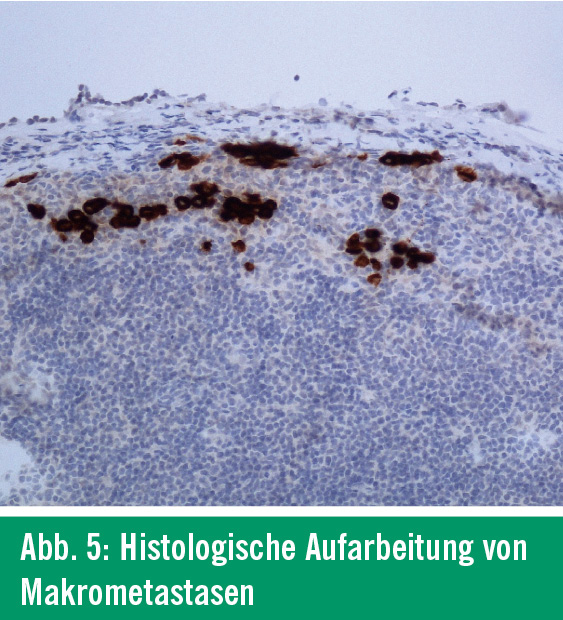
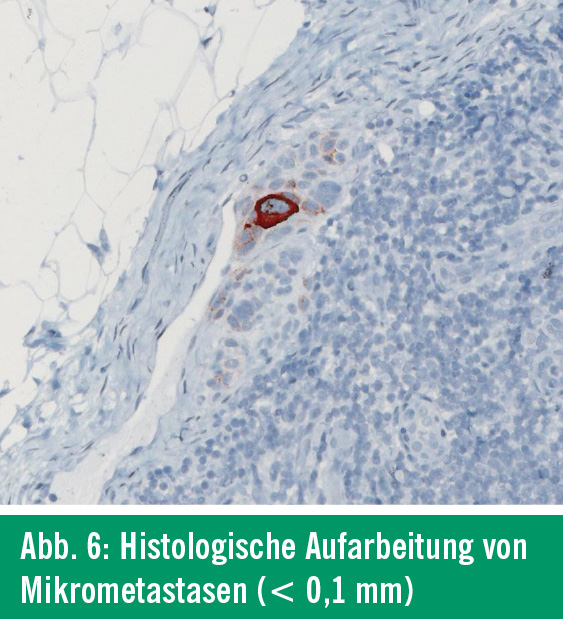
Histologie: Der SLN wird nach Fixierung in Formalin systematisch histologisch und immunhistologisch aufgearbeitet. Neben Standardfärbungen mit Hämatoxylin-Eosin werden monoklonale Antikörper gegen melanomzellassoziierte Proteine eingesetzt. Dazu zählen Antikörper gegen S-100, gegen Melanosomen (pan Melan) und der Antikörper HMB-45. Zur gänzlichen histologischen Aufarbeitung des SLN werden unterschiedliche Methoden angewendet. Arbeiten hierzu haben gezeigt, dass eine Längsaufarbeitung des SLN eine bessere Beurteilungsgrundlage schafft. Aufgefundene Metastasen werden vermessen, wobei Makrometastasen (Abb. 5) von Mikrometastasen (< 0,1mm; Abb. 6) unterschieden werden6. Dies ist von besonderer Bedeutung, da Mikrometastasen zwar diagnostisch relevant sind, aber keinen weiteren operativen Eingriff nach sich ziehen. Nur beim Nachweis von Makrometastasen wird eine anschließende Lymphadenektomie empfohlen.
Erfahrungen und Konsequenzen
Schon bald nach Einführung der SLN-Biopsie als Routineverfahren stellte sich heraus, dass mit zunehmender Tumordicke auch die positiven Ergebnisse beim SLN zunehmen. Während bei einer Tumordicke 1 mm Metastasen auf. In internationalen Guidelines wurde daraufhin die Entfernung des SLN bei primären Melanomen mit eine Tumordicke von > 1 mm empfohlen. Diese Empfehlung wurde auch relativ schnell in nahezu alle Leitlinien für die Melanomversorgung eingearbeitet (Österreich, Konsensuskonferenz 1998) und findet sich auch in den rezenten Guidelines der DDG/ÖGDV.
Allerdings wurden kürzlich Ergebnisse wissenschaftlicher Untersuchungen veröffentlicht, die zeigen, dass auch bei Melanomen mit einem Breslow-Index zwischen 0,76 und 1 mm 11 % der SLN Metastasen aufweisen, insbesondere, wenn zusätzlich histologische Prognosefaktoren wie Ulzeration oder hoher Mitoseindex vorlagen7–11. Diese Arbeiten implizieren, eine SLN-Entfernung auch bei Melanomen ab 0,76 mm Tumordicke nach Breslow zu überlegen.
Bei Makrometastasen ist die anschließende elektive Lymphadenektomie (ELND) Therapie der Wahl. Hierbei werden die dem SLN nachgeschalteten Lymphknoten der betroffenen Lymphknotenstation komplett entfernt.
Die Leitlinien der AWMF zur Versorgung des malignen Melanoms sehen keinen Vorteil für das Überleben durch eine ELND bei Mikrometastasen im SLN12. (Zu bemerken ist jedoch, dass sich die Leitlinie derzeit in Überarbeitung befindet.)
Prognostischer Wert des SLN
Die Bedeutung und der prognostische Wert des SLN wurden in den letzten 20 Jahren sehr kontroversiell diskutiert. Konnte eine Arbeitsgruppe im „Hautarzt“ 2000 noch mit Überzeugung formulieren: „Die übrigen etablierten Prognosefaktoren für das maligne Melanom wie die vertikale Eindringtiefe, Ulzeration u. a. verlieren bei einem bereits metastasierten Schildwachelymphknoten jede prognostische Relevanz“13, so muss diese Aussage aufgrund rezenter wissenschaftlicher Publikationen heute relativiert werden.
Wissenschaftlich bewiesen scheint, dass ein tumorpositiver SLN eine eindeutig schlechtere Prognose bezüglich der regionalen Lymphknotenmetastasierung, Progression und regionaler Rezidive darstellt14. Hingegen zeigt eine großangelegte Multicenterstudie mit 17.600 auswertbaren Patienten, dass bezogen auf Tumor und Überleben die aussagekräftigsten Prognoseparameter die Tumordicke einerseits und die Ulzeration andererseits darstellen (die Zahl der Mitosen ist ein Parameter, dessen Aussagekraft heute noch nicht vollständig geklärt ist)15. Bezüglich Lymphknotenbeteiligung und Überleben waren die Anzahl der positiven Lymphknoten und Exulzeration des Primärtumors die entscheidenden Kriterien. Weitere Studien zeigten, dass, bezogen auf das „overall survival“, Signifikanz nur für Ulzeration des Primärtumors, Tumordicke, Tumortyp, Lokalisation, Geschlecht und hohes Alter gegeben war16.
Bezüglich der Durchführung der SLN-Biopsie zeigten die 2005 publizierten Daten aus der MSLT-1-Studie (Multicenter Selective Lymphadenctomy Trial 1) jedoch, dass die primär einer SLN-Biopsie zugeführten Patienten keinen prognostischen Vorteil gegenüber jenen Patienten, bei denen Lymphknoten erst bei klinischer Auffälligkeit entfernt wurden, aufwiesen. Auch andere Arbeitsgruppen konnten zeigen, dass weder der positive SLN noch die sofort durchgeführte Lymphadenektomie bei positivem SLN Einfluss auf das Überleben haben17–19.
Zusammenfassend ist der Einfluss eines positiven SLN auf das allgemeine Überleben derzeit wissenschaftlich nicht vollständig geklärt. Sicher ist allerdings, dass andere Parameter wie Tumorulzeration und Eindringtiefe eine definierte und bewiesene prognostische Bedeutung haben, dass aber auch Faktoren wie Tumorart, Mitoserate, Lokalisation, Geschlecht und Alter des Patienten Einfluss auf die Prognose haben.
Untersuchungen über die Aussagekraft dieser Parameter sind in Arbeit, finden ständig Einfluss in die Klassifikation und dienen somit auch der Auswahl des geeigneten zielgerichteten Therapieverfahrens.