Die Pathophysiologie des atopischen Ekzems bei Kindern
Die Prävalenz des atopischen Ekzems (AE) hat in den letzten Jahrzehnten stetig zugenommen. Der Krankheitsbeginn liegt typischerweise im Säuglingsalter. Mit dem Eintritt in die Pubertät sinkt die Prävalenz ab. Ungefähr ein Drittel aller AE-Patienten ist zumindest heterozygoter Träger der 2007 berühmt gewordenen Filaggrin-Mutation. Das bedeutet aber auch gleichzeitig, dass bei zwei Drittel der Fälle andere Faktoren bzw. andere Gene involviert sind. Lebensmittelallergie ist das Hauptproblem beim kindlichen atopischen Ekzem. Die britische Arbeitsgruppe für das AE (UK Working Party) hat einen einfachen Algorithmus zur Diagnose des AE entwickelt, der mit juckender Haut ein obligatorisches Major-Kriterium und weitere drei von fünf Minor-Kriterien (Tab.) zur Diagnose AE verlangt.
Das AE ist eine chronische, häufig auftretende, entzündliche Hauterkrankung mit einem charakteristischen Phänotyp und Verteilungsmuster. In der Vergangenheit gab es mehrere Synonyme: Die historischen Begriffe „Neurodermitis“ und „Neurodermatitis“1 wurden später durch die Begriffe „atopische Dermatitis“ und schließlich „atopisches Ekzem“ ersetzt. 2 Der Terminus „atopisches Ekzem“ (AE) ist der 2004 von der World Allergy Organization (WAO) vorgeschlagene Begriff2 und wird in diesem Artikel verwendet. Seit Kurzem scheint auch in deutschen Leitlinien der alte Begriff „Neurodermitis“ wieder in Mode zu kommen.3
Prävalenz im Ansteigen
AE tritt oft gemeinsam mit allergischer Rhinokonjunktivitis und Asthma bronchiale auf. Deshalb werden diese drei oft auch als „atopische“ oder „allergische“ Erkrankungen zusammengefasst. Die höchste Inzidenz besteht im ersten Lebensjahrzehnt.4 Typischerweise tritt das AE im 1. Lebensjahr auf (als Differentialdiagnose zum seborrhoischen Säuglingsekzem aber erst nach dem 6. Lebensmonat), geht dann über in den Heuschnupfen, um über einen Etagenwechsel bei bis zu 50 % der Kinder im allergischen Asthma bronchiale zu enden. Dieser Verlauf wurde mit dem Terminus „atopischer Marsch“ belegt.5
Über die letzten Jahrzehnte ist die Prävalenz des AE weltweit kontinuierlich angestiegen und betrifft nun jedes 10. Kleinkind und jeden 50. Erwachsenen in den Industriestaaten.6 Die weltweit durchgeführte ISAAC-Studie in über 50 Ländern hat gezeigt, dass der Anstieg zwar abflacht, aber immer noch zunimmt.6 Wie kann man das erklären? Obwohl der genetische Hintergrund mit dem Filaggrin-Gen wieder mehr in den Vordergrund gerückt ist7, ändert sich das Genom nicht binnen einen Jahrhunderts und deshalb müssen andere Faktoren involviert sein. Der „westliche Lebensstil“ wurde oft als ein Grund dafür angesehen.8 Die Hygiene-Hypothese postuliert, dass das Fehlen von mikrobiellen und parasitischen Infektionen die volle Ausreifung des Immunsystems in einer zu sauberen Umwelt behindert und sich das „unterbeschäftigte“ Immunsystem deshalb von Toleranz auf Allergie „umprogrammiert“.9 In letzter Zeit wurde diese Hypothese allerdings wiederholt auch durch einen ihrer Erfinder, Johannes Ring, angezweifelt.10
Der „westliche Lebensstil“ beeinträchtigt auch die Barrierefunktion. Die Intensität der Körperpflege hat dramatisch zugenommen. Der durchschnittliche Wasserverbrauch zur Körperreinigung ist von 11 Litern 1961 auf 51 Liter 1997 angestiegen. 11 Der Umsatz an Seife und Waschdetergenzien im Vereinigten Königreich stieg von 76 Mio. £ 1981 auf 453 Mio. £ (inflationsbereinigt) 2001, während die Bevölkerungszahl stabil blieb.12 Dies dürfte auch einer der Gründe sein, warum ein hoher Bildungsstand in einer 2010 mit Medieninteresse bedachten oberösterreichischen Studie ein Risikofaktor für die Entwicklung eines AE bei Kindern sein dürfte.13 Das moderne Leben von Atopikern bringt vor allem in Innenräumen offenbar eine höhere Exposition gegenüber Indoor-Allergenen als bei Gesunden mit sich. Das zeigt z. B. eine Sensibilisierung von 33 % gegen Hausstaub- und Vorratsmilben bzw. 13 % gegen Katzenhaaren gegenüber 25 % und 4 % bei nicht-atopischen Kontrollen.14
Die physiologische Funktion der Haut als größtem menschlichen Organ ist es, eine Barriere zwischen Innen- und Außenwelt zu bilden und den Organismus vor Austrocknung und Xenobiotika zu schützen. Die äußerste Schicht der Epidermis besteht aus den extrem abgeplatteten Korneozyten, ähnlich wie Ziegel in einer Ziegelmauer. Corneodesmosomen verbinden diese Ziegel und erzeugen eine Widerstandskraft gegen Scherkräfte. Im Alltag werden die Corneodesmosomen durch endogene Serinproteasen gespalten und ermöglichen so das alltägliche, unbemerkte Abschilfern der obersten Epidermisschichten. Dieses Gleichgewicht kann leicht gestört werden. Das Hauptallergen der Hausstaubmilbe, Der p1, ist z.B. eine Cysteinprotease und kann ebenso wie Staphylokokkenproteasen die Epidermis ausdünnen; eine verringerte Proteasefunktion führt zu Schuppenbildung. Der Zement dieser oberen Epidermis-Ziegelmauer ist der Interzellularraum und besteht aus Ceramiden, Cholesterin, Cholesterinestern und Fettsäuren. Er wird auch als „Lipidlamelle“ bezeichnet.15 Die Hauptfunktion der Lipidlamelle ist es, vor Wasserverlust zu schützen. Milde Detergenzien, wie z. B. Seife, beeinträchtigen diese Funktion. CORK et al.12 spekulieren, dass die Dicke der Epidermis den Schlüssel hinter den Prädilektionsstellen des AE darstellt. Die Epidermis der Augenlider ist am dünnsten, gefolgt von Genitalien, Ellenbeugen und der posterioren, aurikulären Region. 12 Die Haut des Säuglings ist in Bezug auf die Epidermisdicke generell noch nicht ausgereift, was sie somit anfälliger macht als die dickere erwachsene Haut.16 Die geringe Dicke der Haut ist auch der Grund, warum Kortikosteroide sehr viel leichter durch die kindliche Haut penetrieren als durch die erwachsene.
Atopische Erkrankungen haben einen starken genetischen Hintergrund. PALMER et al. waren die ersten, die in ihrer berühmten Studie die Bedeutung von Filaggrin bei der reduzierten Barrierekapazität demonstrieren konnten.17 Selbst die nicht-entzündete Haut von Atopikern beinhaltet weniger Ceramide und Sphingosine als die Haut nicht-atopischer Kontrollen.15
Lebensmittelallergene sind die wichtigsten Auslöser von AE bei bis zu 35 % der Kleinkinder unter zwei Jahren.18 Milcheiweiß, Hühnerei, Soja, Weizen, Erdnuss, Baumnüsse, Fisch und Muscheln sind die wichtigsten Lebensmittelallergene, wobei Milch das Hauptallergen darstellt. Die Prognose für eine Lebensmittelallergie ist günstig. Mit Ausnahme von Erdnuss wachsen 80 % der Kinder bis zu ihrem 5. Geburtstag aus ihrer Lebensmittelallergie heraus.18 3,5–4% der jugendlichen Amerikaner haben spezifisches IgE auf Lebensmittel. 18 Diese zeigen aber statt AE eher typische Typ-1-allergische Symptome wie Urtikaria/Angioödem, gastrointestinale Symptome und Anaphylaxie.
Sensibilisierung gegen Aeroallergene wie Birke, Gras, Ragweed, Hausstaub und Katzenepithel rücken ab dem 2. Lebensjahr in den Vordergrund. Das Ausmaß der Sensibilisierung korreliert mit der Schwere des AE.19 Patienten mit primärer Pollensensibilisierung können die typischen Symptome einer sekundären Nahrungsmittelallergie aufweisen, wie das orale Allergie-Syndrom gegen Steinobst und Nüsse bei Birkenpollen-Allergie oder das Beifuß-Sellerie-Gewürz-Syndrom bei Sensibilisierung gegen Profilin.20
Klinisches Spektrum
Patienten mit AE leiden unter chronischem Juckreiz. Juckreiz hat mehrere pathophysiologische Dimensionen:
- Der zentrale „neurogene“ Juckreiz entsteht im ZNS auf Pruritogene wie bei Cholestase oder auf Morphine.21
- Der „psychogene“ Juckreiz entsteht im ZNS und wird durch emotionalen Stress verstärkt.22
- Der periphere „pruritorezeptive Juckreiz“ entsteht in entzündeter Haut.21
Juckreiz wird durch sensorische Nerven verursacht, die durch Histamin-1-, -2- und -3-Rezeptoren sowie durch Substanz P aktiviert werden. Mastzellen können diesen verstärken23 und finden sich vermehrt in läsionaler und nicht-läsionaler atopischer Haut.24 IL-31-Überexpression verursacht starken Juckreiz und führt bei Mäusen zu einer AE-artigen Dermatitis.25 IL-31 wird verstärkt in atopischer Haut exprimiert.26 Die Höhe des Serum-IL-31 ist bei Kindern auch mit der Schwere des Ekzems assoziiert.27
Exazerbationen des AE sind oft von Superinfektionen mit Staphylokokken (SA) und Herpes-Viren begleitet.28 SA sind nicht Teil der normalen Hautflora. Als Reservoir dienen oft die Nasenlöcher naher Angehöriger.29 Die menschliche Haut enthält antibakterielle Cathelicidine und β-Defensine, die die Ausbreitung von SA sowie Herpes-simplex-Viren behindern. Auch nicht-entzündliche atopische Haut enthält weniger von beiden als gesunde Normalhaut.30
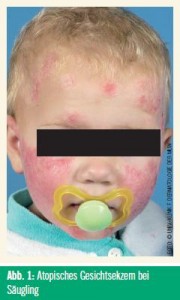
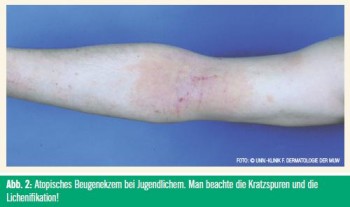
Patienten mit AE präsentieren sich je nach Lebensalter unterschiedlich. Säuglinge präsentieren sich mit einem Milchschorf am Skalp, etwas später mit Gesichtsekzemen (Abb 1). Kinder und Jugendliche leiden als Kardinalsymptom unter Beugenekzemen (Abb 2). Lidekzeme kommen bei 21 % der jungen Erwachsenen vor.31 Andere typische Varianten sind Nackenekzem, Handekzem und die atopischen Winterfüße (andere typische Charakteristika in Tab.). Das klinische Spektrum des AE ist breit und reicht vom Fingerspitzenekzem („Pulpitits sicca“) bis zur Erythrodermie.32, 33 Bei schweren Fällen sind Kratzspuren typische Zeichen des schweren Pruritus.
Diagnose
Gemäß der World Allergy Organization (WAO) sollte ein AE nur mit erhöhtem Total-IgE und Sensibilisierung gegen Aero- und Lebensmittelallergene, bewiesen durch Haut- oder Bluttests, diagnostiziert werden.2 Dieser Typ wird auch als extrinsisches AE bezeichnet.32 Im Gegensatz zum nicht mit Allergien assoziierten, intrinsischen Typ ist das extrinsische AE sehr viel häufiger und tritt früher im Leben auf. Die Prognose für Kleinkinder mit AE ist günstig, bereits 25 % haben es bis zum 5. Lebensjahr verloren34; 70 % verlieren ihr AE bis zum Eintritt in die Pubertät. 35
In Großbritannien wurden in den 1990er-Jahren sehr einfache Kriterien zur Diagnose des AE entwickelt (s. Tab.)36, die wesentlich besser im klinischen Alltag anwendbar waren als die ursprünglichen von Hanifin & Rajka.37 Die Sensitivität und Spezifität scheint übrigens nicht unterschiedlich zu sein.38
Ausblick auf das zukünftige Management
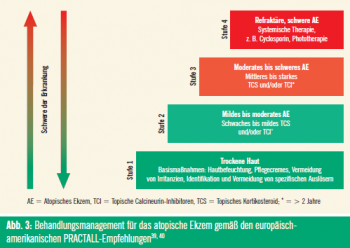
Abschließend haben wir in den letzten Jahren einiges über die Pathophysiologie des AE gelernt. Als wesentliche Erkenntnis aus der gestörten Barrierefunktion wurde die Pflege als Basis in die gemeinsame europäisch-amerikanische Leitlinie zum AE aufgenommen (Abb. 3).39, 40 Seit Einführung der topischen Calcineurin-Inhibitoren vor mehr als einem Jahrzehnt gab es keine pharmakologische Neueinführung im Bereich der Therapie des AE. Das einzige allergologische Biologikum, Anti-IgE, ist bei AE offensichtlich wirkungslos. 41 Nach diesen Jahren der Ernüchterung erscheint nun als erfreulicher Streifen am Horizont eine neue Generation von topischen Kortikosteroiden als Hoffnungsträger für die zukünftige Behandlung von Patienten mit AE.42
1 Novak N, Bieber T, Leung DY. Immune mechanisms leading to atopic dermatitis. J Allergy Clin Immunol. 2003 Dec; 112(6 Suppl): s128-39
2 Johansson SG, Bieber T, Dahl R, Friedmann PS, Lanier BQ, Lockey RF, et al., Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. The Journal of Allergy and Clinical Immunology. 2004 May; 113(5): 832-6
3 Werfel T, Aberer W, Augustin M, Biedermann T, Fölster-Holst R, Friedrichs F, et al., Neurodermitis S2-Leitlinie. Journal der Deutschen Dermatologischen Gesellschaft. 2009; 7(s1): s1-s46
4 Hamelmann E, Beyer K, Gruber C, Lau S, Matricardi PM, Nickel R et al., Primary prevention of allergy: Avoiding risk or providing protection? Clin Exp Allergy. 2007 Dec 12
5 Illi S, Von Mutius E, Lau S, Nickel R, Gruber C, Niggemann B, et al., The natural course of atopic dermatitis from birth to age 7 years and the association with asthma. J Allergy Clin Immunol. 2004 May; 113(5): 925-31
6 Asher MI, Montefort S, Björksten B, Lai CK, Strachan DP, Weiland SK, et al., Worldwide time trends in the prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and eczema in childhood: ISAAC Phases One and Three repeat multicountry cross-sectional surveys. Lancet. 2006 Aug 26; 368(9537): 733-43
7 Van Eerdewegh P, Little RD, Dupuis J, Del Mastro RG, Falls K, Simon J, et al., Association of the ADAM33 gene with asthma and bronchial hyperresponsiveness. Nature. 2002 Jul 25; 418(6896): 426-30
8 Prescott SL. Allergy: The price we pay for cleaner living? Ann Allergy Asthma Immunol. 2003 Jun; 90(6 Suppl 3): 64-70
9 Liu AH. Hygiene theory and allergy and asthma prevention. Paediatric and perinatal epidemiology. 2007 Nov; 21 Suppl 3: 2-7
10 Ring J, Krämer U, Behrendt H. A critical approach to the hygiene hypothesis. Clinical & Experimental Allergy Reviews. 2004; 4(s2): 40-4
11 Cork M, Murphy R, Carr J, Buttle D, Ward S, Båvik C, et al., The rising prevalence of atopic eczema and environmental trauma to the skin. Dermatology in Practice. 2002; 10(3): 22-6 12 Cork MJ, Robinson DA, Vasilopoulos Y, Ferguson A, Moustafa M, MacGowan A, et al., New perspectives on epidermal barrier dysfunction in atopic dermatitis: Gene-environment interactions. J Allergy Clin Immunol. 2006 Jul; 118(1): 3-21
13 Weber AS, Haidinger G. The prevalence of atopic dermatitis in children is influenced by their parents’ education: Results of two cross-sectional studies conducted in Upper Austria. Pediatr Allergy Immunol. 2010 Nov; 21(7): 1028-35
14 Jovanovic S, Felder-Kennel A, Gabrio T, Kouros B, Link B, Maisner V, et al., Exposition und Sensibilisierung gegenüber Milben- und Katzenaller – genen bei Kindern in Baden-Württemberg. Gesundheitswesen (Bundesverband der Arzte des öffentlichen Gesundheitsdienstes (Germany)). 2003 Jul; 65(7): 457-63
15 Holleran WM, Takagi Y, Uchida Y. Epidermal sphingolipids: Metabolism, function, and roles in skin disorders. FEBS Letters. 2006; 580(23): 5456-66
16 Chiou YB, Blume-Peytavi U. Stratum Corneum Maturation. Skin Pharmacology and Physiology. 2004; 17(2): 57-66
17 Palmer CN, Irvine AD, Terron-Kwiatkowski A, Zhao Y, Liao H, Lee SP, et al., Common loss-of-function variants of the epidermal barrier protein Filaggrin are a major predisposing factor for atopic dermatitis. Nature genetics. 2006 Apr; 38(4): 441-6
18 Sampson HA. Update on food allergy. J Allergy Clin Immunol. 2004 May; 113(5): 805-19; quiz 20
19 Scalabrin DM, Bavbek S, Perzanowski MS, Wilson BB, Platts-Mills TA, Wheatley LM. Use of specific IgE in assessing the relevance of fungal and dust mite allergens to atopic dermatitis: A comparison with asthmatic and nonasthmatic control subjects. J Allergy Clin Immunol. 1999 Dec; 104(6): 1273-9
20 Werfel T, Ballmer-Weber B, Eigenmann PA, Niggemann B, Rance F, Turjanmaa K, et al., Eczematous reactions to food in atopic eczema: Posi – tion paper of the EAACI and GA²LEN. Allergy. 2007 Jul; 62(7): 723-8
21 Greaves MW. Recent advances in pathophysiology and current management of itch. Annals of the Academy of Medicine, Singapore. 2007 Sep; 36(9): 788-92
22 Maintz L, Novak N. Getting more and more complex: The pathophysiology of atopic eczema. Eur J Dermatol. 2007 Jul-Aug; 17(4): 267-83
23 Rukwied R, Lischetzki G, McGlone F, Heyer G, Schmelz M. Mast cell mediators other than histamine induce pruritus in atopic dermatitis patients: A dermal microdialysis study. The British journal of dermatology. 2000 Jun; 142(6): 1114-20
24 Badertscher K, Bronnimann M, Karlen S, Braathen LR, Yawalkar N. Mast cell chymase is increased in chronic atopic dermatitis but not in psoriasis. Archives of dermatological research. 2005 Apr; 296(10): 503-6
25 Dillon SR, Sprecher C, Hammond A, Bilsborough J, Rosenfeld-Franklin M, Presnell SR, et al., Interleukin 31, a cytokine produced by activated T-cells, induces dermatitis in mice. Nature immunology. 2004 Jul; 5(7): 752-60
26 Bilsborough J, Leung DY, Maurer M, Howell M, Boguniewicz M, Yao L, et al., IL-31 is associated with cutaneous lymphocyte antigen-positive skin homing T-cells in patients with atopic dermatitis. J Allergy Clin Immunol. 2006 Feb; 117(2): 418-25
27 Ezzat MHM, Hasan ZE, Shaheen KYA. Serum measurement of Interleukin- 31 (IL-31) in paediatric atopic dermatitis: Elevated levels correlate with severity scoring. Journal of the European Academy of Dermatology and Venereology. 2011; 25(3): 334-9
28 Abeck D, Mempel M. Kutane Staphylococcus-aureus-Besiedelung des atopischen Ekzems. Hautarzt. 1998 Dec; 49(12): 902-6
29 Chiu LS, Chow VC, Ling JM, Hon KL. Staphylococcus aureus carriage in the anterior nares of close contacts of patients with atopic dermatitis. Arch Dermatol. 2010 Jul; 146(7): 748-52 30 Ong PY, Ohtake T, Brandt C, Strickland I, Boguniewicz M, Ganz T, et al., Endogenous antimicrobial peptides and skin infections in atopic dermatitis. The New England journal of Medicine. 2002 Oct 10; 347(15): 1151-60
31 Schudel P, Wüthrich B. Klinische Verlaufsbeobachtungen bei Neurodermitis atopica nach dem Kleinkindesalter. Eine katamnestische Untersuchung anhand von 121 Fällen. H+G Zeitschrift für Hautkrankheiten. 1985; 60(6): 479-86
32 Pugliarello S, Cozzi A, Gisondi P, Girolomoni G. Phenotypes of atopic dermatitis. JDDG: Journal der Deutschen Dermatologischen Gesellschaft. 2011; 9(1): 12-20
33 Leung DY, Bieber T. Atopic dermatitis. Lancet. 2003 Jan 11; 361(9352): 151-60
34 Horwitz AA, Hossain J, Yousef E. Correlates of outcome for atopic dermatitis. Ann Allergy Asthma Immunol. 2009 Aug; 103(2): 146-51
35 Bieber T. Atopic dermatitis. N Engl J Med. 2008 Apr 3; 358(14): 1483-94
36 Williams HC, Burney PG, Hay RJ, Archer CB, Shipley MJ, Hunter JJ, et al., The U.K. Working Party’s Diagnostic Criteria for Atopic Dermatitis. I. Derivation of a minimum set of discriminators for atopic dermatitis. The British Journal of Dermatology. 1994 Sep; 131(3): 383-96
37 Hanifin J, Rajka G. Diagnostic features of atopic dermatitis. Acta Derm Venereol (Stockh). 1980; 92 Suppl: 44s-7s
38 Jøhnke H, Vach W, Norberg LA, Bindslev-Jensen C, Host A, Andersen KE. A comparison between criteria for diagnosing atopic eczema in infants. Br J Dermatol. 2005 Aug; 153(2): 352-8
39 Akdis CA, Akdis M, Bieber T, Bindslev-Jensen C, Boguniewicz M, Eigenmann P, et al., Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology/American Academy of Allergy, Asthma and Immunology/PRACTALL Consensus Report. J Allergy Clin Immunol. 2006 Jul; 118(1): 152-69 40 Akdis CA, Akdis M, Bieber T, Bindslev-Jensen C, Boguniewicz M, Eigenmann P, et al., Diagnosis and treatment of atopic dermatitis in children and adults: European Academy of Allergology and Clinical Immunology/American Academy of Allergy, Asthma and Immunology/PRACTALL Consensus Report. Allergy. 2006 Aug; 61(8): 969-87
41 Heil PM, Maurer D, Klein B, Hultsch T, Stingl G. Omalizumab therapy in atopic dermatitis: Depletion of IgE does not improve the clinical course – a randomized, placebo-controlled and double blind pilot study. J Dtsch Dermatol Ges. 2010 Dec; 8(12): 990-8
42 Luger TA. Balancing efficacy and safety in the management of atopic dermatitis: The role of methylprednisolone aceponate. Journal of the European Academy of Dermatology and Venereology. 2011; 25(3): 251-8