Im Trend: frühere Stadien therapieren, auf Kombinationen setzen: Neue Therapien für das Melanom
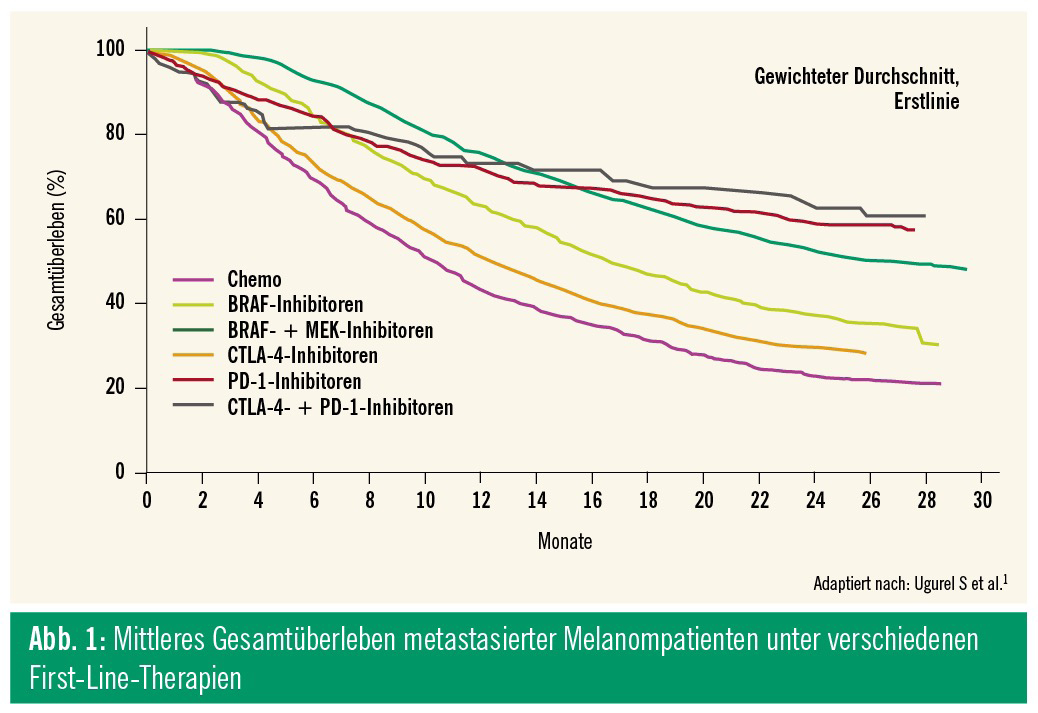
In den letzten Jahren wurden in der Therapie des Melanoms neue Standards etabliert, die sowohl im palliativen als auch im adjuvanten Setting erhebliche Verbesserungen hinsichtlich der Wirksamkeit gebracht haben. So konnte durch den Einsatz der molekular gezielten Therapie mit BRAF- und MEK-Inhibitoren oder der Immuntherapie mit Checkpoint-Inhibitoren wie CTLA-4- oder PD-1-blockierenden Antikörpern sowie der intraläsionalen Therapie mit Talimogen laherparepvec (TVEC) das mittlere Gesamtüberleben von metastasierten Melanompatienten in manchen klinischen Studien – auch unter reger Beteiligung österreichischer Zentren – bereits von 6 bis 12 Monaten zu Zeiten der Chemotherapie auf etwa 3 Jahre angehoben werden (Abb. 1). Zusätzlich wird bei knapp 20 % der Patienten eine komplette Rückbildung aller Metastasen erreicht.1 Durch die vor kurzem erfolgte Zulassung der modernen Therapien im adjuvanten Setting konnte die Rückfallrate bei Patienten nach komplett operierter Lymphknotenmetastasierung um die Hälfte reduziert werden, wodurch vielen Patienten das Schicksal einer inoperablen Metastasierung erspart werden wird.2–4
Trotz all dieser Erfolge verstirbt aber nach wie vor die Mehrheit der metastasierten Melanompatienten schlussendlich an der Tumorerkrankung. Es ist daher wesentlich für Patienten, welche auf die bisherigen Therapien nicht optimal ansprechen, weitere therapeutische Möglichkeiten zu evaluieren.
Adjuvante/neoadjuvante Therapie
Zum einen wird, wie schon zuvor im metastasierten Setting, die Kombination der Blockade des PD-1- und des CTLA-4-Rezeptors getestet, welche im palliativen Setting die derzeit effektivste Variante der Immuntherapie darstellt. Allerdings wird die hohe Effektivität auch durch eine hohe Rate an schweren immunvermittelten Nebenwirkungen („immune-related adverse events“, irAE) erkauft. Bereits in der adjuvanten Studie EORTC 18071/CheckMate 029 (Ipilimumab 10 mg/kg vs. Placebo)5 wurde beobachtet, dass bei tumorfrei operierten Patienten im Vergleich zu inoperabel metastasierten Patienten eine deutlich höhere Rate an irAEs auftritt. Es wurde daher für die Studie CheckMate 915 eine Kombination aus regulärer Dosierung des PD-1-Antikörpers Nivolumab mit einer reduzierten Dosis von 1 mg/kg Ipilimumab alle 6 Wochen gewählt, um einen Kompromiss hinsichtlich Wirksamkeit und Verträglichkeit zu erreichen. Zusätzlich wurden nur Patienten ab Stadium IIIB bis zu komplett reseziertem Stadium IV – also Patienten mit einem höheren Rückfallrisiko – eingeschlossen. Daten aus dieser Studie liegen derzeit noch nicht vor.
Zum anderen wird der Tatsache Rechnung getragen, dass Patienten mit dickeren Primärtumoren in Stadium IIB und IIC ein vergleichbares Metastasierungsrisiko haben wie Patienten nach Lymphknotenmetastasierung im Stadium IIIB. Daher erscheint es logisch, Patienten mit einem ähnlichen Risiko auch gleich zu behandeln. In der Studie KEYNOTE-716, die leider nicht in Österreich rekrutiert, werden derzeit Patienten im Stadium IIB und IIC über ein Jahr mit dem PD-1-Antikörper Pembrolizumab, verglichen mit Placebo, behandelt. Studien mit dem PD-1-Antikörper Nivolumab und BRAF/MEK-Inhibitoren sind in Vorbereitung. Eine wesentliche Frage bei einer doch so deutlichen Ausweitung der Patientengruppe, sowie generell im adjuvanten Setting, ist die nach der optimalen Dauer der adjuvanten Therapie. Insbesondere bei der Immuntherapie wäre eine Evaluierung einer kürzeren Therapiedauer sehr wünschenswert, da aktuelle Daten darauf hinweisen, dass die wesentlichen Veränderungen, die über das Ansprechen auf eine Immuntherapie entscheiden, bereits sehr früh beobachtet werden können. Leider wird diese Frage, die sowohl für die Akzeptanz der Therapie bei den Patienten als auch bei den Kostenträgern wesentlich wäre, derzeit noch von keiner der geplanten Studien aufgegriffen.
Wie im metastasierten Setting stellt sich auch im adjuvanten Setting die Frage, ob es bei BRAF-mutierten Patienten sinnvoll ist, das rasche und hohe Ansprechen der BRAF/MEK-Inhibitoren mit dem möglichen Vorteil des langfristigen Ansprechens der Immuntherapie durch eine vorgeplante sequenzielle Gabe zu kombinieren. Die Melanomgruppe der EORTC bereitet derzeit eine Studie zu dieser Fragestellung vor.
Die Evaluierung des neoadjuvanten Therapieprinzips ist eine der spannendsten Neuerungen beim Melanom. Hier wird eine systemische Therapie vor der operativen Sanierung von Metastasen verabreicht, um einerseits die Rate an kompletten Resektionen zu erhöhen, andererseits aber auch die mögliche Rückfallquote durch Reduktion von subklinischen Mikrometastasen bzw. durch die Induktion einer Tumor-Immunantwort zu senken. Zur neoadjuvanten Immuntherapie wurden rezent zwei Studien publiziert, die unterschiedliche Aspekte dieser Therapie beleuchten. Das Team um Christian Blank vom Netherlands Cancer Institute in Amsterdam verglich eine adjuvante vs. eine neoadjuvante Therapie mit der Kombination aus 3 mg/kg Ipilimumab und 1 mg/kg Nivolumab bei 20 Patienten mit klinisch detektierten lokoregionären Lymphknotenmetastasen.6 Hierbei zeigte sich bei 9 von 10 Patienten im neoadjuvanten Arm eine nahezu- bzw. komplette Rückbildung der Lymphknotenmetastase(n) sowie ein Trend hinsichtlich eines besseren rezidivfreien Überlebens der neoadjuvant behandelten Patienten. Dieses bessere Ansprechen war mit einer höheren Rate an neuen, vor der Therapie nicht bestehenden, tumorreaktiven T-Zell-Klonen in der neoadjuvanten Gruppe assoziiert. Das Team um Jennifer Wargo vom MD Anderson Cancer Center in Houston, Texas, verglich eine neoadjuvante Therapie mit einem PD-1-Inhibitor gegen eine Kombination aus PD-1- und CTLA-4-Inhibitor und fand eine deutlich höhere Ansprechrate unter der Kombinationstherapie.7 In beiden Studien zeigte sich aber auch eine außergewöhnlich hohe Rate von 90 % an hochgradigen irAEs unter der PD-1- und CTLA-4-Inhibitor-Kombination. Dies konnte aber bereits in einer Folgestudie durch eine Reduktion der Dosierung von Ipilimumab auf 1 mg/kg deutlich verbessert werden.
Aktuell wird aufgrund der hohen pathologischen Remissionsrate in der PRADO-Studie bereits die Frage untersucht, ob eine medikamentöse neoadjuvante Therapie, insbesondere mit der Kombination aus Ipilimumab und Nivolumab, eine nachfolgende Operation bei gutem Ansprechen eventuell unnötig machen könnte.
Ebenso wurde ein Vergleich zwischen einer neoadjuvanten präoperativen, gefolgt von einer adjuvanten postoperativen, Therapie mit Dabrafenib und Trametinib bei einer kleinen Gruppe von BRAF-mutierten Patienten mit operabler lokoregionärer oder Fernmetastasierung und postoperativer „Standard of Care“-Therapie durchgeführt.8 Es zeigte sich in der Gruppe mit neoadjuvanter und adjuvanter Therapie eine deutliche Verbesserung des rückfallfreien Überlebens, insbesondere wenn im OP-Präparat bereits eine komplette Rückbildung der Metastase beobachtet wurde.
Fraglich ist, ob es angesichts der sehr guten Daten zur adjuvanten Therapie je zu einer größeren, formalen Vergleichsstudie zwischen neoadjuvanter und adjuvanter Therapie kommen wird, da die benötigte Patientenanzahl sehr hoch wäre. Wahrscheinlich ist, dass sich die neoadjuvante Therapie als „Sonderanwendung“ bei ausgewählten Patienten auch ohne eine solche Studie etablieren wird.
Therapie des inoperabel metastasierten Melanoms
Im palliativen Setting liegt der Fokus auf neuen Kombinationstherapien, wobei nahezu jede Kombination einen PD-1/PD-L1-Antikörper als „Backbone“ enthält. Der Schwerpunkt liegt also eindeutig auf einer verbesserten Immuntherapie, auch wenn die Kombinationspartner nicht immer primär immunologische Angriffspunkte haben müssen.
So wird in zwei randomisierten Phase-III-Studien (COMB-I und TRILOGY) bei BRAF-mutierten Patienten jeweils eine Kombination aus einem PD-1- bzw. PD-L1-Antikörper (Spartalizumab, Atezolizumab) und einer BRAF/MEK-Inhibitor-Kombination (Dabrafenib/Trametinib, Vemurafenib/Cobimetinib) im Vergleich zu einer BRAF/MEK-Inhibitor-Komb
ination alleine untersucht. Erste Daten aus beiden Studien werden für das ESMO-Meeting im Herbst erwartet und werden zeigen, ob eine initiale Dreifachtherapie bessere Effektivität aufweist und auch eine akzeptable Verträglichkeit hat. Leider wurde im Studiendesign bei beiden Studien nicht darauf geachtet, einen Vergleichsarm mit einer kontrollierten sequenziellen Anwendung von Immuntherapie und gezielter Therapie einzuschließen, oder die Therapie speziell bei Patienten mit einem höheren Risikoprofil (hohe Tumorlast, hohe LDH etc.) – dem wahrscheinlichsten Einsatzgebiet einer Triple-Therapie – zu erproben. Sollten die Ergebnisse also keine durchschlagende Verbesserung zeigen, könnten diese Studien eher zu neuen offenen Fragen als zu einem neuen Therapiestandard führen.
Im Bereich der immuntherapeutischen Kombinationen kommt es, neben der Kombination des PD-1-Antikörpers Nivolumab mit einem Antikörper gegen einen neuen Immun-Checkpoint, LAG-3, oder mit dem bereits zugelassenen onkolytischen Virus TVEC, auch zu einem „Revival“ von Interleukin-(IL-)2 – allerdings in einer veränderten Form. NKTR-214 ist eine PEGylierte Prodrug von IL-2. Die PEGylierung ist so lokalisiert, dass sie die Bindung an die α-Untereinheit des IL-2-Rezeptors (IL-2R) und damit an den IL-2Rαβγ-Komplex reduziert, welcher vor allem auf regulatorischen T-Zellen vorkommt. Dadurch kommt es zu einer präferenziellen Bindung an IL-2Rβγ, welcher vor allem auf zytotoxischen T-Zellen und NK-Zellen exprimiert wird. Darüber hinaus führt die veränderte Formulierung auch zu einer besseren Verträglichkeit; insbesondere kommt es nicht mehr zum Auftreten des unter klassischem Hochdosis-IL-2 beobachteten „vascular leak syndrome“, das eine stationäre Behandlung in einem ICU-Setting notwendig machte.
Daneben gibt es eine Vielzahl weiterer früher Kombinationsstudien, bei denen unterschiedliche immunologische Angriffspunkte – Makrophagen, NK-Zellen, regulatorische T-Zellen, myeloide Suppressorzellen u. a. – als Angriffspunkte dienen.
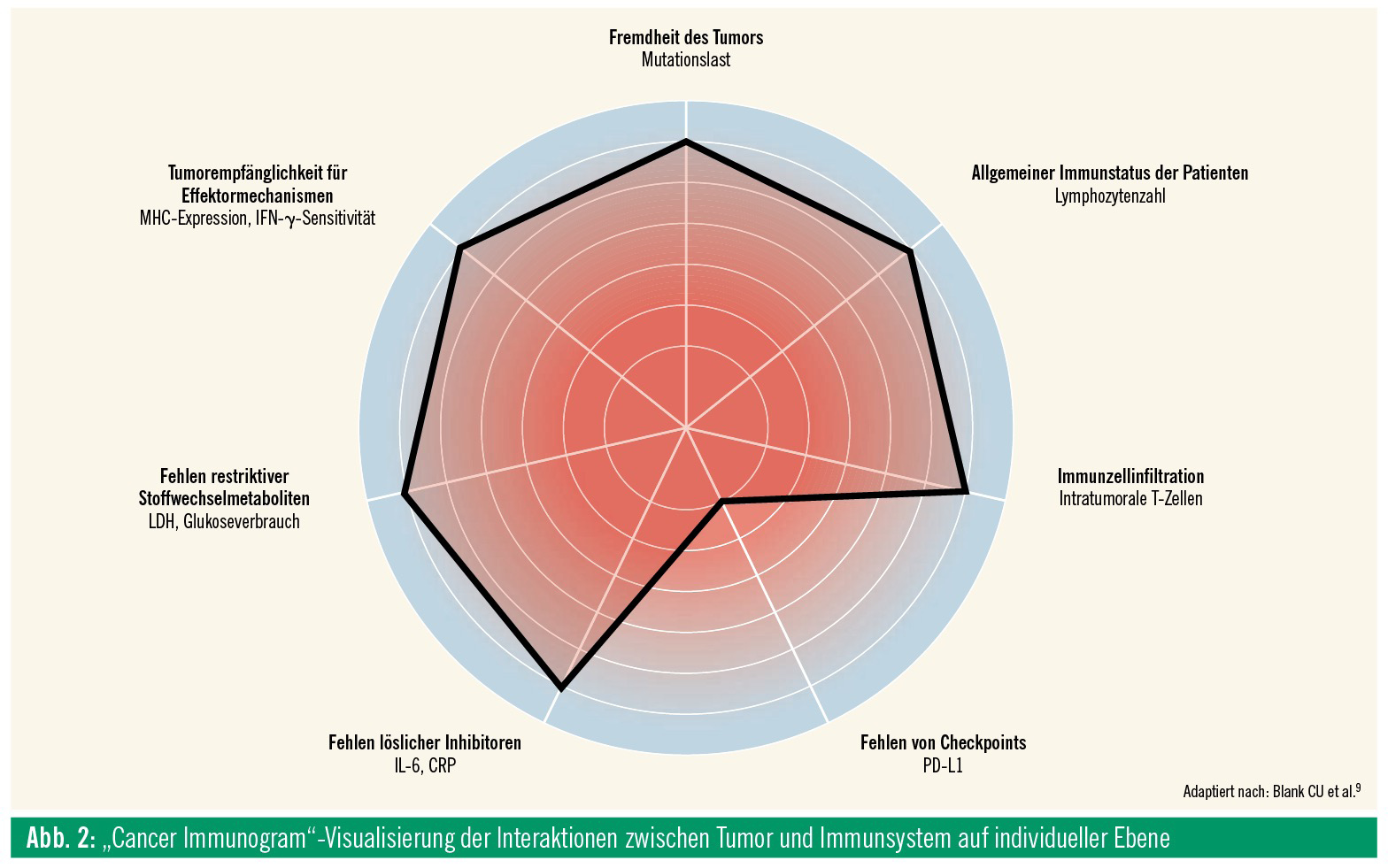
Derzeit werden die meisten dieser Studien noch an relativ nichtselektionierten Patientengruppen getestet. Angesichts der Vielzahl an unterschiedlichen Kombinationen wird es jedoch notwendig werden, Modelle zum Verständnis individueller Defekte der Tumorimmunität, wie z. B. das „Cancer Immunogram“9 (Abb. 2), vom theoretischen Denkmodell zu einer praktischen Anwendung hin zu entwickeln, um solche Defekte gezielt behandeln zu können. Weltweit sind erste, meist akademische Studien, die sich bemühen, eine Analyse der individuellen tumorimmunologischen Situation eines Patienten mit einer dazu passenden Therapie zu verbinden, bereits im Anlaufen.