Aus der Sicht des Angiologen
Das abdominelle Aortenaneurysma (AAA) gehört zu den dilatativen Arteriopathien. Es ist meist mit Arteriosklerose assoziiert und daher eine Erkrankung des höheren Lebensalters. Die Prävalenz klinisch relevanter AAA (Durchmesser über 4,0 cm) steigt um 2 bis 4 % pro Lebensdekade. Bei über 65-Jährigen liegt die Prävalenz bei 4 bis 8 %. Frauen sind mit einer Prävalenz von 1,3 % deutlich seltener betroffen. Die Inzidenz wird mit 40 Erkrankungen auf 100.000 Einwohner pro Jahr geschätzt. Sie ist in den letzten Jahrzehnten unabhängig von den verbesserten Diagnosemöglichkeiten gestiegen. Ebenso ist die Zahl der Eingriffe an der abdominellen Aorta gestiegen.
Definition: Der normale Durchmesser der Aorta beträgt 15 bis 24 mm. Von einem Aneurysma spricht man bei einem Durchmesser von über 30 mm oder über das 1,5-Fache des Aortendurchmessers auf Höhe der Nierenarterien. Etwa 90 % aller aortalen Aneurysmen liegen infrarenal.
Ätiologie und Pathogenese: Beim AAA kommt es im Gegensatz zu den thorakalen Aneurysmen (Verlust der glatten Muskelzellen) zu einem Verlust elastischer Fasern in der Media der Gefäßwand und zu einem Widerstandsverlust der Wand gegen den Gefäßinnendruck. Die Degeneration der elastischen Fasern ist in dem meisten Fällen arteriosklerotisch bedingt, seltener ist es die Folge eines genetischen Defekts wie z. B. beim Marfan-Syndrom oder idiopathisch wie bei der zystischen Medianekrose. Auch eine inflammatorische Genese ist selten. Solche Aneurysmen findet man viel häufiger im Aortenbogenbereich. Dort hat eine retrospektive Studie mit 1.600 Patienten gezeigt, dass in bis zu 30 % der Fälle eine Riesenzellarteriitis nachgewiesen werden konnte.
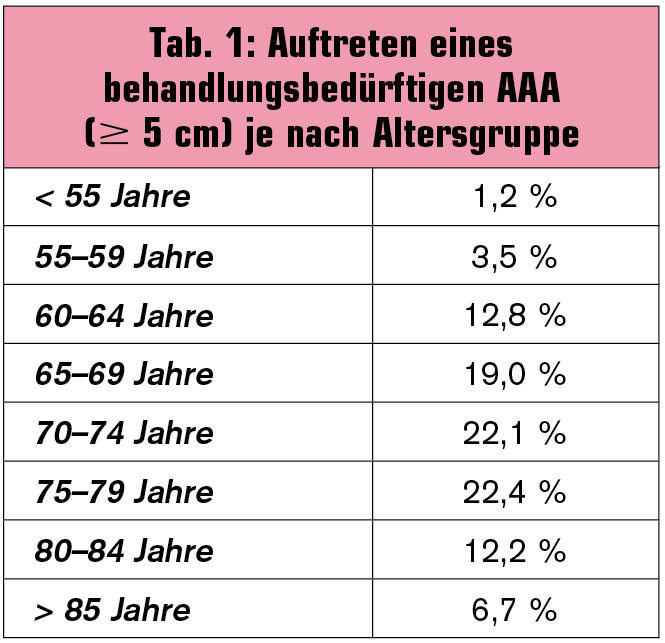
Risikofaktoren: Der Zusammenhang mit zunehmendem Alter ist bereits erwähnt worden. Tab. 1 zeigt das Auftreten von behandlungswürdigen AAA nach Altersgruppe geordnet. Weitere nicht beeinflussbare Risikofaktoren sind eine positive Familienanamnese (8-fach erhöhtes Risiko für Geschwister), genetische Assoziationen (z. B. Kollagen-Typ-III-Gen) und männliches Geschlecht. Einen klaren Zusammenhang gibt es zwischen Nikotinabusus, dem wichtigsten Risikofaktor, sowie systolisch und diastolisch erhöhtem Blutdruck. Gesamtcholesterin und BMI haben wahrscheinlich keinen Einfluss. Diabetiker haben sogar ein geringeres Risiko, ein AAA zu entwickeln.
Einteilung: Wichtig ist die Unterscheidung zwischen echten Aneurysmen, die alle 3 Wandschichten betreffen, und falschen Aneurysmen, bei denen es sich um eine umschriebene Wandläsion handelt, z. B. bei mykotischen oder traumatischen Aneurysmen (Aneurysma spurium). Die wahren Aneurysmen werden in fusiforme mit symmetrischer Dilatation oder sackförmige mit lokalisierter einseitiger Ausweitung der Aortenwand unterteilt.
Klinik: Das rupturierte Aortenaneurysma präsentiert sich oft als (manchmal leider fehldiagnostiziertes) akutes Abdomen. Pulsationen, Schmerzen im Brustkorb, im Bereich der LWS oder des Skrotums sowie Druckschmerzhaftigkeit treten bei Größenzunahme auf und sind als Alarmsymptome zu deuten. Weitere Symptome sind Embolien in die Peripherie, oft sehr diskret akral ausgebildet. Die Klinik der Embolisation richtet sich nach Lokalisation und Größe des verschlossenen Gefäßes. Große Aneurysmen können auch Nachbarorgane mit entsprechender Symptomatik verdrängen. Es ist aber zu betonen, dass die Mehrzahl der Aneurysmen bis zur Ruptur asymptomatisch bleiben.
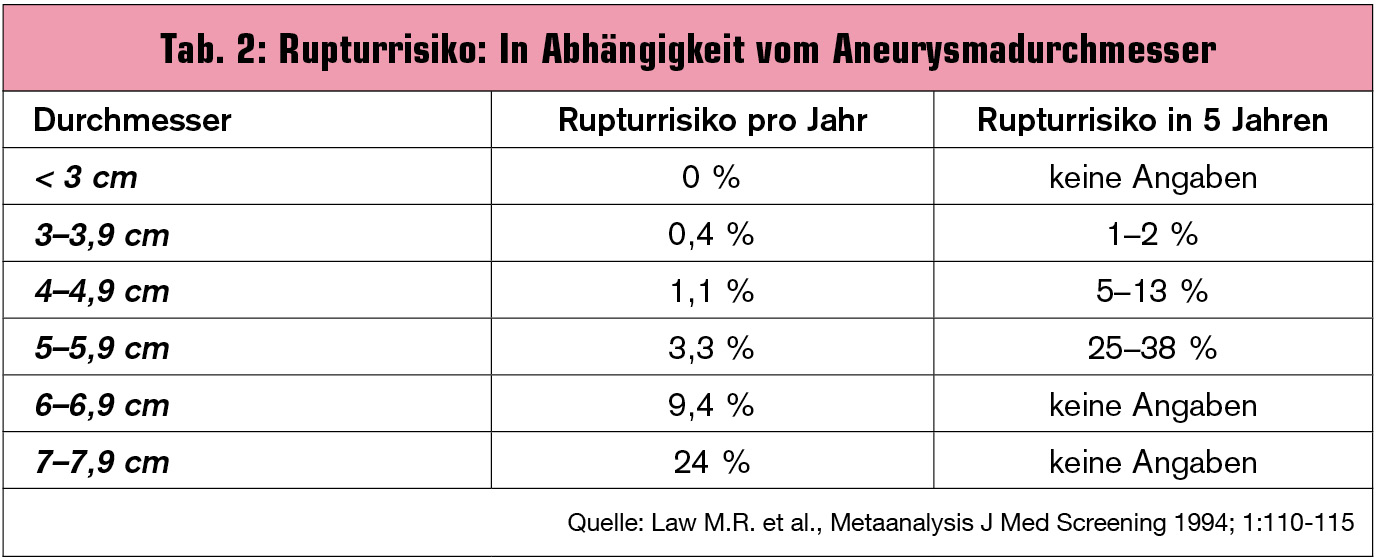
Rupturrisiko – Prognose – Mortalität: Tab. 2 zeigt das Rupturrisiko in Abhängigkeit vom Aneurysmadurchmesser. Der maximale transversale Durchmesser ist das wichtigste prognostische Kriterium. Weitere Risikofaktoren für eine Ruptur sind:
Beim rupturierten AAA beträgt die Gesamtmortalität 80 %, die Krankenhausmortalität 55 %. In der Gruppe der über 65-Jährigen ist jeder 50. Todesfall durch die Ruptur eines AAA verursacht. Zu berücksichtigen ist sicherlich auch eine hohe Dunkelziffer bei nicht obduzierten Patienten, die mit der Diagnose Bauch- oder Rückenschmerzen verstorben sind.
Diagnose: Die Diagnose erfolgt sonografisch, vorzugsweise wenn der Patient nüchtern ist. Die Sensitivität der Untersuchung beträgt 100 %. Die Abbildung zeigt ein typisches sonografisches Bild.
Die CT ist meist nur zur Vorbereitung vor Eingriffen zur Darstellung der Wandbeschaffenheit, Bezug zu Nachbarorganen und zur Anatomie der von der Aorta abgehenden Äste notwendig. MR-Angiografie (es wird nur das mit Blut durchflossene Lumen dargestellt) und Angiografie sind für die Routinediagnostik ungeeignet.
Screening: Grundlagen der Sinnhaftigkeit eines Screenings sind 4 populationsbasierte, randomisierte und kontrollierte Studien (CHICHESTER-Studie/UK, MASS-Studie/UK, westaustralische Aneurysmascreening-Studie und WIBORG-Studie/DK). In der Metaanalyse dieser Studien wurde eine signifikante Reduktion der aneurysmabedingten Letalität in gescreenten Kollektiven errechnet. Die Wahrscheinlichkeit, dass ein AAA rupturiert, sank um 47 %. Die Zahl der geplanten Operationen stieg auf das 3-Fache, die Zahl der Notoperationen reduzierte sich um 45 %. Teilnehmer des Screeningkollektivs, die das Screening ablehnten, hatten in allen Aspekten ein höheres Risiko.
Trotz dieser eindrücklichen Zahlen wird ein unstrukturiertes Screening nicht empfohlen (viele nicht therapiebedürftige Aneurysmen werden entdeckt, die Lebensqualität dieser Patienten sinkt, die Kosteneffizienz ist fraglich). Ein Screening bringt nur Vorteile, wenn Risikogruppen definiert werden.
Dies sind:
Therapie: Die konservative Therapie beinhaltet die Beeinflussung der behandelbaren Risikofaktoren. So hat z. B. ein Patient, der das Rauchen aufgegeben hat, nur mehr ein erhöhtes Risiko um den Faktor 1,5. Weiters wird die Entwicklung einer COPD gebremst, und auch das allgemeine kardiovaskuläre Risiko sinkt. Neben der üblichen Behandlung aller anderen kardiovaskulären Risikofaktoren gibt es auch neue pharmakologische Ansatzpunkte, dafür liegen allerdings noch wenige Daten vor. Ein solcher Ansatzpunkt wäre die Verabreichung von Makrolidantibiotika oder Doxyzyklin. Beide Substanzen hemmen Metalloproteasen und damit das Aneurysmawachstum. Gut belegt ist die Wirkung von Statinen im Sinne einer antiinflammatorischen Therapie. ACE-Hemmer haben neben der blutdrucksenkenden Wirkung auch einen protektiven Effekt auf die Aortenwand. Der Wert von Betablockern ist diesbezüglich unklar. Zum konservativen Therapiespektrum gehört auch die regelmäßige Kontrolle der Patienten: Misst das Aneurysma zwischen 3 und 4,4 cm, sollte 1-mal jährlich eine Ultraschallkontrolle erfolgen. Misst das Aneurysma zwischen 4,5 und 5,4 cm, sollte die Kontrolle 3-monatlich erfolgen und der Patient an einem spezialisierten Zentrum vorgestellt werden. Eine Therapie ist indiziert, wenn der Durchmesser mehr als 5,5 cm oder das jährliche Aneurysmawachstum mehr als 1 cm beträgt.
Die Therapiedurchführung und die Entscheidung, ob endovaskulär oder offen behandelt wird, sind im Rahmen einer interdisziplinären Zusammenarbeit in einem gefäßmedizinischen Zentrum zu treffen. In zahlreichen Studien wurden die Ergebnisse der offenen Operation mit der endovaskulären Methode verglichen. Die 30-Tage-Mortalität ist bei der offenen Operation höher als bei der endovaskulären Therapie. Bezüglich der Gleichwertigkeit im Langzeitverlauf gibt es durchaus unterschiedliche Daten.
Die Spezifika der einzelnen Therapiemöglichkeiten werden in den folgenden Artikeln diskutiert.