Therapie des Mammakarzinoms
HER2+– Mammakarzinom
Immuntherapie im neoadjuvanten Setting
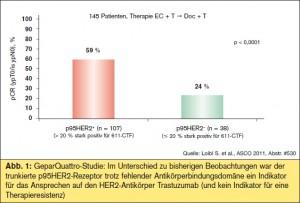
p95HER2 und Trastuzumab-Resistenz: Im Jahr 2007 wurde von Scaltriti et al. erstmals festgehalten, dass der trunkierte HER2-Rezeptor (p95HER2) aufgrund der fehlenden Antikörperbindungsdomäne mit einer Tras – tuzumab-Resistenz assoziiert sein könnte (Scaltriti et al., JNCI 2007). Nunmehr ergab eine am ASCO präsentierte Auswertung des translationellen Arms der GeparQuattro-Studie (S. Loibl et al., Abstr. #530) im neoadjuvanten Setting HER2-positiver Brustkrebspatientinnen, dass, anders als erwartet, die p95HER2-Expression kein Indikator für eine Resistenz, sondern ein Indikator für das Ansprechen auf die Trastuzumab-hältige Immunchemotherapie war: Die Rate pathologischer Komplettremission (pCR) betrug 59 % bei Vorliegen des trunkierten Rezeptors gegenüber 24 % bei p95HER2-negativen Patientinnen (> Abb. 1).
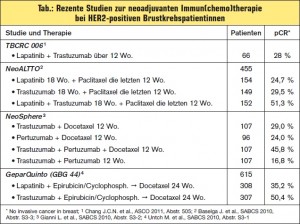
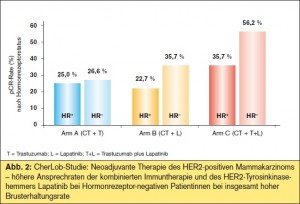
Kombinierte Immuntherapie und p95HER2: Die Ergebnisse der CherLob-Studie, einer Phase- II-Studie im neoadjuvanten Setting, belegen erneut die bessere Wirksamkeit der kombinierten Immuntherapie aus Lapatinib + Tras – tzuzumab (+ Chemotherapie) gegenüber den jeweiligen Monotherapien Lapatinib (+ Chemotherapie) oder Trastuzumab (+ Chemotherapie) mit einer pCR-Rate von rund 43 % vs. 26–28 % (vgl. > Tab., > Abb. 2). Wie in NeoSphere zeigte sich auch in dieser Studie, dass Hormonrezeptor-negative Patientinnen besser auf Lapatinib ansprachen (> Abb. 2). Als wesentliches Ergebnis wurde festgehalten, dass zum Zeitpunkt des chirurgischen Eingriffs 84 % der Patientinnen im kombinierten Immuntherapie- Arm Lapatinib + Trastuzumab (+ Chemotherapie) Lymphknoten-negativ waren und dass bei über 60 % der Patientinnen dieses Arms statt einer Mastektomie eine brusterhaltende Therapie durchgeführt werden konnte. Auch in dieser Studie schien der trunkierte p95HER2-Rezeptor kein signifikanter Prädiktor für eine Therapieresistenz mit Tras – tuzumab zu sein, die Patientenzahl dieser Analysen ist allerdings insgesamt sehr klein (> Abb. 2).
Prävention bei Frauen mit hohem Brustkrebsrisiko
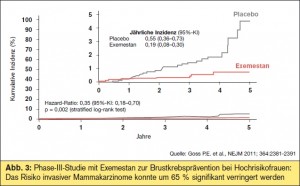
In der placebokontrollierten Phase-III-Studie NCIC-CTG-MAP.3 wurde Exemestan bei postmenopausalen Frauen (> 60 Jahre) mit erhöhtem Brustkrebsrisiko (Gail-Risikoscore) präventiv eingesetzt, eine Indikation, in der bislang die selektiven Östrogenrezeptormodulatoren Tamoxifen und Raloxifen untersucht sind, die beide das Brustkrebsrisiko um etwa 40 % verringern (Goss P., Late Breaking Abs tract #LBA504; NEJM 2011; 364:2381). Wenn 95 Frauen über 5 Jahre mit Tamoxifen behandelt werden, lässt sich ein Mammakarzinom verhindern, allerdings hat Tamoxifen den Nachteil einer prokanzerogenen Wirkung am Endometrium und erhöht das Thrombose- und Schlaganfallrisiko. Die aktuelle Studie mit Exemestan inkludierte 4.560 postmenopausale Frauen, die in Exemestan 25 mg/d oder Placebo randomisiert wurden. Primärer Endpunkt war die Inzidenz invasiver Mammakarzinome, darüber hinaus wurde das Auftreten von präinvasiven Tumoren (DCIS) und von Präkursorläsionen analysiert. In beiden Armen erhielten etwa 18 % der Frauen Bisphosphonate. Im Ergebnis konnte die Inzidenz invasiver Mammakarzinome um 65 % (p =0 ,002) verringert werden (32 Fälle unter Placebo, 11 Fälle unter Exemestan), darunter vor allem die Inzidenz Östrogenrezeptor-positiver, Progesteronrezeptor-positiver und HER2-negativer Mammakarzinome (> Abb. 3). Die Rate an kardiovaskulären Nebenwirkungen, Frakturen oder anderen malignen Erkrankungen war gegenüber Placebo nicht erhöht; die Lebensqualität schien von der Therapie unbeeinflusst zu sein, Hitzewallungen, Muskelund Gelenkschmerzen wurden allerdings häufiger verzeichnet. Um ein Mammakarzinom zu verhindern, müssen 94 Frauen über 3 Jahre und 26 Frauen über 5 Jahre mit Exemestan behandelt werden. Die Autoren kommen zum Schluss, dass wenn eine Brustkrebsprävention für Frauen mit hohem Mammakarzinomrisiko angedacht werden sollte, mit dieser Studie eine weitere Grundlage für die praktische Umsetzung geschaffen wäre.
Triple-negatives Mammakarzinom
Bevacizumab: In der neoadjuvanten Studie GeparQuinto der deutschen Brustkrebsgruppe wurde die Zugabe von Bevacizumab zu einem Anthrazyklin-Taxan-basierten Regime bei 684 triple-negativen Patientinnen (Hormonrezep – tor- und HER2-negativ) als sekundärer Endpunkt untersucht (B. Gerber et al., Abstr. #1006). Im Unterschied zur Gesamtpopulation steigerte Bevacizumab bei dem selektionierten Patientengut die Rate pathologischer Komplettremission gemäß der stringentesten Definition, keine invasiven und nicht-invasiven Tumorresiduen in Brust und Lymphknoten (ypT0, ypN0), von 27,8 auf 36,4 % (p = 0,021). Begründet wurde der Einsatz von Bevacizumab mit der Beobachtung, dass die prognostisch ungünstige Subgruppe triple-negativer Mammakarzinome häufig VEGF-assoziierte Gene exprimiert („hypoxische Signatur“). In einer Metaanalyse von O’Shaugnessy zeigte sich, dass die Zugabe von Bevacizumab zur Chemotherapie Ansprechraten und progressionsfreies Überleben signifikant verbessert. Ähnliche Ergebnisse in späteren Therapielinien erzielte auch die RIBBON-2-Studie, in der sich mit längerer Nachbeobachtung ein Überlebensvorteil bei triple-negativen Patientinnen abzeichnet: So geht aus der am ASCO präsentierten retrospektiven Auswertung hervor, dass Bevacizumab (+ Chemotherapie) das progressionsfreie Überleben von 2,7 auf 6 Monate verlängerte und das mediane Gesamtüberleben von 12,6 auf 17,9 Monate verbesserte. Die Ansprechraten wurden von 18 % auf 41 % gesteigert (A. Brufksy et al., Abstr. #1010).
Iniparib: Triple-negative Mammakarzinome sind aufgrund der fehlenden Expression prädiktiver Targets der bislang einzige Subtyp, für den keine zielgerichtete Therapie verfügbar ist. Mit Spannung wurde daher die Phase-IIIStudie von Joyce O’Shaugnessy mit dem PARP-Inhibitor Iniparib erwartet, der Antitumoreffekte über einen Zellzyklusstopp in der G2/M-Phase und durch die Induktion von DNA-Doppelstrangbrüchen erzielt und in einer ersten Phase-II-Studie mit Gemcitabin/Carboplatin das progressionsfreie Überleben und das Gesamtüberleben verlängern konnte. In der aktuellen Phase-III-Studie (O’Shaugnessy et al., Abstr. #1007) konnte dieser Erfolg nicht reproduziert werden. Das progressionsfreie Überleben wurde zwar signifikant verbessert, allerdings nur um einen Monat, und das Gesamtüberleben wurde ebenfalls um etwa einen Monat verlängert, allerdings nicht signifikant, sodass die beiden co-primären Endpunkte entsprechend der statistischen Vorgabe nicht verbessert wurden. Insgesamt war der Effekt geringer, als man auf Basis der Phase-II-Daten annehmen konnte. Wenn Iniparib als Zweit- und Drittlinientherapie eingesetzt wurde, schienen die Ergebnisse gegenüber der First-Line-Therapie besser zu sein. Ausgangspunkt für die Entwicklung von PARP-Inhibitoren beim Mammakarzinom waren BRCA-1/-2-assoziierte hereditäre Brustkrebsformen, bei denen eine hohe PARP-Enzymaktivität zur Reparatur von DNA-Schäden nachgewiesen wurde. Die Hypothese daraus war, dass mit der PARP-Inhibition DNA-Schäden induziert und Tumorzellen in Apoptose übergeführt werden. Überraschend wurde am ASCO schließlich mitgeteilt, dass Iniparib in physiologischen Konzentrationen das eigentliche Target (PARP) nicht hemmt. Auf der anderen Seite wurde ein Wirksynergismus mit Gemcitabin/ Carboplatin nachgewiesen, weshalb diese bei Brustkrebs unübliche Zytostatikakombination als chemotherapeutisches Rückgrat für die Phase-III-Studie herangezogen wurde. (Schlussfolgerungen und Kommentare vgl. Interview mit Univ.-Prof. Dr. Günther Steger).
* American Society of Clinical Oncology (ASCO), 3.–7. Juni 2011, Chicago