Antiplättchentherapie bei koronarer Herzerkrankung
Blutplättchen spielen eine zentrale Rolle bei der normalen Hämostase und darüber hinaus bei der Atherothrombose. Es gibt verschiedene Ansätze, die Plättchenfunktion zu hemmen und hierdurch akute thrombotische Koronarereignisse zu vermindern. Jede Antiplättchentherapie ist jedoch auf der anderen Seite mit einem gesteigerten Blutungsrisiko assoziiert. Somit muss stets zwischen antithrombotischen Wirkungen und potenziellen Blutungskomplikationen bei einer Therapieentscheidung abgewogen werden.
Azetylsalizylsäure (Aspirin)
Aspirin induziert eine permanente Funktionsstörung von Blutplättchen, die klinisch durch eine Verlängerung der Blutungszeit detektiert werden kann. Dies basiert auf einer irreversiblen Inaktivierung des Enzyms Zyklooxygenase-1 (COX-1) und damit einer Inhibition des Thromboxan-A2-vermittelten Weges der Plättchenaggregation. Durch eine Monotherapie mit Aspirin kann bei Hochrisikopatienten im Vergleich zu Placebo die Inzidenz eines Myokardinfarkts, Schlaganfalls oder vaskulären Todes um etwa 25 % reduziert werden. Zu diesen Risikopatienten, bei denen der Nutzen das potenzielle Blutungsrisiko deutlich überwiegt, zählen Patienten mit chronisch stabiler koronarer Herzerkrankung (KHK), Zustand nach Schlaganfall oder transitorischer ischämischer Attacke (TIA), abgelaufenem Myokardinfarkt oder instabiler Angina pectoris. Die verfügbare Evidenz unterstützt die Einnahme einer Aspirindosis von 75–100 mg täglich. In Situationen, in denen ein sofortiger antithrombotischer Effekt erforderlich ist, wie beispielsweise beim akuten Koronarsyndrom, sollte eine Aufsättigungsdosis von 160–300 mg oral bzw. bis zu 500 mg i. v. gegeben werden. Neben der Sekundärprävention wurde der Nutzen von Aspirin auch bei der Primärprävention analysiert (siehe dazu den Beitrag ab Seite 26 in diesem Heft). In sechs Primärpräventionsstudien bei insgesamt etwa 95.000 Individuen reduzierte niedrig dosiertes Aspirin über einen mittleren Beobachtungszeitraum von 6,9 Jahren die jährliche Rate schwerer vaskulärer Ereignisse von 0,57 % auf 0,51 %, d. h. um relative 12 %. Dies beruht im Wesentlichen auf einer Abnahme nichttödlicher Myokardinfarkte. Dem gegenüber stand jedoch eine Zunahme von Blutungen von 0,07 % auf 0,1 % pro Jahr. Die Sterblichkeit wurde nicht beeinflusst. Insgesamt wird derzeit eine generelle Primärprävention mit Aspirin nicht empfohlen, da die gleichen Risikofaktoren die relative Rate kardiovaskulärer Ereignisse und von Blutungskomplikationen erhöhen (Tab.).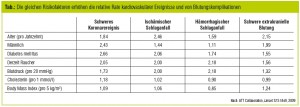
Thienopyridine
Thienopyridine inhibieren die adenosindiphosphatabhängige (ADP-abhängige) Plättchenfunktion durch irreversible Modifikation des P2Y12-Rezeptors. Als Thienopyridine stehen Ticlopidin, Clopidogrel und Prasugrel zur Verfügung. Clopidogrel wird als Prodrug aufgenommen und unterläuft zwei Cytochrom P450 abhängige (CYP-abhängige) Konversionsschritte. Genetische Variationen dieser Leberenzyme sind für einen variablen Spiegel aktiver Metabolen in der Zirkulation verantwortlich. In der CURE-Studie (CURE Trial Investigators, New Engl J Med 2001) hatte eine duale Blockade mit Aspirin und Clopidogrel einen additiven Effekt. Bei Patienten mit Nicht-ST-Hebungsinfarkt (NSTEMI) wurde die Rate des primären kombinierten Endpunktes aus kardiovaskulärem Tod, nichttödlichem Myokardinfarkt und Schlaganfall von 11,4 % auf 9,3 % im Vergleich zu Aspirin alleine reduziert (p < 0,001; Abb. 1). Erwartungsgemäß führte diese aggressivere Antiplättchentherapie auch zu einer signifikanten Steigerung schwerer Blutungskomplikationen (3,7 % vs. 2,7 %; p = 0,001). Der klinische Nutzen einer dualen Thrombozytenaggregationshemmung im Vergleich zu Aspirin alleine wurde bei Patienten, die einer Koronarintervention unterzogen wurden sowie bei akutem ST-Hebungsinfarkt (STEMI) bestätigt.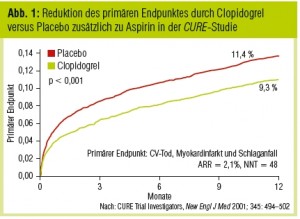
Entsprechend wird eine Langzeittherapie mit Aspirin und Clopidogrel nach STEMI derzeit für ein Jahr, unabhängig von der akuten Reperfusionsstrategie, empfohlen. Eine Kombinationsbehandlung nach unbeschichtetem Stent wird in der Regel für vier Wochen empfohlen, nach beschichtetem Stent reichen die Empfehlungen zwischen drei und zwölf Monate, in Abhängigkeit des Stenttyps. Mehrere Studien zur Klärung der optimalen Therapiedauer laufen zur Zeit. Als Dauerdosierung wird in der Regel Clopidogrel 75 mg/Tag eingesetzt. Als Aufsättigungsdosis sollten 300 mg, bzw. bei geplanter Intervention 600 mg (mit einer Verdoppelung der Tagesdosis auf 150 mg für sieben Tage) gegeben werden. Prasugrel wird ebenfalls als Prodrug in inaktiver Form aufgenommen, durchläuft aber nur einen CYP abhängigen Umwandlungsschritt. Die Pharmakokinetik von Prasugrel ist im Vergleich zu Clopidogrel schneller. Nach Einnahme einer Aufsättigungsdosis von 60 mg Prasugrel ist nach einer Stunde die Plättchenaggregation etwa fünffach stärker gehemmt als nach Einnahme der Clopidogrel Aufsättigungsmedikation. Zudem wirkt Prasugrel unabhängig von CYP2C19- Genvarianten. Die täglich Erhaltungsdosis liegt bei 10 mg.
In der TRITON-TIMI-38Studie (Wiviott et al., New Engl J Med 2007) wurde Prasugrel mit Clopidogrel bei Patienten mit akutem Koronarsyndrom und Koronarintervention untersucht. Bei insgesamt 13.608 Patienten reduzierte Prasugrel den primären kombinierten Endpunkt aus kardiovaskulärem Tod, Myokardinfarkt und Schlaganfall von 12,1 % auf 9,9 % (p < 0,001). Gleichzeitig stiegen die nicht bypassabhängigen Blutungskomplikationen von 1,8 % auf 2,4 % (p < 0,001). Der Benefit von Prasugrel beruhte im Wesentlichen auf einer Reduktion nichttödlicher Myokardinfarkte, die Gesamtsterblichkeit wurde nicht verändert. Zu berücksichtigen ist ein erhöhtes Blutungsrisiko bei Patienten über 75 Jahren und mit einem Körpergewicht unter 60 kg. Zudem ist Prasugrel bei Zustand nach Schlaganfall bzw. TIA kontraindiziert.
Wesentlich bei der TRITON-TIMI-38-Studie ist jedoch das Studiendesign:
• Bei Patienten mit Nicht-ST-Hebungsinfarkt erfolgte keine sofortige Gabe eines zweiten Thrombozyten gregationshemmers zusätzlich zu Aspirin, wie dies eigentlich in internationalen Leitlinien empfohlen wird, sondern es wurde zunächst eine Koronardiagnostik durchgeführt. Nur diejenigen Patienten, die einer Koronarintervention zugeführt wurden, wurden in die Studie aufgenommen und randomisiert. Im Clopidogrel Arm erhielten diese Patienten zudem eine nur niedrige Aufsättigungsdosis von 300 mg und nicht 600 mg. Patienten mit Nicht-ST-Hebungsinfarkt machten immerhin 74 % des Gesamtkollektivs aus.
• Bei ST-Hebungsinfarkt wurde ein leitlinienkonformeres Studienprotokoll mit Aufsättigung innerhalb der ersten 12 Stunden und direkter Koronarangiographie bzw. Intervention verfolgt, allerdings auch hier mit einer niedrigen Clopidogrel-Sättigungsdosis von 300 mg.
Entsprechend der Studienergebnisse wurde Prasugrel von der Food and Drug Administration (FDA) und der European Medicines Agency (EMA) zur Reduktion thrombotischer kardiovaskulärer Ereignisse bei akutem Koronarsyndrom und geplanter Koronarintervention zugelassen. Im klinischen Alltag kann die schnellere/gesteigerte Effektivität von Prasugrel im Rahmen eines akuten ST-Hebungsinfarktes mit Zuweisung zur primären Koronarintervention mit dem Ziel der Prävention nichtfataler Myokardinfarkte und Stentthrombosen eingesetzt werden. Zudem kann Prasugrel bei Patienten erwogen werden, die trotz Aspirin und Clopidogrel Therapie eine Stentthrombose entwickeln. Der Stellenwert von Prasugrel als initiale medikamentöse Behandlung beim akuten Koronarsyndrom/NSTEMI ist offen und wird derzeit in Studien evaluiert. Der Einsatz von Prasugrel mit einer niedrigeren Erhaltungsdosis von 5 mg, selbst bei alten Patienten (> 75 Jahre) und niedrigem Gewicht (< 60 kg), wird ebenfalls weiter untersucht.
Reversible P2Y12-Antagonisten
Drei direkte reversible P2Y12-Antagonisten (Ticagrelor, Cangrelor und Elinogrel) stehen klinisch zur Verfügung bzw. sind in klinischer Erprobung. Diese benötigen, anders als die Thienopyridine keine metabolische Aktivierung in der Leber. Ticagrelor wird schnell absorbiert und mindestens in einen weiteren aktiven Metaboliten transformiert. Die Spitzenplasmakonzentration von Ticagrelor und die maximale Plättcheninhibition werden ein bis drei Stunden nach Einnahme erreicht. Die Plasmahalbwertszeit liegt bei sechs bis 13 Stunden, was eine zweimal tägliche Dosierung erforderlich macht. Es wird eine Aufsättigung von 180 mg mit nachfolgender täglicher Dosierung von zweimal 90 mg empfohlen.
In der PLATO-Studie (Wallentin et al., New Engl J Med 2009) wurde Ticagrelor bei Hochrisikopatienten mit akutem Koronarsyndrom im Vergleich zu Clopidogrel getestet. Die Randomisierung erfolgte innerhalb der ersten 24 Stunden nach Symptombeginn. Nach zwölf Monaten reduzierte Ticagrelor die relative Häufigkeit kardiovaskulärer schwerwiegender Ereignisse von 11,7 % auf 9,8 % (p < 0,001; Abb. 2). In der PLATO- Studie wurde neben vaskulären Ereignissen auch die Gesamtsterblichkeit signifikant durch Ticagrelor vermindert. Wie unter Prasugrel traten auch unter Ticagrelor im Vergleich zu Clopidogrel weniger gesicherte Stentthrombosen im Verlauf auf. Die Gesamthäufigkeit schwerer Blutungen war in beiden Gruppen nicht unterschiedlich. Auch die Blutungshäufigkeit während einer Bypassoperation war unter Ticagrelor im Gegensatz zu Prasugrel nicht höher als unter Clopidogrel. Es traten jedoch häufigere nicht mit einer Bypassoperation assoziierte Blutungen und tödliche intrakranielle Blutungen auf.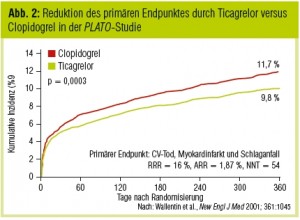
Da die Molekularstruktur von Ticagrelor teilweise identisch mit Adenosin ist und Metaboliten von Ticagrelor Adenosinrezeptoren aktivieren können, müssen bei Ticagrelor als mögliche Nebenwirkungen Dyspnoe, Bradykardien sowie ein Anstieg von Kreatinin und Harnsäure berücksichtigt werden. Es wurden jedoch keine gehäuften Schrittmacherimplantationen erforderlich. Ticagrelorinduzierte Dyspnoe verschlechterte die Prognose nicht.
In der PLATO-Studie war auffällig, dass in den USA kein Benefit von Ticagrelor vs. Clopidogrel belegt werden konnte. Es wird derzeit diskutiert, ob dies durch die in den USA übliche höhere Aspirindosis von 300 mg/Tag bedingt ist. Der exakte Pathomechanismus ist noch nicht geklärt. Entsprechend der Datenlage wurde Ticagrelor von der EMA und FDA zur Reduktion thrombotischer kardiovaskulärer Ereignisse bei Patienten mit akutem Koronarsyndrom unabhängig von der geplanten therapeutischen Strategie (Koronarintervention, Operation, Medikamente) zugelassen. Eine Kontraindikation besteht bei Zustand nach intrakranialen Blutungen. Bei der Kombination sollte die Aspirindosis nicht über 100 mg liegen. Die Dosierung muss nicht in Abhängigkeit des Alters oder Gewichts modifiziert werden.






















































































