Pathogenetische Überlegungen bei Psoriasisarthritis
Je nach Studie sind 5–30 % der Patienten mit Psoriasis von einer Arthritis betroffen; da die Psoriasis selbst bis zu 3 % der Bevölkerung befällt, liegt die Prävalenz der Psoriasisarthritis (PsA) bei ca. 0,2–1 % der Bevölkerung – vermutlich eher an der unteren Grenze dieser Bandbreite.
Unterschiedliche pathogenetische Prinzipien?
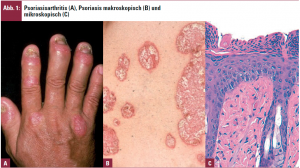
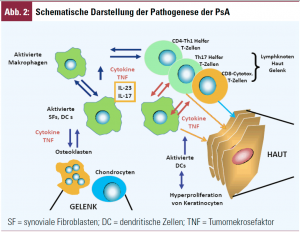
Das Erscheinungsspektrum der PsA ist mannigfaltig wie bei kaum einer anderen Gelenkerkrankung: nach Moll und Wright gibt es zumindest 5 Formen, nämlich einen ausschließlichen Befall der distalen Interphalangealgelenke (Abb. 1A), eine asymmetrische Oligoarthritis, oft mit Beteiligung der großen Gelenke, jene mit überwiegendem Befall der proximalen und Metakarpophalangealgelenke, eine mutilierende und somit rapid destruktive Form und schließlich einen prädominanten Achsenskelettbefall ähnlich einem M. Bechterew. Darüber hinaus kommt es bei der PsA häufig zu Schmerzen im Bereich der Sehnenansätze (Enthesiopathie). Die Unterschiedlichkeit der Präsentationsformen der PsA lässt die Vermutung keimen, dass unterschiedliche pathogenetische Prinzipien dabei im Spiel sind – doch ist dies lediglich Spekulation, da die Genese der PsA immer noch im Dunklen liegt. Generell wird angenommen, dass antigenpräsentierende Zellen der Haut Fremd- oder Selbstantigene aufnehmen und im zugehörigen Lymphknoten T-Lymphozyten zu erkennen geben und diese somit aktivieren, wobei hier zusätzlich die Beteiligung kostimulatorischer Moleküle notwendig ist. Die aktivierten T-Lymphozyten können sodann aus- und in die Haut wandern, in der das Antigen auftritt, und dort andere Zellpopulationen, wie Makrophagen oder Epidermalzellen stimulieren, wodurch es zur Hyperproliferation dieser Zellen und zum klinischen Erscheinungsbild der Psoriasis kommt (Abb. 1B, 1C; Abb. 2).
Die Pathogenese muss somit einerseits mit der Psoriasis an sich in Zusammenhang stehen, wobei es interessanterweise bei PsA eine Häufung des psoriatischen Nagelbefalls gibt (Abb. 1A), andererseits eine genetische Komponente aufweisen, da sie nicht nur auftritt, wenn die Betroffenen selbst eine Schuppenflechte zeigen, sondern auch wenn bloß ein Familienmitglied an Psoriasis erkrankt ist. Es gibt in der Tat sowohl bei Psoriasis als auch bei PsA vielfältige genetische Assoziationen. Last, not least spielt eine Aberration des Immunsystems mit Hyperproduktion von Zytokinen, interzellulären Botenstoffen, eine wichtige Rolle.
Genetische Assoziationen
Wenn wir die Genetik betrachten, so ist die Erbkomponente zunächst aus Studien an Familien offensichtlich: bei etwa 15 % der PsA-Patienten hat auch ein Familienmitglied eine PsA. Mittlerweile gibt es eine Fülle von genomweiten Analysen, die eine Reihe von Hinweisen erbracht haben. In erster Linie besteht eine Assoziation mit Immunantwortgenen, also jenen des Haupthistokompatibilitätskomplexes MHC/HLA. Interessanterweise besteht aber bei PsA nicht – wie bei rheumatoider Arthritis (RA) – in erster Linie eine Assoziation mit Klasse-II-MHC-Genen, sondern eine mit Klasse-I-Genen: HLAB27, B*39 und Cw*0602. Ein Klasse-II-Gen, HLA-DRB1*07, das nicht mit RA assoziiert ist, zählt auch zu den bei PsA involvierten Genen. HLA-B27 hat – nicht überraschend – eine prominente Rolle bei der Beteiligung des Achsenskeletts. Diverse Analysen haben so genannte PSORS-Genloci aufgezeigt, insbesondere am Chromosom 6 (wo der HLA-Lokus beheimatet ist), aber auch an den Chromosomen 1 und 17. Vor Kurzem wurde auch über die Assoziation der Psoriasis mit Interleukin 23 (IL-23) und NFκB, sowie TNF-Polymorphismen berichtet. Tatsächlich führt im Tierexperiment IL-23 zu einer epidermalen Hyperplasie, und die Inhibition von IL-23, einem Mitglied der IL-12-Familie, mittels Ustekinumab ist bei Psoriasis höchst effizient, auch bei Patienten, die auf andere Therapien nicht hinreichend angesprochen haben. Bei PsA wird Ustekinumab gegenwärtig klinischen Studien unterzogen. Dies bringt uns zu der weiteren wesentlichen Komponente, nämlich der Rolle von Zytokinen.
Dysregulation des Immunsystems und erhöhte Zytokinproduktion
Schon vor Langem hat Gerald Partsch beobachtet, dass in Synovialflüssigkeiten von PsA-Patienten hohe Konzentrationen an TNF (und auch IL-6) nachweisbar sind – und die Erfolge der TNF-Inhibitoren haben dieser Beobachtung viel Kredit gezollt. Auch IL-12/IL-23 sowie IL-6 sind in erhöhtem Maße nachweisbar und ebenso IL-17. IL-17 kommt vermutlich eine wichtige Rolle zu. Es wird produziert von einem erst kürzlich beschriebenen Helfer-Zell-Typ, TH17-Zellen, einer Population, die als zentral für die Entstehung von Autoimmunität und chronischer Entzündung gilt. IL-17, das Hauptprodukt dieser Zellen, aktiviert insbesondere Monozyten und Makrophagen (Abb. 2) und führt somit zu einer erhöhten TNF-Produktion. Alle diese Moleküle sind in Hautbiopsien von Psoriasis überexprimiert. IL-17 kommt in verschiedenen Isoformen vor und IL-17F ist die in erster Linie bei Psoriasis gefundene. Auch in der Zirkulation sind vermehrt TH17-Zellen zu finden.
Umweltfaktoren – infektiöse Trigger
Auch andere Zytokine – wie IL-6 – sind erhöht, und es wird von Interesse sein, in welchem Maße eine IL-6-Inhibition wirksam ist. Da die PsA die Gelenke auch ähnlich wie die rheumatoide Arthritis destruieren kann und für die erosive Komponente Osteoklasten verantwortlich sind, ist es auch wichtig festzuhalten, das Osteoklastenvorläuferzellen im peripheren Blut von PsA-Patienten in erhöhtem Maße vorgefunden wurden. Sind somit Hinweise für eine genetische Disposition und eine Dysregulation des Immunsystems mit erhöhter Zytokinproduktion mittlerweile augenscheinlich, fehlt doch das Bindeglied zwischen diesen beiden pathogentischen Komponenten – und dieses ist vermutlich im Bereich der Umweltfaktoren zu suchen. Es ist anzunehmen, dass ein infektiöser Trigger die Psoriasis – und bei Psoriasispatienten eine PsA – auslöst. Es ist mittlerweile aber auch offenkundig, dass die „natürliche“, kommensale Darmflora bei vielen chronischen Entzündungen, wie M. Crohn, aber auch rheumatoider Arthritis, eine wichtige Rolle spielen könnte. Dies ergab sich u. a. aus Studien an experimentellen Arthritismodellen, in denen die Gelenkentzündung nicht auftritt, wenn die Tiere keimfrei aufwachsen. Nicht nur der Darm, auch die Haut ist Träger eines gewaltigen kommensalen, üblicherweise symbiontischen Mikrobioms.
Haut- und Darmkeime. Somit könnte das Metagenom des Menschen eine wesentliche Funktion in der Auslösung vieler chronisch entzündlicher Krankheiten und auch der PsA innehaben. An den epithelialen Grenzschichten des Organismus zur Umwelt, an denen immer wieder Keime und Keimbestandteile eindringen und von antigenpräsentierenden Zellen aufgenommen werden können, dürften vielfältige Interaktionen zwischen Umwelt und Immunsystem ablaufen, die – bei prädisponierten Personen und wahrscheinlichem zusätzlichem barrierestörendem Trigger – zur Aktivierung der chronischen Geschehnisse führen. Da die Psoriasis zur Familie der seronegativen Spondarthritiden (nach neuerer Nomenklatur zu den peripheren – und gelegentlich axialen – Spondyloarthritiden) zählt, ist in diesem Zusammenhang erwähnenswert, dass bei mehr als 50 % von Patienten mit M. Bechterew ohne weitere klinische Symptome Darmveränderungen im Sinne eines M. Crohn feststellbar sind. Zu dieser Krankheitsfamilie zählt auch die reaktive Arthritis, die nachweislich mit vorausgegangenen Infektionen, wie solchen mit Chlamydien, Salmonellen oder Yersinien, in Zusammenhang steht. Vielleicht sind es bei der Psoriasis Haut- und bei PsA zusätzlich Darmkeime, die eine auslösende Rollen spielen, wobei aber auch ein Trauma, das zu einer Stressantwort des Organismus führt, immer wieder als möglicher Trigger angesehen wird. Zu diesen Fragen, die im Augenblick lediglich spekulativ sind, wird wohl bis zum Ende dieses Jahrzehnts noch sehr viel mehr Information zu erwarten sein.
Pathogenetische Unterschiede zur RA und Unterschiede zwischen Psoriasis und PsA
Die Synovitis bei PsA ist durch eine Infiltration mit T- und BLymphozyten charakterisiert und unterscheidet sich von der RA durch eine geringere Deckzellhyperplasie und eine höhere Vaskularität, auch wenn es keine pathognomonischen Veränderungen der PsA oder RA gibt. CD8+-T-Zellen sind häufiger anzutreffen als bei der RA, und es ist anzunehmen, dass neben den klassischen CD4+-T-Helferzellen vor allem die CD8+-TLymphozyten eine wichtige pathogenetische Rolle spielen. Zytokine wie IL-1, IL-6, TNF, Interferon γund viele andere sind überexprimiert.
Spezifische Therapien. Einige der pathogenetischen Erkenntnisse haben zu neuen Therapieformen geführt. Zum einen sind TNF-Inhibitoren heute unbestreitbar bei jenen Patienten, die auf Behandlung mit synthetischen Medikamenten nicht hinreichend bezüglich ihrer Psoriasis oder ihrer PsA ansprechen, hervorragende Therapeutika. Zum anderen steht mit Ustekinumab zumindest für die Psoriasis, möglicherweise auch für die PsA, ein IL-12-/IL-23-Inhibitor mit hoher Effizienz zur Verfügung. Während TNF-Blocker auch in der Therapie der rheumatoiden Arthritis (RA) höchst effizient sind, zeitigt Ustekinumab bei RA nur geringfügige Effekte. Auf diese Weise lassen sich auch die Unterschiede in der Prädominanz pathogenetischer Faktoren zwischen unterschiedlichen Krankheiten herausarbeiten. Dass eine Reihe weiterer Moleküle, insbesondere Adhäsionsmoleküle, die die Zell-Zell-Interaktion fördern, für die Pathogenese der Psoriasis von Relevanz sind, geht aus der Effizienz von entsprechenden Inhibitoren, Efalizumab und Alefacept, hervor. Letzteres ist ein Fusionsprotein eines LFA-3-Moleküls mit einem Immunglobulin-Fc-Teil und inhibiert die Interaktion zwischen LFA-3 auf antigenpräsentierenden Zellen und dem auf T-Lymphozyten exprimierten CD2- Antigen und reduziert den vorliegenden Studien nach die Zahl der Gedächtnis-T-Zellen. Ersteres ist ein monoklonaler Antikörper gegen das Adhäsionsmolekül LFA-1, blockiert die Bindung zwischen diesem vor allem auf T-Zellen vorkommenden Molekül und dem auf antigenpräsentierenden Zellen und Endothelzellen exprimierten ICAM-1 und hemmt dadurch die T-Zell-Aktivierung; Efalizumab wurde aber kürzlich wegen des Auftretens von progressiven multifokalen Leukenzephalopathiefällen (PML) vom Markt genommen. Bei PsA sind beide Moleküle nicht effizient, was wiederum auf pathogenetische Unterschiede zwischen Psoriasis und PsA hinweist.
PsA – ein Symptomenkomplex?
Die pathogenetische Heterogenität der PsA-Manifestationen selbst ist aber auch sehr gut an den Ansprechraten der unterschiedlichen PsA-Manifestationen auf unterschiedliche Medikamente zu erkennen. Während synthetische Basistherapeutika bei peripherer Gelenkbeteiligung wirksam sind, sind es bei Enthesiopathien und axialem Skelettbefall nur die TNF-Inhibitoren. Die pathogenetischen Hintergründe der unterschiedlichen Manifestationen müssen erst zutage gebracht werden. Jedenfalls ist aus all den erwähnten Überlegungen die PsA eher als ein Symptomenkomplex denn als eine Krankheitsentität anzusehen. Auch die Unterschiede zur RA sind augenscheinlich, denn während bei RA IL-6-Rezeptorinhibition mit Tocilizumab sehr effizient ist, deuten erste negative Ergebnisse bei Patienten mit PsA darauf hin, dass IL-6 nicht primär in das Geschehen involviert ist. Auch eine erste kontrollierte Studie mit Abatacept, einem Hemmer der T-Zell-Kostimulation, zeitigte nur geringe Effizienz, vergleicht man die erzielten Daten indirekt mit jenen bei rheumatoider Arthritis, obzwar die Effizienz höher war als unter Placebo; auch die Verbesserung der Hautmanifestationen war nur relativ geringfügig. Ob eine gegen B-Zellen gerichtete Therapie angesichts des Vorkommens von B-Lymphozyten in der PsA-Synovialmembran wirksam sein wird, muss erst detaillierter untersucht werden.
Zusammenfassend spielen in der Pathogenese der PsA eine Vielzahl von Zellen und Zytokinen eine Rolle. Der Umstand, dass insbesondere TNF-Inhibitoren eine hohe Effektivität sowohl hinsichtlich der Hautproblematik als auch bezüglich aller muskuloskelettalen Manifestationen aufweisen, andere Biologika aber bisher negative oder nur recht schwache Verbesserungen zeitigten, spricht zum einen für eine prädominante Rolle von TNF in der Pathogenese aller Veränderungen der Psoriasis und ihrer Komplikationen, zum anderen aber für unseren noch unzureichenden Kenntnisstand zur Pathogenese – oder zumindest zu pathogenetisch herausragend wichtigen Geschehnissen. Hier liegt noch viel Arbeit vor den Grundlagenwissenschaftlern und klinischen Forschern.
Literatur beim Verfasser