Viele neue Therapien – was tun?
Die medikamentöse Therapie der rheumatoiden Arthritis (RA) hat innerhalb der letzten Dekade durch die Entwicklung der sog. Biologika eine beachtenswerte Zunahme an Behandlungsmöglichkeiten erfahren. Neben den seit Längerem bewährten synthetischen Basistherapeutika (Disease-modifying anti-rheumatic Drugs; DMARD) und Glukokortikoiden (GK) sind derzeit neun verschiedene Biologika für die Therapie der RA zugelassen, die proinflammatorisch Zytokine wie den Tumor-Nekrose-Faktor alpha (TNF-alpha), Interleukin-1 oder Interleukin-6 blockieren, die Aktivierung von T-Zellen über kostimulatorische Moleküle hemmen oder eine Depletion von B-Zellen im peripheren Blut bewirken. Nachdem Biologika bevorzugt in Kombination mit synthetischen DMARD eingesetzt werden, stehen dem behandelnden Arzt verschiedene Kombinationsmöglichkeiten zur Verfügung. Dadurch kann es jedoch fallweise zu Unsicherheiten in der Auswahl einer optimalen Therapiestrategie kommen.
Aus diesem Grund wurde ein Expertenkomitee der EULAR formiert, das – basierend auf den publizierten Daten aus klinischen Studien und Expertenmeinungen – Empfehlungen zur Behandlung von RA-Patienten formuliert hat1.
Leitgedanken der EULAR-Empfehlungen
Als übergeordnete Strategien wurde dabei Einigkeit erzielt,
a) dass nach Möglichkeit die Therapieentscheidung zur Behandlung einer RA durch einen Rheumatologen erfolgen sollte,
b) dass eine bestmögliche Behandlung des Patienten angestrebt werden sollte und diese in konsensueller Abstimmung mit dem Patienten erreicht werden soll sowie
c) dass in die konzeptuellen Überlegungen zur Therapiegestaltung sowohl die direkten Medikamentenkosten als auch indirekte Kosten durch einen Produktivitätsausfall des Patienten einbezogen werden sollen.
Therapeutische Empfehlungen
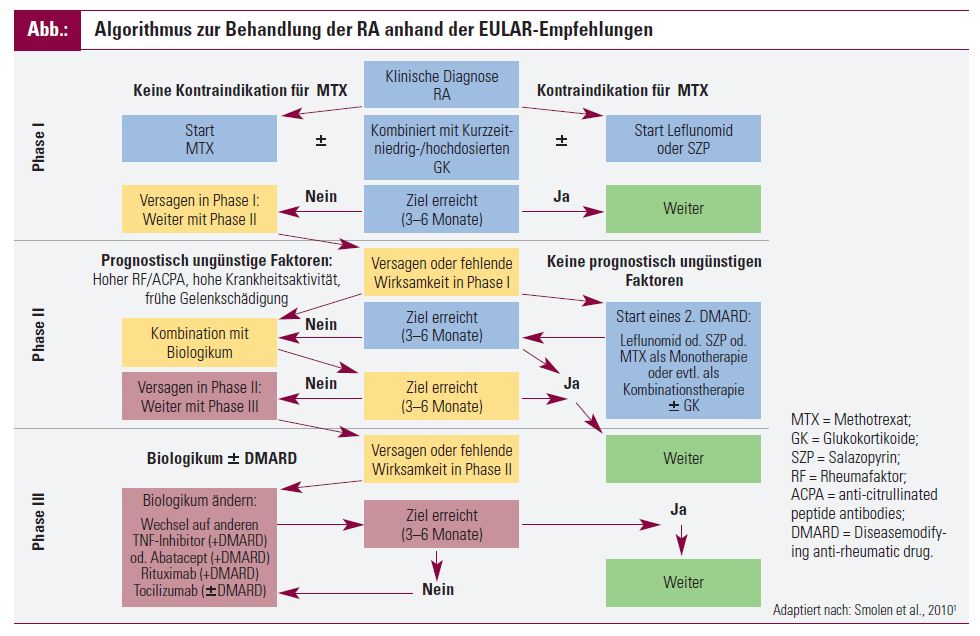
Die einzelnen Schritte in der Therapie eines RA-Patienten, die nach dem Stellen der Diagnose möglichst rasch gestartet werden sollte, sind in dem Flussdiagramm der Abbildung dargestellt.
Phase I
Präferenziell sollte in der Phase I die Therapie mit dem synthetisches DMARD Methotrexat (MTX) begonnen werden bzw. sollte MTX Teil der initialen Therapiestrategie sein. Bei Vorliegen von Kontraindikationen oder einer Unverträglichkeit kann jedoch auf DMARD wie Leflunomid oder Salazopyrin, aber auch auf injizierbare Goldpräparate ausgewichen werden. Der Einsatz von GK ist in niedriger bis mittlerer Dosierung in Kombination mit MTX sinnvoll. GK sollten aber nach Möglichkeit zeitlich begrenzt eingesetzt und nach dem Eintreten einer klinischen Wirkung wieder ausgeschlichen werden. Die Anti-Malaria- Präparate Chloroquin (Resochin®) oder Hydroxychloroquin werden fallweise als Kombinationspräparate eingesetzt und zeigen eine gewisse klinische Wirksamkeit. Sie sind jedoch anderen DMARD in der Prävention von strukturellen Gelenksschäden unterlegen und sollten als Monopräparate daher allenfalls nur in Patienten mit einer sehr niedrigen Krankheitsaktivität zum Einsatz kommen.
Zu Therapiebeginn müssen die Patienten engmaschig in 1-3- monatigen Abständen kontrolliert werden. Als Behandlungsziel wird dabei das Erreichen einer Remission oder einer niedrigen Krankheitsaktivität (anhand einer DAS28-, SDAI- oder CDAI-Bestimmung2) innerhalb von 3 bis maximal 6 Monaten angestrebt.
Wird das Behandlungsziel erreicht, wird die Therapie unverändert fortgesetzt und der Patient in 3-monatigen Abständen weiter kontrolliert.
Phase II
Wird das Behandlungsziel jedoch nicht erreicht, erfolgt das Einleiten der Phase II, die mit einer Stratifizierung des Patienten hinsichtlich seiner Risikokonstellation beginnt. Bei Vorliegen von prognostisch ungünstigen Faktoren, wie hoher Rheumafaktor, positiver Nachweis von Antikörpern gegen citrullinierte Peptide (anti-citrullinated peptide antibodies; ACPA), eine hohe Krankheitsaktivität (bestimmt anhand von DAS28, SDAI oder CDAI), eine hohe Anzahl an geschwollenen Gelenken, serologische Entzündungszeichen (C-reaktives Protein, Blutsenkungsgeschwindigkeit) oder frühe radiologische Zeichen einer strukturellen Gelenkszerstörung, wird die Therapie mit einem Biologikum erweitert.
Derzeit sind in Österreich fünf verschiedene Anti-TNF-Präparate (Remicade®, Enbrel®, Humira®, Simponi®, Cimzia®), der Anti-IL-6-Rezeptor-Antikörper Tocilizumab (RoActemra®) und das CTLA4Ig-Fusionsprotein Abatacept (Orencia®) als First-Line-Biologika nach Versagen einer Therapie mit mindestens einem DMARD zugelassen. Das Anti-B-Zell-Präparat Rituximab (MabThera®) ist derzeit nur nach Versagen von DMARD einschließlich einer oder mehrerer Therapien mit TNF-Blockern zugelassen. Für den Anti-IL-1-Rezeptor-Antagonisten Anakinra (Kineret®) konnte zwar in individuellen RA-Patienten eine Wirkung festgestellt werden; kontrollierte klinische Studien3 ergaben für Anakinra jedoch keine ausreichende Wirksamkeit in der Behandlung der RA, weshalb Anakinra nicht in die Therapieempfehlungen aufgenommen wurde. Aufgrund der längeren Marktpräsenz und der damit verbundenen Erfahrung im Einsatz der unterschiedlichen Präparate wird in den meisten Fällen derzeit ein Anti-TNF-Präparat als erstes Biologikum eingesetzt. Eine Kombination mit MTX sollte grundsätzlich angestrebt werden.
Im Falle des Fehlens von prognostisch ungünstigen Faktoren kann nach dem Versagen eines synthetischen DMARD auf ein zweites DMARD gewechselt werden (in Kombination mit GK oder ohne). Eine Kombination von zwei verschiedenen synthetischen DMARD ist prinzipiell möglich, allerdings sollte einer Monotherapie aufgrund eines günstigeren Risikoprofils der Vorrang gegeben werden.
Phase III
Wird das Behandlungsziel analog wie in Phase I innerhalb von 3 bis maximal 6 Monaten erreicht, wird die Therapie unverändert fortgesetzt. Sollte dies jedoch nicht der Fall sein, erfolgt der Übergang zu Phase III und ein Wechsel des Biologikums.
Sollte dieses initial ein Anti-TNF-Präparat gewesen sein, macht es Sinn, innerhalb der unterschiedlichen TNF-Blocker auf einen anderen zu wechseln4,5. Alternativ kann auf ein anderes Biologikum gewechselt werden. Zusätzlich zu den bereits erwähnten Präparaten steht weiters noch das B-Zell-depletierende Medikament Rituximab (MabThera®) zur Auswahl. Auch in der Phase III wird eine Therapieantwort innerhalb von 3 bis maximal 6 Monaten angestrebt. Sollte sie nicht erreicht werden, wäre ein erneuter Wechsel des Biologikums der nächste Schritt.
Ein gewisser Prozentsatz an Patienten zeigt gegenüber den bisher dargestellten Therapiestrategien leider kein ausreichendes Ansprechen. In dieser speziellen Patientengruppe können versuchsweise Medikament wie Ciclosporin A oder Cyclophosphamid eingesetzt werden, deren Anwendung muss jedoch unter besonderer Beachtung des Risikoprofils erfolgen und sollte daher auf Ausnahmefällen beschränkt sein.
Überlegungen und Empfehlungen zur Therapiedauer bei Remission
Anhand der gegenwärtigen Datenlage ist es unklar, ob DMARD in Patienten, die sich in einer Remission befinden, auch wieder abgesetzt werden können. In einer randomisierten, kontrollierten Studie wurde beispielsweise in ca. einem Drittel der Patienten ein Krankheitsschub unter DMARD-Therapie beobachtet im Vergleich zu ca. zwei Drittel der Patienten, in denen die DMARD-Therapie abgesetzt wurde6. Die Empfehlung des Expertenkomitees lautet demnach, dass eine begleitende GK-Therapie zuerst ausgeschlichen und abgesetzt werden sollte, ohne dass darunter eine Reaktivierung der Erkrankung beobachtet wird. In einem weiteren Schritt kann versuchsweise – unter Beibehaltung des synthetischen DMARD – das Verabreichungsintervall für das Biologikum verlängert oder die Dosierung verringert werden.
Empfehlungen bezüglich der Zeiträume, die für diese Therapieänderungen eingehalten werden sollen, können aufgrund der fehlenden Datenlage derzeit nicht gegeben werden. Gleichfalls kann für das Absetzen einer synthetischen DMARD-Therapie derzeit keine allgemeine Empfehlung abgegeben werden, sodass eine Entscheidung dazu auf individueller Basis zwischen Patient und behandelndem Arzt getroffen werden muss.
1 Smolen JS et al., EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis 69:964-975 (2010).
2 Aletaha D, Smolen JS, The definition and measurement of disease modification in inflammatory rheumatic diseases. Rheum Dis Clin North Am 32:9-44, vii (2006).
3 Cohen S et al., Treatment of rheumatoid arthritis with anakinra, a recombinant human interleukin-1 receptor antagonist, in combination with methotrexate: results of a twenty-four-week, multicenter, randomized, double-blind, placebo-controlled trial. Arthritis Rheum 46:614-624 (2002).
4 Gomez-Reino JJ, Carmona L, Switching TNF antagonists in patients with chronic arthritis: an observational study of 488 patients over a four-year period. Arthritis Res Ther 8, R29 (2006).
5 Hyrich KL, Lunt M, Watson KD, Symmons DP, Silman AJ, Outcomes after switching from one anti-tumor necrosis factor alpha agent to a second anti-tumor necrosis factor alpha agent in patients with rheumatoid arthritis: results from a large UK national cohort study. Arthritis Rheum 56:13-20 (2007).
6 ten Wolde S et al., Randomised placebo-controlled study of stopping second-line drugs in rheumatoid arthritis. Lancet 347:347-352 (1996).