Schmerz in der Rheumatologie
Genaue Anamnese
Die genaue Exploration eines Rheumapatienten, der immer (auch) wegen Schmerzen den Rheumatologen aufsucht, lohnt sich; eine Visite ohne die Frage nach Schmerzen wäre inkomplett.
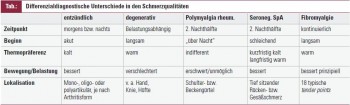
Die Frage nach der Schmerzqualität gibt evtl. schon ersten Aufschluss über entzündlichen oder degenerativen Charakter. So schildert der Arthritis-Patient Ruheschmerzen und Verschlechterung bei Wärmeapplikation bzw. nachts (Bettwärme!) und dementsprechend Besserung bei Kryotherapie; das Schmerzmaximum wird morgens angegeben, mit Besserung im Tagesverlauf. Degenerativer Schmerz ist eher durch den sog. Anlaufcharakter gekennzeichnet, bessert sich auf Thermoapplikation und ist belastungsabhängig, sprich: wird im Tagesverlauf gegen Abend stärker. Der Patient mit seronegativer Spondarthritis schildert typischerweise „tief sitzende“ Rücken- bzw. Gesäßschmerzen, mit Beginn vor dem 45. Lebensjahr, Störung der Nachtruhe, Morgensteifigkeit im Kreuz, wobei sich sowohl Steifigkeit als auch Schmerzen auf Bewegung bessern. Wichtig sind auch Fragen nach dem Schmerzbeginn bzw. vorangegangener Ereignisse: War der Beginn schleichend oder akut? Ist der Schmerz im Anschluss an ein Trauma oder einen Infekt aufgetreten? Bestehen Wetterabhängigkeit bzw. saisonale Schwankungen? (Tabelle)
Das quantifizierende Schmerz-Assessment mittels VAS (Visual Analogue Scale) Pain von 0–100 (0 = kein Schmerz, 100 = maximal vorstellbarer Schmerz) ist fester Bestandteil bei der Erstbegutachtung bzw. jeder Verlaufskontrolle eines Rheumapatienten. Schmerzwahrnehmung, Schmerzschwelle und der Umgang mit Schmerz ist natürlich auch stark von der psychosoziokulturellen Situation des Patienten und seinem Umfeld geprägt.
Pathophysiologie
Die physiologische Schmerzverarbeitung funktioniert über den Empfang von schmerzhaften peripheren Stimuli, die über Nervenfasern in das Hinterhorn des Rückenmarks geleitet werden, von wo sie nach einer ersten Integration der Signale ins Gehirn in die sog. Schmerzmatrix projiziert werden1. Diese wird sowohl von emotionalen als auch sensorisch-diskriminativen Zentren beeinflusst. Pathologische Schmerzverarbeitung (engl. pain processing) findet z. B. bei Entzündungen (steril wie die Synovitis, aber auch erregerbedingte Infektionen), Malignomen oder Neuropathien statt.
Hält ein Schmerz über längere Zeit an, dann kann er chronifizieren, was an mehreren Stellen bzw. auf mehreren Ebenen stattfinden kann: Schmerz kann sich „verselbständigen“, was über so genannte „Wind-up-Phänomene“ im Rückenmark geschieht – sprich: die Balance zwischen exzitatorischen aufsteigenden Reizen und inhibitorischen absteigenden Neuronen ist gestört –; ferner kann es zu strukturellen Änderungen mit Debzw. Regeneration von Axonen und zentral zur Störung dendritischer Verbindungen kommen.
Pathophysiologisch gelangte man in den letzten Jahren zu entscheidenden Erkenntnissen, wie die Entzündungsreaktion mit den Schmerzsignalen verbunden ist.
Auf intrazellulärer Ebene spielt der auf Makrophagen gelegene ATP-anhängige Ca-Kanal P2X4 bei der Nozizeption durch Aktivierung von Prostaglandin E2 eine große Rolle. Kalzium ist wahrscheinlich der wichtigste intrazelluläre second messenger für die Aktivierung der Arachidonsäurekaskade. Da P2X4-Rezeptoren sowohl zentral als auch in der Peripherie vorkommen, könnte deren Blockade einerseits den peripheren Schmerz am Ort des Geschehens reduzieren, andererseits auch zentral ansetzen.
Bezüglich des neuropathischen Schmerzes mehren sich die Hinweise, dass TNF-α sowohl zentral als auch peripher an der Schmerzvermittlung beteiligt ist – allerdings hat sich die TNF- α-Blockade beim neuropathischen Schmerz als klinisch unwirksam herausgestellt. Die Schmerzkupierung mittels intrazellulärer Signalblockade über andere Zytokine (z. B. MAP-Kinasen) stellt auch einen möglichen zukünftigen Therapieansatz dar.
2009 konnte in einer Studie gezeigt werden, dass RA-Patienten eine verstärkte Reaktivität auf Schmerzreize haben; dies unterstreicht die Wichtigkeit ausreichender Analgesierung in diesem Patientenkollektiv; optimalerweise sollten auch „nichtentzündliche“ Kofaktoren wie Schlafprobleme und psychischer Stress in diese Überlegungen mit einfließen2.
Interessant ist, dass Nikotinabusus sowohl akute als auch chronische Schmerzzustände beeinflusst. Nikotin an sich wirkt analgetisch; Raucher haben aber z. B. ein höheres Risiko fürRückenschmerzen und erleben Schmerzen intensiver als Nichtraucher; inwiefern hier durch Rauchen verursachte Komorbiditäten eine Rolle spielen, muss erst geklärt werden. Für die negativen Auswirkungen des Nikotinkonsums z. B. auf Patienten mit RA (seropositiv bzw. ACPA-positiv) oder auch auf PatientInnen mit Osteoporose besteht mittlerweile ausreichend Evidenz.
Schmerztherapie
Diese richtet sich selbstredend nach der zugrunde liegenden Erkrankung und kann nicht über einen Kamm geschoren werden. Nichtsteroidale Antirheumatika (NSAR) sind nach wie vor Mittel der 1. Wahl für entzündlich rheumatische Zustände. Die COX-2-HEMMER (Coxibe) wurden in den letzten Jahren wegen fraglicher Kardiotoxizität als Klasseneffekt – aufgrund der erhöhten kardiovaskulären Mortalität von Rofecoxib in der VIGOR-Studie, das deswegen auch vom Markt genommen wurde – eher gemieden. Diese Hypothese hat sich nicht bestätigt, sodass Coxibe rezent eine Renaissance erleben und für ein selektioniertes Patientengut (z. B. CED-Patienten, Patienten nach blutendem Ulcus ventriculi oder duodeni oder mit NSAR-induzierter Colitis) nach Ausschluss einer kardialen Kontraindikation eine gute und sichere Therapieoption darstellen. Mögliche strukturmodifizierende Eigenschaften von NSAR und Coxiben bei entzündlichen Wirbelsäulenerkrankungen im Sinne einer Verzögerung der sekundär postentzündlich auftretenden Ossifikationen werden seit Längerem diskutiert und untermauern deren Einsatz in dieser Indikation.
Paracetamol ist ebenfalls ein „Basisanalgetikum“ und das von der EULAR empfohlene First-Line-Analgetikum bei Osteoarthrose3.
Systemische Steroide sind aus der Akut- und Schubtherapie der RA nicht wegzudenken und sind auch für die Polymyalgia rheumatica bzw. Riesenzellarteritiden das Therapeutikum der Wahl zur prompten Schmerzkupierung.
Opioide: Im chronischen Setting wird es öfters notwendig sein, aufgrund höherer analgetischer Potenz oder wegen Komorbiditäten (chronisch renale Insuffizienz, kardiale Probleme, gastrointestinale Kontraindikationen) auf ein Opioid zu wechseln. Unerlässlich ist die Aufklärung des Patienten bezüglich häufiger Nebenwirkungen (Nausea, Schwindel, Suchtpotenzial, Einschränkung der Fahrtüchtigkeit während der Einstellungsphase bzw. Dosisänderungen etc.). Gerade Rheumapatienten mit häufiger Polypharmazie profitieren von einer nicht peroralen Aufnahmeart wie z. B. transdermalen Opiatpflastern, die nur alle 72 Stunden gewechselt werden müssen – mit der Option der bedarfsgemäßen oralen Zusatzmedikation im Fall von Schmerzspitzen (orales kurz wirksames Opioid, Paracetamol, Metamizol, Mefenaminsäure). Auch ältere Patienten profitieren von einer Opioidtherapie; allerdings kann sich gerade in diesem Patientenkollektiv durch vermehrte Sturzneigung das Risiko erhöhen, eine Fraktur zu erleiden.
Zusätzlich besteht die Möglichkeit topischer NSAR-Anwendungen, physikalischer Therapie bzw. alternativmedizinischer Methoden. Für die Fibromyalgie wurden bereits etliche Präparate getestet: es gibt positive schmerzreduzierende Ergebnisse für diverse Antidepressiva wie z. B. Milnacipran und Duloxetin und für Gabapentin und Pregabalin4. Auch wenn Therapierichtlinien und -empfehlungen zur Verfügung stehen, ist die analgetische Therapie immer individuell auf den Patienten abzustimmen.
1 Kuner R, Central mechanisms of pathological pain. Nat Med 2010; 16(11):1258–66
2 Edwards RR, Wasan AD, Bingham CO et al., Enhanced reactivity to pain in patients with RA. Arthritis Res Ther 2009; 11(3):R61
3 Zhang W, Doherty P, Leeb BF et al., EULAR evidence based recommendations for the management of hand OA:ESCISIT. Ann Rheum Dis 2007; Mar 66(3):377–88
4 Carville SF, Arendt-Nielsen S, Bliddal H, EULAR evidence-based recommendations fort he management of fibromyalgia syndrome. Ann Rheum Dis. 2008 Apr; 67(4):536–41