Endokrine Therapie 2.0 – Einsatz von Resistenzblockern
Antihormonelle Therapie gilt als Standard in der Therapie des Hormonrezeptor-positiven (HR+), HER2-negativen (HER2–) metastasierten Mammakarzinoms. Das Auftreten von endokriner Resistenz kann durch eine abnorme Aktivität der PI3K-Akt-mTOR-Signalkaskade (PI3K – Phosphatidylinositol-3-Kinase; mTOR – mammalian Target of Rapamycin) erklärt werden. Demnach konnten zielgerichtete Substanzen mit Einfluss auf das Tumorzellwachstum über molekulare Mechanismen die Wirkung der endokrinen Therapie verbessern.1–3
mTOR-Inhibitor Everolimus
Everolimus, ein selektiver mTOR-Inhibitor, ist in Kombination mit Exemestan zur Therapie des fortgeschrittenen HR+/HER2–-Mammakarzinoms bei postmenopausalen Frauen ohne symptomatische viszerale Metastasierung indiziert, nachdem es zu einem Rezidiv oder einer Progression nach einem nichtsteroidalen Aromataseinhibitor gekommen ist.a
In der Zulassungsstudie BOLERO-2, einer randomisierten Phase-III-Studie, wurden Everolimus + Exemestan mit Placebo + Exemestan bei fortgeschrittenem HR+-Brustkrebs mit Rezidiv oder Progress während endokriner Therapie verglichen. Dabei zeigte sich eine Verlängerung des medianen progressionsfreien Überlebens (PFS) um mehr als das Doppelte: 7,8 vs. 3,2 Monate, retrospektiv (p < 0,0001). Stomatitis und Hautausschlag (alle Grade) (59 % vs. 12 %, 39 % vs. 7 %, jeweils retrospektiv) galten als häufigste Nebenwirkungen in der Everolimus-Gruppe. Pneumonitis (alle Grade) wurde mit 16 % vs. 0 % (retrospektiv) angegeben.1, 2, 4
Im Speziellen beim lobulären metastasierten Mammakarzinom spielt die Dysregulation der Akt-Kaskade mit Überexpression von Cyclin E eine wichtige Rolle bei endokriner Resistenz.
Im Rahmen des diesjährigen ESMO-Kongresses in Barcelona, Spanien, wurde eine Studie präsentiert, die Palbociclib + Fulvestrant vs. Everolimus + Exemestan als antihormonelle Zweitlinientherapie bei 74 Patientinnen mit dieser Tumorentität untersuchte. Dabei zeigte sich ein signifikant längeres PFS bei Everolimus + Exemestan im Vergleich zu Palbociclib + Fulvestrant (6,0 vs. 4,6 Monate,p = 0,04, retrospektiv).*
CDK-4/6-Inhibitoren
Die in Österreich zugelassenen CDK-4/6-Inhibitoren Palbociclib, Ribociclib und Abemaciclibb–d – „small-molecule inhibitors“ von CDK 4 und CDK 6 – bewirken eine Hemmung der Zellproliferation. CDK-4/6-Inhibitoren gelten als gut verträgliche Medikamente. Das Nebenwirkungsprofil aller drei Substanzen ist sehr ähnlich, allerdings gibt es einige Unterschiede. So ist Neutropenie die häufigste Nebenwirkung von Palbociclib und Ribociclib, eine Verlängerung der QT-Zeit sowie hepatobiliäre Toxizität sind im Zusammenhang mit Ribociclib auch erwähnenswert. Gastrointestinale Nebenwirkungen (u. a. Diarrhö) werden im Speziellen mit Abemaciclib assoziiert. Regelmäßiges Monitoring ist von großer Bedeutung, um so etwaige Toxizitäten zu erkennen und entsprechend zu handeln.5–7
Palbociclib: In der randomisierten Phase-III-Studie PALOMA-2 wurde die Wirksamkeit von Palbociclib in Kombination mit Letrozol im Vergleich zu Letrozol plus Placebo bei Frauen mit ER-positivem, HER2-negativem lokal fort geschrittenem oder metastasiertem Brustkrebs untersucht. Dabei konnte ein medianes PFS von 24,8 vs. 14,5 Monate (p < 0,001, retrospektiv) gezeigt werden.8 Die PALOMA-3-Studie verglich Palbociclib + Fulvestrant mit Fulvestrant + Placebo bei Frauen mit lokal fortgeschrittenem oder metastasiertem HR+/HER2–-Brustkrebs. Hierbei lag das mediane PFS bei 9,5 vs. 4,6 Monaten (p < 0,0001, retrospektiv).9 Die aktive Phase-III-Studie PALLAS (PALbociclib CoLlaborative Adjvuant Study, NCT02513394) untersucht Palbociclib (über 2 Jahre) gemeinsam mit endokriner Standardtherapie (mind. 5 Jahre) im Vergleich zu endokriner Standardtherapie (mind. 5 Jahre) im adjuvanten Setting bei frühem HR+/HER2–-Brustkrebs. Primärer Studienendpunkt ist das invasive krankheitsfreie Überleben (iDFS).
Ribociclib zeigte in Kombination mit endokriner Therapie einen Überlebensvorteil bei prä- und perimenopausalen Patientinnen im Rahmen der MONALEESA-7-Studie.10
Beim ESMO 2019 wurden positive Überlebensdaten der MONALEESA-3-Studie (postmenopausale Patientinnen, Fulvestrant ± Riboclicib) präsentiert: mit signifikanter Verlängerung des Gesamtüberlebens mit Ribociclib gegenüber Placebo.**
Abemaciclib: Über einen statistisch signifikanten Vorteil des medianen Gesamtüberlebens von 9,4 Monaten in der Abemaciclib-Gruppe der MONARCH-2-Studie (Abemaciclib + Fulvestrant vs. Fulvestrant + Placebo) wurde ebenfalls im Rahmen des ESMO 2019 berichtet.***
PI3Kα-Inhibitor Alpelisib
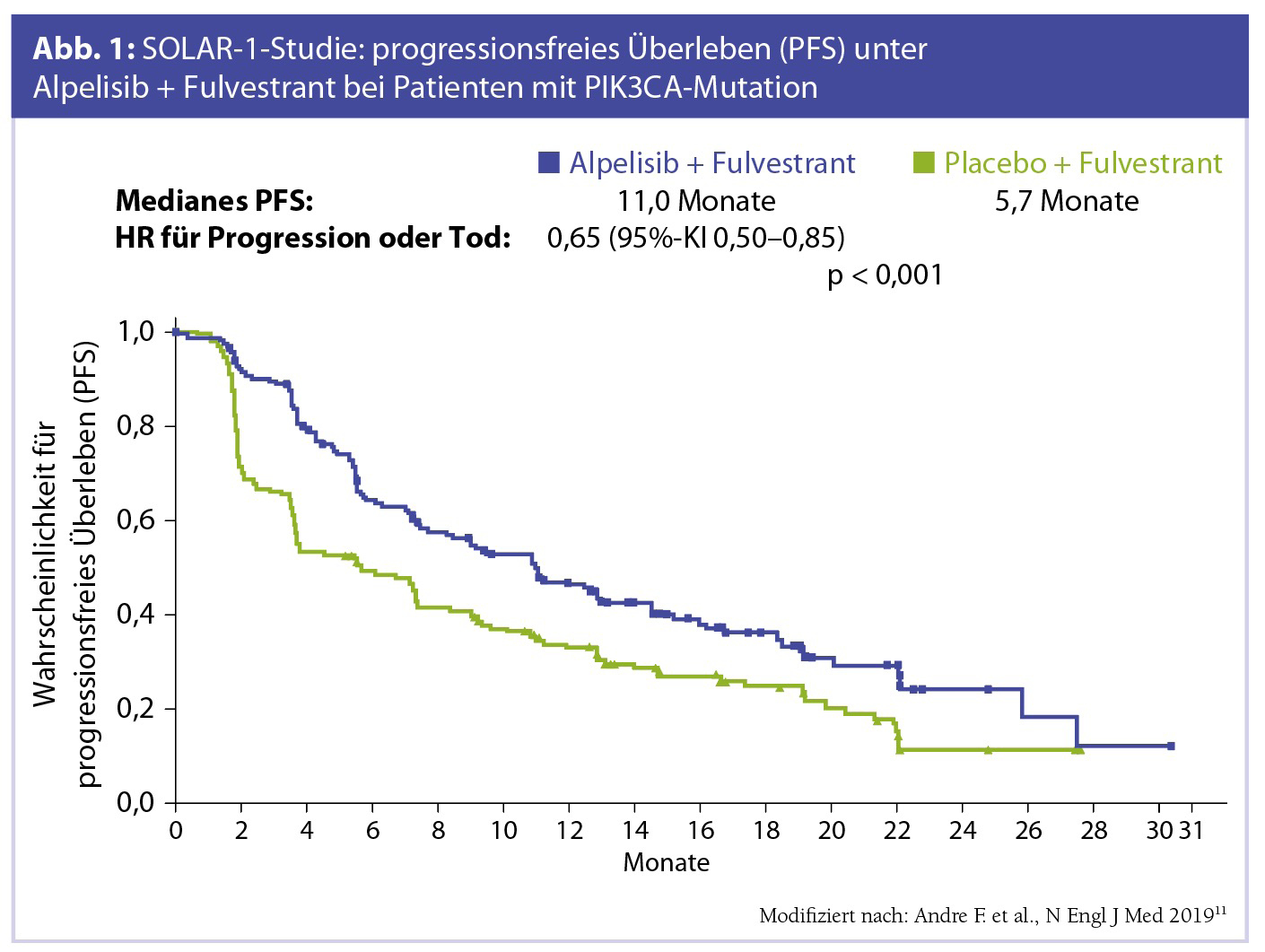
PIK3CA-Mutationen treten in ca. 40 % aller Patienten mit HR+/HER2–-Brustkrebs auf.11 Das Vorhandensein dieser Mutation ist ein unabhängiger negativer prognostischer Faktor und korreliert mit schlechterer Prognose.12 Alpelisib, ein PI3Kα-spezifischer Inhibitor, wurde in der randomisierten Phase-III-Studie SOLAR-1 untersucht, die Alpelisib+ Fulvestrant mit Placebo + Fulvestrant bei lokal fortgeschrittenem HR+/HER2–-Brustkrebs mit antihormoneller Therapie in der Anamnese verglich. Alpelisib + Fulvestrant verlängerten das PFS bei Patienten mit einer PIK3CA-Mutation (11,0 vs. 5,7 Monate, p < 0,001, retrospektiv) (Abb. 1). Zu den häufigsten Grad-3/4-Nebenwirkungen in der Alpelisib-Gruppe zählten Hyperglykämie, Hautausschlag und Diarrhö.11 Die Zulassung von Alpelisib durch die U.S. Food and Drug Administration (FDA) erfolgte im Mai 2019.
Aktuelles aus San Antonio
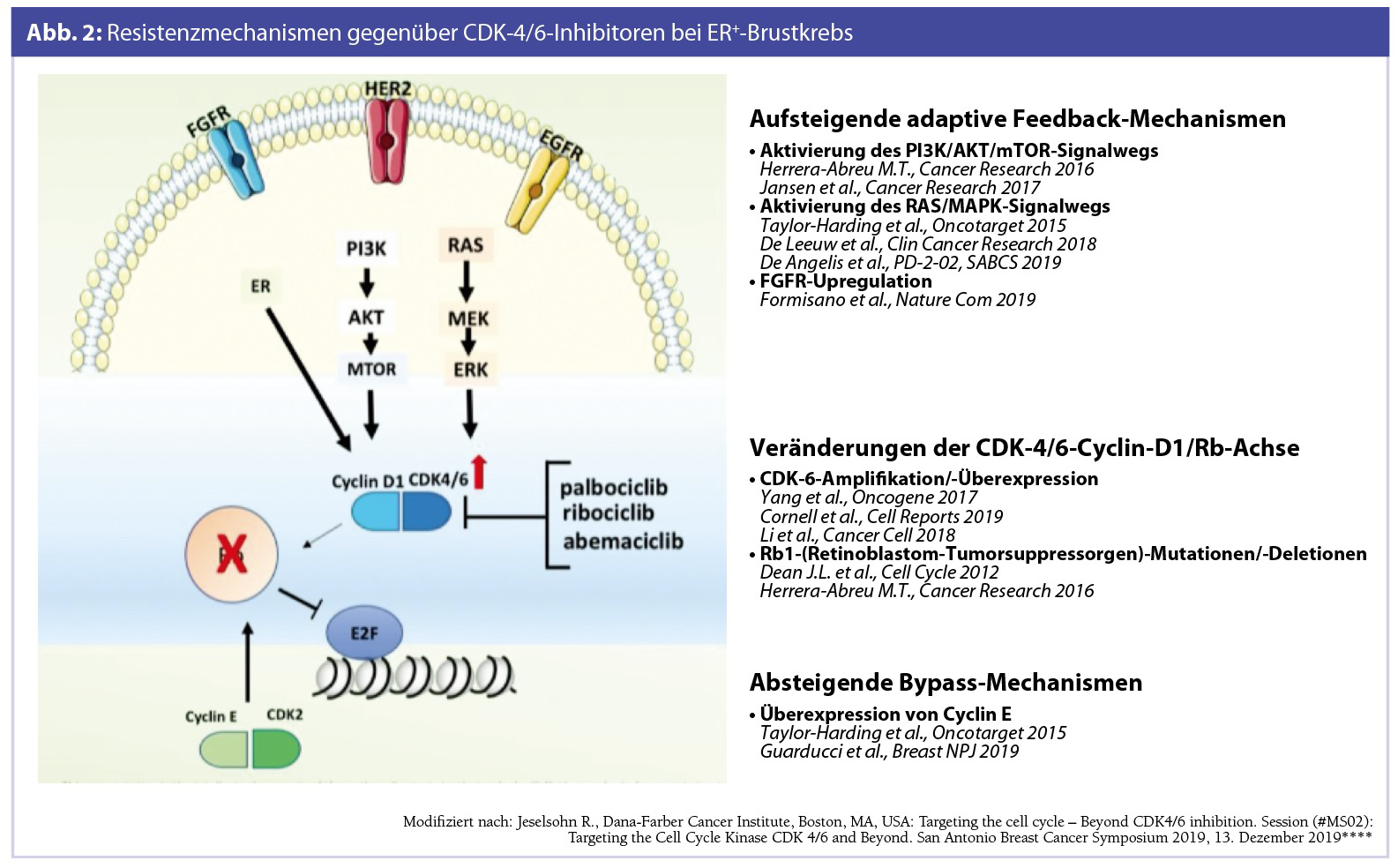
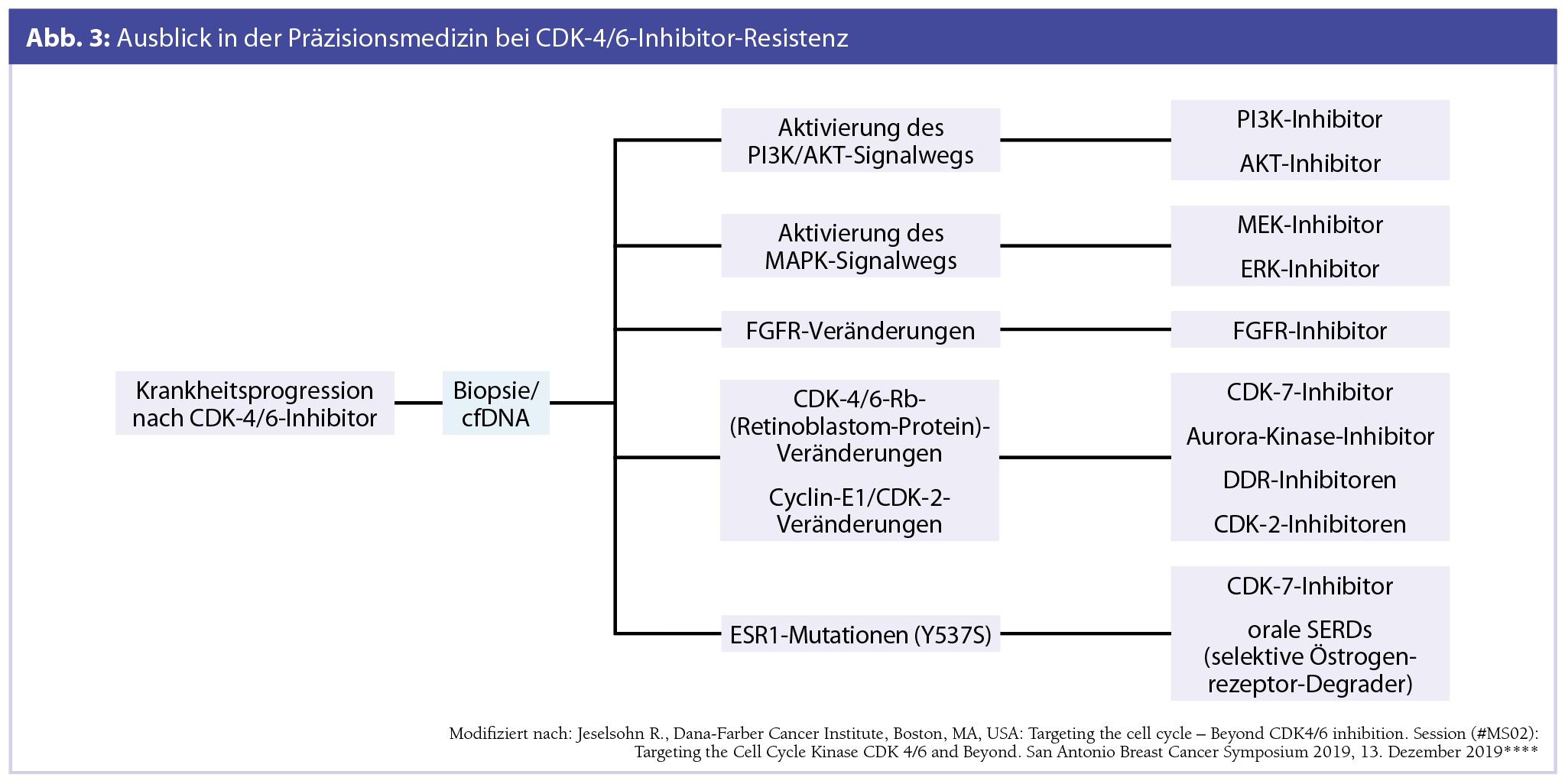
Einen Überblick über Resistenzmechanismen gegenüber CDK-4/6-Inhibitoren und über daraus folgende therapeutische Möglichkeiten gab Rinath Jeselsohn, MD (Dana-Farber Cancer Institute, Boston, MA, USA) in ihrem Vortrag „Targeting the cell cycle – Beyond CDK4/6 inhibition“ im Rahmen des San Antonio Breast Cancer Symposiums (San Antonio, Texas, USA, 10.–14. Dezember 2019). Dabei wurden u. a. die Aktivierung der PI3K/Akt/mTOR- bzw. RAS/ MAPK-Signalkaskade, die Hochregulierung des FGFR (Fibroblast Growth Factor Receptor), CDK-6-Überexprimierung, Mutation des Retinoblastom-Tumorsuppressorgens (Rb1) sowie Überexpression von Cyclin E diskutiert (Abb. 2). Resistenz gegenüber CDK-4/6-Inhibitoren gilt als heterogen, sodass Präzisionsmedizin in diesem Setting jedenfalls bedeutend erscheint (Abb. 3). Laufende klinische Studien sollen schließlich zu Therapieempfehlungen führen.****
Referenzen:
Austria-Codex Fachinformation zu
a Afinitor® 10 mg Tabletten, Stand der Information: Mai 2018
b Ibrance® 125 mg Hartkapseln, Stand der Information: Juli 2018
c Kisqali® 200 mg Filmtabletten, Stand der Information: Dezember 2018
d Verzenios® 50 mg Filmtabletten, Stand der Information: September 2018
* Orlandi A. et al., Annals of Oncology 2019; 30 (Suppl. 5): v104–v142; 10.1093/annonc/mdz242. ESMO 2019 Congress, 29 September 2019
** Slamon D. et al., Annals of Oncology 2019; 30 (Suppl. 5): v851–v934; 10.1093/annonc/mdz394. ESMO 2019 Congress, 29 September 2019
*** Sledge G. et al., Annals of Oncology 2019; 30 (Suppl. 5): v851–v934; 10.1093/annonc/mdz394. ESMO 2019 Congress, 29 September 2019
**** Jeselsohn R., Dana-Farber Cancer Institute, Boston, MA, USA: Targeting the cell cycle – Beyond CDK4/6 inhibition. Session (#MS02): Targeting the Cell Cycle Kinase CDK 4/6 and Beyond. San Antonio Breast Cancer Symposium 2019, 13. Dezember 2019
- Baselga J. et al.: Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 2012; 366 (6): 520–529
- O’Shaughnessy J. et al.: Everolimus-based combination therapies for HR+, HER2– metastatic breast cancer. Cancer Treat Rev 2018; 69: 204–214
- Schiff R. et al.: Cross-talk between estrogen receptor and growth factor pathways as a molecular target for overcoming endocrine resistance. Clin Cancer Res 2004; 10 (1 Pt 2): 331S–336S
- Yardley D.A. et al.: Everolimus plus exemestane in postmenopausal patients with HR(+) breast cancer: BOLERO-2 final progression-free survival analysis. Adv Ther 2013; 30 (10): 870–884
- Spring L.M. et al.: Clinical Management of Potential Toxicities and Drug Interactions Related to Cyclin-Dependent Kinase 4/6 Inhibitors in Breast Cancer: Practical Considerations and Recommendations. Oncologist 2017; 22 (9): 1039–1048
- Thill M. et al.: Management of adverse events during cyclin-dependent kinase 4/6 (CDK4/6) inhibitor-based treatment in breast cancer. Ther Adv Med Oncol 2018; 10: 1758835918793326
- Lynce F. et al.: CDK4/6 inhibitors in breast cancer therapy: Current practice and future opportunities. Pharmacol Ther 2018; 191: 65–73
- Finn R.S. et al.: Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med 2016; 375 (20): 1925–1936
- Cristofanilli M. et al.: Fulvestrant plus palbociclib vs. fulvestrant plus placebo for treatment of hormone-receptor-positive, HER2-negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA-3): final analysis of the multicentre, double-blind, phase 3 randomised controlled trial. Lancet Oncol 2016; 17 (4): 425–439
- Im S.A. et al.: Overall Survival with Ribociclib plus Endocrine Therapy in Breast Cancer. N Engl J Med 2019; 381 (4): 307–316
- Andre F. et al.: Alpelisib for PIK3CA-Mutated, Hormone Receptor-Positive Advanced Breast Cancer. N Engl J Med 2019; 380 (20): 1929–1940
- Sobhani N. et al.: The prognostic value of PI3K mutational status in breast cancer: A meta-analysis. J Cell Biochem 2018; 119 (6): 4287–4292