Pro HPV-Screening: zunehmende Evidenz
Zwei grundlegenden Anforderungen muss ein modernes Screening des Zervixkarzinoms genügen: Zum einen muss das Risiko für Frauen, die an einem Zervixkarzinom oder an einer seiner behandlungswürdigen Vorstufen erkrankt sind, sicher erkannt werden, um diese Frauen einer weiteren Abklärung zuzuführen. Zum anderen müssen Frauen ohne Risiko sicher erkannt werden, um diese vor unnötiger Abklärung, wiederholten Untersuchungen und Verunsicherung zu bewahren. Mit einer Sensitivität von fast 100 % und einem negativen Vorhersagewert von nahezu 100 % erfüllt die HR-HPV-Testung beide Anforderungen in idealer Weise.
Höhere Sensitivität als der Pap-Test: In zahlreichreichen großen und z. T. randomisierten Studien wurde die Leistungsfähigkeit von HR-HPV-DNA-Test und Pap-Test (konventionell und Dünnschicht) für das Screening des Zervixkarzinoms miteinander verglichen: ARTISTIC (Kitchener H. C., 2006, 2009); POBASCAM (Bulkmans N. W., 2004, 2007; Rijkaart D. C., 2012); NTCC (Ronco G., 2006, 2010); SwedeScreen (Naucler P., 2007, 2010); CCCaST (Mayrand M. H., 2007, 2009); India Screening trail (Sankaranarayanan R., 2009); Finnish screening trail (Leiomen M., 2009); ATHENA (Wright T. C. Jr., 2012) und VUSA (Rijkaart D. C., 2012). Im Ergebnis dieser Studien wird deutlich, dass der HR-HPV-Test für die Detektion von CIN 2+ um ca. ein Drittel und für die Detektion von CIN 3+ ca. ein Fünftel bis ein Viertel sensitiver ist als der Pap. Die FASE-Studie (Monsonego J., 2011, 2012) zeigt mit einem HR-HPV-smRNA-Test vergleichbare Ergebnisse. Dies bedeutet, dass mit einem HR-HPV-Screening Frauen mit CIN 2+ früher entdeckt sowie zeitiger und ohne ein Risiko der Progression behandelt werden können als mit einem Pap-Screening .
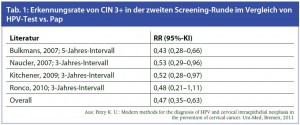 Längeres Screeningintervall mit gesundheitsökonomischem Impact: Vier Studien verglichen HR-HPV-Test und Pap-Test hinsichtlich des Risikos für CIN 3+ in der zweiten Screeningrunde bei negativem Testergebnis in der ersten Screeningrunde (Tab. 1). Alle Studien berichten eine ca. 50%ige Reduktion der Diagnose von CIN 3+ in der zweiten Screeningrunde bei Frauen, die in der ersten Runde einen negativen HPV-Test hatten, im Vergleich zu Frauen, die einen negativen Pap-Test hatten. Dies bedeutet, dass ein negativer HRHPV- Test deutlich sicherer eine CIN 3+ ausschließt als ein negativer Pap-Test. Eine praktische Konsequenz aus diesem Resultat ist, dass die Intervalle zwischen den Screeningrunden bei primärem HPV-Screening ausgeweitet werden können, was eine wichtige gesundheitsökonomische Implikation haben könnte. So kommen Berkhof et al. (2010) zu der Ansicht, dass bei primärer HR-HPV-Testung in Holland die Screeningintervalle bis zu 8 Jahren verlängert werden könnten, ohne dass ein höheres Risiko für CIN 2+ im Vergleich zur Pap-Testung entsteht. Die meisten Experten sprechen sich jedoch für Screeningrunden alle 2–5 Jahre aus.
Längeres Screeningintervall mit gesundheitsökonomischem Impact: Vier Studien verglichen HR-HPV-Test und Pap-Test hinsichtlich des Risikos für CIN 3+ in der zweiten Screeningrunde bei negativem Testergebnis in der ersten Screeningrunde (Tab. 1). Alle Studien berichten eine ca. 50%ige Reduktion der Diagnose von CIN 3+ in der zweiten Screeningrunde bei Frauen, die in der ersten Runde einen negativen HPV-Test hatten, im Vergleich zu Frauen, die einen negativen Pap-Test hatten. Dies bedeutet, dass ein negativer HRHPV- Test deutlich sicherer eine CIN 3+ ausschließt als ein negativer Pap-Test. Eine praktische Konsequenz aus diesem Resultat ist, dass die Intervalle zwischen den Screeningrunden bei primärem HPV-Screening ausgeweitet werden können, was eine wichtige gesundheitsökonomische Implikation haben könnte. So kommen Berkhof et al. (2010) zu der Ansicht, dass bei primärer HR-HPV-Testung in Holland die Screeningintervalle bis zu 8 Jahren verlängert werden könnten, ohne dass ein höheres Risiko für CIN 2+ im Vergleich zur Pap-Testung entsteht. Die meisten Experten sprechen sich jedoch für Screeningrunden alle 2–5 Jahre aus.
Sinnvolle Altersgrenze für primäres HPV-Screening: In den meisten entwickelten Ländern ist die Prävalenz der HPV-Infektion zwischen dem 20. und 25. Lebensjahr am höchsten. In diesem Alter sind die HPV-Infektionen jedoch sehr oft transient. Treten Dysplasien auf, so handelt es sich oft um CIN 1 oder CIN 2 mit einem hohen Anteil an spontanen Regressionen. Die meisten Experten sind deshalb der Ansicht, dass ein primäres Screening mit einem HR-HPV-Test erst ab dem 30. Lebensjahr sinnvoll ist. Die HPV-Prävalenz beträgt um das 30. Lebensjahr nur noch ca. 7 % und sinkt bei Frauen ab dem 35. Lebensjahr auf ca. 3–5 %. Es steigt dabei relativ der Anteil von Frauen mit transformierenden Infektionen. Für Österreich ist zu beantworten, welche wissenschaftlichen Daten noch benötigt werden, um sich zukünftig für ein primäres HPV-Screening ab 30 Jahren zu entscheiden.
Zugelassene HPV-Tests: Für die klinische Anwendung in der Routine wurden verschiedene Signal-Amplifikations- und PCR-basierte Tests entwickelt und klinisch validiert. Die Zulassung von Tests durch die amerikanische Gesundheitsbehörde FDA gilt international als wichtiger Qualitätsmarker. Derzeit sind 4 HPV-Tests durch die FDA approbiert: 1999 wurde dem Test Hybrid Capture® 2 (Fa. Qiagen) die Zulassung erteilt. 2009 folgte der Cervista® HPV HR (Fa. Hologic), 2011 wurden der HPV-Test Aptima® (Fa. Gen-Probe) und der Cobas®-HPV-Test (Fa. Roche) zugelassen. Für die klinisch wichtige Genotypisierung von HPV 16/18 sind von der FDA der Cervista®-HPV-16/18-Test (Fa. Hologic) und der Cobas®-HPV-Test (Fa. Roche) zugelassen. Die Reproduzierbarkeit dieser HR-HPV-Tests ist hoch.
Fazit: Viele unserer Bemühungen in Österreich gehen dahin, die Primärprävention des Zervixkarzinoms durch die HPV-Impfung zu verbessern. Für die Zukunft erscheint es deshalb nur logisch, den Erfolg der HPV-Impfung auch mit einem HPV-Test und nicht mit einem Pap-Test zu kontrollieren.























































































