Das Aldosteron-Paradoxon
In den vergangenen zehn Jahren wurden im Bereich der Nierenphysiologie bedeutende Forschungsergebnisse erzielt. Insbesondere die Aufklärung des Wirkmechanismus von Aldosteron am Tubulusapparat mit der Entdeckung neuer Kinasen und Transportproteine ist hervorzuheben.
Der Tubulusapparat und seine Angriffspunkte
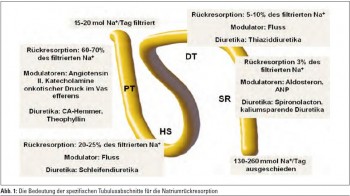
Täglich werden 25 mol Natrium in den Primärharn filtriert, davon allerdings nur etwa 130–260 mmol pro Tag ausgeschieden, da in den verschiedenen Abschnitten des Tubulusapparates eine entsprechende Rückresorption erfolgt (Abb. 1). 60–70% des filtrierten Natriums werden im proximalen Tubulusapparat rückresorbiert. Die Modulation erfolgt vor allem über Angiotensin II, Katecholamine und den onkotischen Druck im Vasefferens. Hier ergeben sich die Angriffspunkte für Diuretika, insbesondere Carboanhydrasehemmer und Theophyllin. Im folgenden Abschnitt, der Henle´schen Schleife, findet die Rückresorption von 20–25% des filtrierten Natriums statt. Die Modulation erfolgt über den Harnfluss. Die Henle´sche Schleife stellt den Ansatzpunkt für die Schleifendiuretika dar. Im anschließenden distalen Tubulus erfolgt die Rückresorption von 5–10% des filtrierten Natriums, auch hier erfolgt die Modulation über den Fluss. Thiaziddiuretika greifen im distalen Tubulusapparat an. Im letzten Abschnitt des Tubulusapparates, dem Sammelrohr, wo nur mehr 3% des Natriums rückresorbiert werden, setzt vor allem Aldosteron an. Dieses kann mit dem Aldosteronblocker Spironolacton und kaliumsparenden Diuretika beeinflusst werden.
Proximaler Tubulus
Ein quantitativ wichtiger Rückresorptionsmechanismus ist der Na+/H+-Austauscher, der für die Rückgewinnung des filtrierten Natriumbikarbonats aus dem Primärharn verantwortlich ist. Carboanhydrasehemmer wie Acetazolamid (Diamox®) inhibieren die Carboanhydrase und vermindern so den Austausch. Der natriuretische Effekt ist bescheiden, da er an weiter distal gelegenen Tubulusabschnitten kompensiert wird.
Henle´sche Schleife
Den wesentlichen Transporter im Bereich der Henle´schen Schleife stellt der Na-K-2Cl-Kotransporter dar. Er ist auch der Angriffspunkt für Schleifendiuretika. Drei Ionenbindungsstellen des Na-K-2Cl-Kotransporters müssen jeweils von einem Na-, Kalium- und Chlorid-Ion besetzt werden, bevor das zweite Chlorid-Ion binden kann. Schleifendiuretika kompetitieren als organische Säure mit Chlorid um diese letzte Bindungsstelle und hemmen so den Transporter. Eine chronische Therapie mit Schleifendiuretika führt weiter distal zu einer Tubulushypertrophie. Dadurch kommt es zu einer Adaptation, und die Natriumrückresorption im distalen Tubulus kann von physiologischerweise 5% auf 18% steigen. Damit ist der in der Henle´schen Schleife erzielte „Natriumgewinn“ im Endeffekt deutlich reduziert. Wenn man mit der sogenannten sequenziellen Tubulusblockade mit einem Thiaziddiuretikum oder Thiazidanalogon, wie Xipamid, zusätzlich den distalen Tubulusapparat hemmt, kann die Rückresorption auch im distalen Tubulusapparat inhibiert und letztendlich die Natriumausscheidung auf bis zu 19% gesteigert werden. So ist eine deutliche Zunahme der Flüssigkeitsausscheidung zu erzielen.
Distaler Tubulus
Den wichtigsten Transporter im Bereich des distalen Tubulus stellt der Natrium-Chlorid-Kotransporter dar (NCC). In diesem Bereich greifen Thiazide und analoge Substanzen wie Xipamid, Hydrochlorothiazid und Chlortalidon an, welche den elektroneutralen NCC blocken. Der NCC schleust ein Natrium- und ein Chlorid-Ion in die Zelle ein, Kalium wird nicht transportiert. Thiazide binden dann an die Anionenseite des Kotransporters und hemmen seine Aktivität. Ein Steady State wird nach sechs bis neun Tagen erreicht.
Sammelrohr
Die Natriumresorption im Sammelrohr erzeugt über spezielle Natriumkanäle (ENaC) einen elektrischen Gradienten in das Tubuluslumen und führt über separate Kaliumkanäle (ROMKKanal) zum Ausstrom von Kalium in das Tubuluslumen. Die Natriumkanäle werden direkt durch Amilorid und Triamteren gehemmt, gleichzeitig kommt es zu einer Verminderung der Kaliumsekretion (kaliumsparender Effekt). Aldosteronblocker, wie das Spironolacton, besetzen direkt den Aldosteronrezeptor, über den intrazelluläre Signaltransduktionskaskaden eine Hochregulation des ENaC-Kanals verhindern und somit den Natrium- Kalium-Austausch blockieren können.
In den vergangenen zehn Jahren wurden neue Transportproteine im distalen Nephron entdeckt und die Funktionsweise der entsprechenden Kanäle neu charakterisiert. In der Henle´schen Schleife findet man den ROMK-Kanal, den Natrium-Kalium- Chlorid-Kotransporter Typ 2, sowie für den Elektrolyttransport notwendige Kinasen wie WNK1, WNK3 sowie SPAK und OSR1. Im distalen Nephron (Sammelrohr und distaler Tubulus) finden sich noch WNK4, SGK1, der Natrium-Chlorid-Kotransporter NCC und ENaC. Mutationen, zum Beispiel von WNKKinasen, führen zu seltenen Erbkrankheiten, wie zur familiären hyperkalämische Hypertonie (Gordon-Syndrom). WNK-Kinasen sind direkt oder indirekt in die Regulation der Natrium-Kalium- Transporter im distalen Nephron und somit auch in die Pathogenese der Hypertonie involviert. WNK-Kinasen regulieren den Renal Outer Medullary Potassium Channel (ROMK), den Natrium-Kalium-Chlorid-Kotransporter Typ 2 (NKCC2), den Natrium-Chlorid-Kotransporter NCC und den epithelialen Natriumkanal (ENaC). Weiters modulieren sie viele andere Transportproteine wie SPAK oder OSR1 und SGK1. Man unterscheidet insgesamt vier WNK-Kinasen (WNK1, „kidney specific“ WNK1, WNK3 und WNK4). Diese Kinasen sind, wie schon erwähnt, vor allem entlang des Aldosteron-sensitiven Teils im distalen Nephron exprimiert.
Physiologie
WNK1, 3 und 4 phosphorylieren SPAK und OSR1, welche wiederum NKCC2 (Natrium-Kalium-Chlorid-Kotransporter Typ 2) und NCC (Natrium-Chlorid-Kotransporter) aktivieren. Es ist nicht bekannt, ob WNK-regulierte Transportproteine im Zytoplasma phosphoryliert werden, um somit die Insertion in die Membran zu ermöglichen, oder erst eine Phosphorylierung/ Aktivierung stattfindet, wenn das Transportprotein bereits in der Membran verankert ist.
Regulation des Natrium-Chlorid-Kotransporters (NCC)
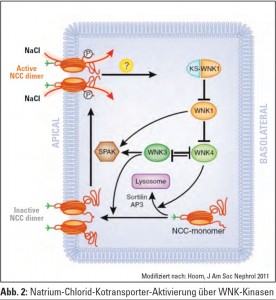
Wie in Abbildung 2 gezeigt, liegt der Kotransporter als Monomer vor und wird durch die Aktivierung über WNK3 in ein inaktives Dimer in die apikale Membran des distalen Tubulusapparates eingebaut. Bei Aktivierung mittels WNK1 und dem Transportprotein SPAC wird dieses inaktive NCC-Dimer aktiviert, sodass jetzt aktiv Natriumchlorid in die Zelle aufgenommen werden kann. Wie die Aktivierung wieder abgeschaltet wird, ist derzeit Gegenstand weiterer Untersuchungen. Interessanterweise hemmt WNK4 den Transport des Monomers in die Membran, während WNK3 dies stimuliert, WNK3 und WNK4 können sich gegenseitig inhibieren. WNK4 selbst wird über WNK1, und WNK1 über ein „kidney specific“ WNK1 reguliert. Es ist daher klar, dass durch Mutationen Genvarianten entstehen, die das sensible Gleichgewicht leicht stören können und es hier zu Veränderungen der Natriumrückresorption kommt.
Antwort der Niere auf die Aldosteron-Stimulation durch Hyperkaliämie
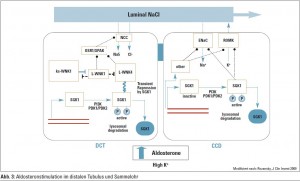
Hohe Kaliumkonzentrationen im Blut führen zu einer Aldosteron- Freisetzung aus der Nebenniere, in deren Folge es zu einer Aktivierung des Transportproteins SGK1 kommt. Im dis – talen Tubulus aktiviert SGK1 WNK4 und WNK4 inhibiert das „trafficking“ des Monomers durch das Zytosol und die Insertion in der Membran des Natrium-Chlorid-Kotransporters (Abb. 3). Dadurch wird im distalen Tubulusapparat kein Natrium rückresorbiert und es gelangt mehr Natrium zum Sammelrohr. Die Sekretion von Kalium ist flussabhängig. Je mehr Flüssigkeit durch Natrium gebunden wird und dort vorbeifließt, desto mehr Natrium kann gegen Kalium im Sammelrohr ausgetauscht werden. Das erklärt, wie SGK1 im Sammelrohr direkt bzw. über andere Transportproteine den epithelialen Natriumkanal (ENaC) aktiviert und so Natrium rückresorbiert und im Austausch Kalium über den ROMKKanal eliminiert werden kann. So kann der Körper rasch und effizient auf eine Hyperkaliämie mit einer Kaliurese reagieren.
Das Aldosteron-Paradoxon
Die Nieren können einerseits bei bedrohlichem Flüssigkeitsverlust und der daraus resultierenden Kontraktion des Extrazellulärvolumens Natrium sehr gut zurückhalten. Auf eine Hypokaliämie können die Nieren wiederum sehr schnell mit einer vermehrten Kaliumausscheidung reagieren. Die Fähigkeit der Nieren, Natrium zu erhalten und Kalium auszuscheiden, war im Paläolithikum aufgrund der salzarmen und kaliumreichen Ernährung sehr wichtig.
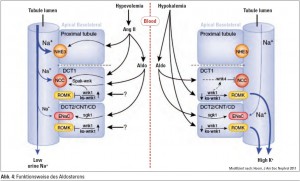
Aldosteron spielt eine zentrale Rolle bei der Natriumrückresorption und der Kaliumsekretion durch Regulation über NCC, ENaC und ROMK. Aldosteron wird als Antwort auf Angiotensin II sezerniert und führt primär zur Natriumretention. Wenn Aldosteron aufgrund des Stimulus der Hyperkaliämie freigesetzt wird, wirkt es kaliuretisch. Die Beobachtung, dass Aldosteron abhängig vom sekretorischen Stimulus unterschiedliche Funktionen hat, wurde als Aldosteron-Paradoxon bezeichnet. Der Mechanismus wurde rezent besser, aber immer noch nicht umfassend aufgeklärt. Wie in Abbildung 4 dargestellt, kann Aldosteron zwei Dinge gleichzeitig: einerseits Natrium bei bestehender Hypovolämie über Angiotensin II zu retinieren. Angiotensin II löst eine maximale Natrium rückresorption im proximalen Tubulus aus, reguliert über Aktivierung von Aldosteron, SPAC und WNK im distalen Tubulus NCC hoch und führt so auch zu einer Natriumrückresorption im distalen Tubulus. Das restliche Natrium wird über die Aktivierung über SGK1 und ENaC im Sammelrohr rückresorbiert. Dadurch wird Natrium maximal zurückgehalten. Beim Stimulus der Hyperkaliämie andererseits (wie im rechten Teil der Abbildung 4 zu sehen) kommt es direkt zu einer Aktivierung von WNK4, welche im distalen Tubulusapparat die Expression des NCC-Kanals inhibiert, wodurch Natrium im distalen Tubulus nicht rückresorbiert wird. Damit ist mehr Natrium im Sammelrohr vorhanden und es kann hier Natrium gegen Kalium ausgetauscht werden. Dies wird über die direkte Aktivierung von SGK1 und andere Signaltransduktionswege mittels Aldosteron in Gang gesetzt. Dadurch kommt es zu einer massiven Kaliurese.
Klinische Relevanz der WNK-Kinasen
Mutationen im Bereich von WNK1 und/oder 4 führen zu einer seltenen autosomal dominant vererbten Erkrankung, dem sogenannten Gordon-Syndrom. Dieses manifestiert sich mit Hypertonie, Hyperkaliämie, Hyperkalziurie und einer metabolischen Azidose. Die Korrektur erfolgt mit Thiaziddiuretika. Neben dem Aldosteron-Paradoxon wurde in der rezenten Vergangenheit auch der Begriff des essenziellen Hypertonie- Paradoxons geprägt. Die wesentliche Herausforderung besteht in der Lösung des Paradoxons: mehr unkontrollierte Hypertonie trotz verbesserter Therapie, wie es von Chobanian im New England Journal of Medicine 2009 beschrieben wurde. Eine Ursache dieses Paradoxons könnte das fehlende Verständnis der molekularen Mechanismen der Hypertonie darstellen. Die Mehrzahl der mit Hypertonie assoziierten Gene deutet auf eine Rolle der Niere hin. WNK stellen eine vielversprechende Verbindung für die Genese der Hypertonie dar.
In mehreren Untersuchungen wurden nun „Single nucleotide“- Polymorphismen und Haplotypen in WNK1- und WNK4- Genen gefunden, die mit Blutdruckvariabilität, Schweregrad der Hypertonie, Salzsensitivität, Thiazidsensitivität und Kaliurese assoziiert waren. Rezente Studien (Tobin et al., Circulation 2005; Turner et al., Hypertension 2005) bestätigen diese These. Insbesondere die Salzsensitivität kann über verschiedene Genvarianten von WNK1 erklärt werden, ebenso das unterschiedliche Ansprechen auf Thiaziddiuretika. Kombinationen von Genvarianten von WNK1-Alpha-Adducin und NEDD4L sind mit einem höheren Blutdruck verbunden. Bei dieser ungünstigen Genkombination steigt der Blutdruck im Salzbelastungstest höher an als mit vergleichbaren Genvarianten bzw. als im Vergleich zur Durchschnittsbevölkerung.
Zusammenfassend kann daher als klinische Relevanz von WNK-Kinasen Folgendes festgehalten werden: Mutationen in WNK1 oder WNK4 führen zu familiärer hyperkalämischer Hypertonie. Salzretention durch Aldosteron oder Angiotensin II wird über WNK-Kinasen vermittelt. Polymorphismen von WNK1 und WNK4 sind mit Hypertonie assoziiert. Die WNK stellen vielversprechende Kandidaten zur Entwicklung von neuen Antihypertensiva dar.