IgA-Nephropathie
Die IgA-Nephropathie (IgAN) ist mit einem Anteil von etwa 35 % die häufigste Glomerulonephritisform der westlichen Welt1. Die IgA-Nephritis wurde erstmals 1968 von Berger und Hinglais, basierend auf immunhistologischen Merkmalen mit Ablagerung von Immunglobulin A (IgA), bestehend aus polymerem IgA1 im Mesangium der erkrankten Glomerula, beschrieben. Weiters kommt es zu einer charakteristischen Vermehrung von Mesangiumzellen sowie zu einer Verbreiterung der mesangialen Matrix. Die Menge des abgelagerten IgA korreliert jedoch nicht mit dem Schweregrad der Erkrankung. Die Pathogenese ist zum gegebenen Zeitpunkt noch nicht vollständig geklärt. Das aktuelle Modell der Krankheitsentstehung geht von einem vierstufigen Krankheitsprozess der IgAN aus2.
- Bei Patienten mit IgAN ist der Anteil von IgA1-Molekülen erhöht, die aufgrund einer genetischen Variation einen verminderten Anteil an O-glykosidisch gebundenen galaktosehaltigen Kohlenhydratseitenketten aufweisen3–6.
- Die abweichende Glykosylierung der IgA-Moleküle führt dazu, dass diese vom Immunsystem potenziell als körperfremd erkannt werden, was zur Bildung von Autoantikörpern der Klasse IgG gegen die IgA1-Molküle führt7.
- Diese IgG-Autoantikörper bilden durch Bindung an die galaktosedefizienten IgA1-Moleküle zirkulierende Immunkomplexe, welche sich im Mesangium der Glomerula ablagern3.
- Jene IgG-/IgA1-haltigen Immunkomplexe können über einen noch nicht bekannten Mechanismus die Mesangiumzellen aktivieren und extrazelluläre Matrix, Zytokine und Chemokine induzieren, was zur entzündlichen Destruktion der Glomerula führen kann.
Es wurde bereits ein Assay für diese glykanspezifischen (Auto-)IgG etabliert. Es zeigte sich bei IgAN-Patienten im Vergleich zu Patienten mit anderen Erkrankungen eine 88%-ige Spezifität und eine 95%-ige Sensitivität. Es konnte auch eine Korrelation mit dem Ausmaß der Proteinurie hergestellt werden7. Mit der Etablierung solcher Testverfahren verbindet sich die Hoffnung einer nichtinvasiven Diagnostik und/oder Aktivitätsbeurteilung der IgAN.
Rezent fokussierte sich die Gruppe von Cox et al. auf Patienten mit makrohämaturischer IgAN8. Periphere mononukleäre Zellen (PBMC) wurden während einer Episode makroskopischer Hämaturie sowie anschließend in der Phase der Remission mit persistierender mikroskopischer Hämaturie isoliert. Es wurde eine Hochregulation des Chemokinrezeptors CX3CR1 bei natürlichen Killerzellen, natürlichen T-Killer-Zellen, CD8+-Zellen und γ- sowie δ-T-Zellen zum Zeitpunkt der makroskopischen Hämaturie festgestellt. Im Gegensatz dazu war bei mikroskopischer Hämaturie keinerlei Hochregulation messbar. Schließlich wurden auch Erhöhungen des korrespondierenden Liganden von CX3CL1 (Fraktalkine) in den Nierenhistologien sowie im Harn von Patienten mit IgAN mit rezidivierenden Episoden einer makroskopischen Hämaturie gefunden. Die Autoren schließen daraus, dass die „CX3CL1-Fraktalkine-Achse“ wesentlich zur Erkenntnis der Pathogenese der Makrohämaturie bei IgAN-Patienten beiträgt, nämlich, dass hochregulierte CX3CR1-positive zytotoxische Effektor-Lymphozyten zur Liste der Immunphänomene bei IgAN-Patienten hinzugefügt werden können.
Prognose und Klassifikation
Patienten mit gesicherter IgA-Nephropathie sollten auf sekundäre Ursachen, wie chronische Lebererkrankungen, untersucht werden. Die KDIGO-Leitlinien schlagen vor, das Progressionsrisiko durch Evaluierung der Proteinurie, des Blutdrucks und der eGFR (errechnete glomeruläre Filtrationsrate) zum Diagnosezeitpunkt und während der Folgeuntersuchungen zu ermitteln. Es existiert dazu jedoch keinerlei Evidenz. Im Jahre 2009 wurde eine neue pathologische IgAN-Klassifikation (Oxford-Klassifikation) vorgestellt9, 10. Basierend auf der klinisch-pathologischen Analyse wurden die in Tabelle 1 dargestellten Parameter als prognostisch wertvoll identifiziert. Auch für die Entscheidung für oder gegen eine immunsuppressive Therapie könnte die Oxford-Klassifikation in Zukunft hilfreich sein11.
Therapie
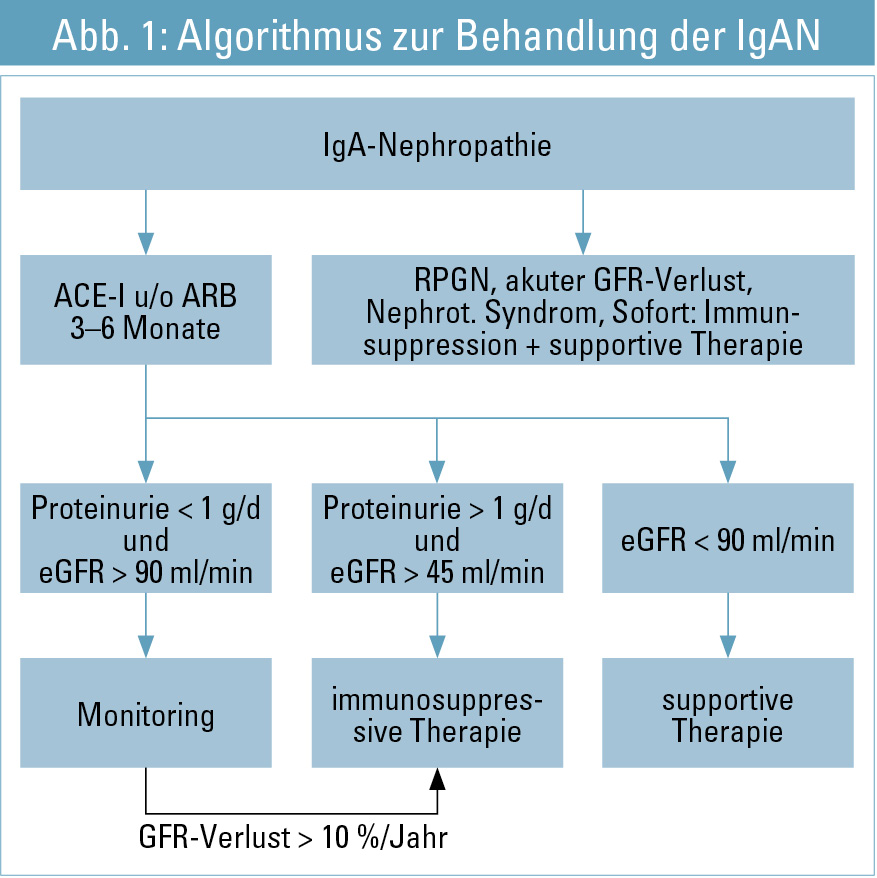
Trotz wachsender Erkenntnisse über die Pathogenese der IgAN existiert nach wie vor keine Möglichkeit, die Produktion der pathogenen IgA-Immunkomplexe bzw. die mesangialen Ablagerungen zu beeinflussen. Therapieoptionen konzentrieren sich auf die Modulation von immunologischen und inflammatorischen Prozessen, „downstream“ im Glomerulum und im tubulointerstitiellen Raum. Der aktuelle Therapiealgorithmus ist in Abbildung 1 dargestellt.
Supportive Therapie
Neben der optimalen Blutdruckeinstellung ist der Wert der antiproteinurischen Therapie mit ACE-Inhibitoren (ACEI) oder AT1-Rezeptorantagonisten (ARB) bei IgAN-Patienten unumstritten (Zielblutdruck bei Proteinurie < 1 g/d: 1 g/d: < 125/75 mmHg). Den vielleicht stärksten Hinweis auf den renoprotektiven Effekt der ACEI liefert die Studie von Praga et al.12, die Enalapril mit anderen Antihypertensiva verglich. Obwohl in beiden Gruppen identische Blutdruckwerte erreicht werden konnten, verringerte sich bei Patienten unter ACEI-Therapie über einen Beobachtungszeitraum von über 6 Jahren die GFR um 7 % verglichen mit 35 % in der Kontrollgruppe.
Laut den aktuellen KDIGO-Leitlinien für Glomerulonephritiden 2012 wird eine Langzeittherapie mit ACEI oder ARB bei einer Proteinurie > 1 g/24 h empfohlen (Evidenzgrad 1B). Dabei sollte die jeweilige Monotherapie ausdosiert werden, um eine Proteinurie < 1 g/24 h zu erreichen (Evidenzgrad 2C). Obwohl die duale Blockade mit einem ACEI und ARB die Proteinurie bei IgAN reduzierte, konnten keine positiven Langzeiteffekte auf das renale Überleben gezeigt werden und die Sicherheit war fraglich13. Der direkte Renininhibitor Aliskiren wurde kürzlich in einer Pilotstudie in Kombination mit einem ARB angewendet, was zu einer zusätzlichen Reduktion der durchschnittlichen Eiweißausscheidung um 26,3 % über einen Beobachtungszeitraum von 12 Monaten führte. Allerdings entwickelten 6 von 25 Patienten eine transiente Hyperkaliämie. Langzeitstudien mit einem längeren Follow-up werden benötigt14.
In der Praxis bzw. in der STOP-IgAN-Studie15 bewährte sich ein multifaktorieller Ansatz der supportiven Therapie (Tab. 2).
Patienten, bei denen trotz Therapie mit ACEI/ARB in Maximaldosis und supportiver Therapie die Proteinurie innerhalb von 6 Monaten nicht unter 0,5–1 g/24 h gesenkt werden konnte, hatten das höchste Risiko für einen progredienten Nierenfunktionsverlust16. Bei dieser Patientengruppe stellt sich die Frage nach der Sinnhaftigkeit einer immunsuppressiven Therapie.
Immunsuppressive Therapie
Kortikosteroide: In den aktuellen KDIGO-Leitlinien wird bei Patienten mit einer persistierenden Proteinurie von > 1 g/24 h trotz 3- bis 6-monatiger optimierter supportiver Therapie (ACEI/ARB und Blutdruckkontrollen) und einer GFR > 50 ml/min eine Kortikosteroidtherapie für 6 Monate vorgeschlagen (Evidenzgrad 2B). Dieser Empfehlung liegen neben der Studie von Pozzi et al.17, 18 auch ähnlich konzeptionierte Studien aus Italien bzw. China zugrunde19. Übereinstimmend konnte eine Überlegenheit der Steroid/ACEI-Kombinationstherapie bei IgAN-Patienten mit einer mittleren Proteinurie zwischen 1 und 1,5 g/Tag und einer GFR > 50 ml/min19 bzw. > 30 ml/min20 gezeigt werden. Die entsprechenden Dosierungsschemata sind in Tabelle 3 dargestellt.
Das Problem der beiden Studien liegt darin, dass eine ACEI- oder eine ARB-Therapie vor Studienbeginn zumindest für 4 Wochen pausiert wurde. Somit ist nicht klar, ob nicht eine Reihe von Patienten eingeschlossen wurde, deren Proteinurien bereits unter RAAS-Blockade alleine kontrollierbar waren. Eine rezente Metaanalyse zur Steroidtherapie, welche die letztgenannten zwei Studien inkludierte, ergab eine Assoziation der Steroidtherapie mit einer Abnahme der Proteinurie. Das Risiko für die Entwicklung einer ESRD („end stage renal disease“) konnte signifikant reduziert werden21. Die Autoren meinen, dass eine Steroidtherapie in Kombination mit einer RAAS-Blockade, bei fehlendem Therapieerfolg der supportiven Therapie und einer eGFR > 50 ml/min, in den meisten Fällen empfohlen werden kann. Auch Patienten, bei denen die eGFR unter supportiver Therapie abfällt, sollten immunsuppressiv behandelt werden.
Andere Immunsuppressiva: Die Behandlung der IgAN mit Kortikosteroiden in Kombination mit anderen immunsuppressiven Agenzien bleibt nach wie vor kontroversiell. Denn die Evidenz dafür stammt hauptsächlich von kleinen Studien. Zudem unterschieden sich viele dieser Studien hinsichtlich der Blutdruckzielwerte und des Einsatzes von ACEI sehr.
Azathioprin, Zyklophosphamid: Eine italienische randomisierte, kontrollierte Studie mit einem medianen Follow-up von 4,9 Jahren konnte zeigen, dass eine Kombination von Kortikosteroiden mit Azathioprin die Nebenwirkungen wie Zytopenien, Hepatotoxizität und gastrointestinale Symptome erhöht, jedoch keineswegs wirksamer ist, als eine 6-monatige Hochdosis-Kortikosteroidmonotherapie22.
Die KDIGO-Guidelines sehen bei Patienten mit IgAN keine immunsuppressive Therapie mit Kortikosteroiden und Zyklophosphamid oder Azathioprin vor, sofern kein rapid progressiver Verlauf mit glomerulären Nekrosen oder extrakapillären Proliferaten vorliegt (Evidenzgrad 2D).
Der Einsatz von Kortikosteroiden und Zyklophosphamid wird bei Patienten mit rapid progressiver IgAN mit glomerulären Halbmonden analog zur Therapie der ANCA-assoziierten Vaskulitis vorgeschlagen (Evidenzgrad 2D).
Mykophenolat-Mofetil (MMF): Die Evidenz für den Einsatz von MMF ist ebenso unklar. Eine Metaanalyse zum Einsatz von MMF bei IgAN zeigte keinen signifikanten Benefit betreffend einer Reduktion der Proteinurie23.
Laut KDIGO wird der Einsatz von MMF bei IgAN nicht empfohlen (Evidenzgrad 2C).
In 2 Studien mit kaukasischen Patienten mit Hochrisiko-IgAN konnte keinerlei Hinweis auf eine Wirksamkeit von MMF nachgewiesen werden24. Eine Gruppe aus Peking berichtet zudem darüber, dass 6 von 32 MMF-behandelte IgAN-Patienten eine beatmungspflichtige Pneumonie entwickelten und 4 Patienten im Alter zwischen 27 und 47 Jahren verstarben25. Bei 3 der Patienten konnte Pneumocystis carinii als Erreger gesichert werden. In allen Fällen entwickelte sich die Pneumonie etwa 3 Monate nach Beginn der Therapie und alle wiesen eine GFR < 30 ml/min auf.
Diese Arbeiten weisen eindrücklich darauf hin, dass vor dem Einsatz potent immunsuppressiver Substanzen bei IgAN eine gründliche Nutzen-Risiko-Analyse erfolgen muss. Wenn tatsächlich, trotz schwacher Datenlage, MMF zum Einsatz kommen sollte, scheint zumindest eine Pneumocystis-Prophylaxe zwingend.
Antithrombozytäre Präparate: Laut KDIGO-Leitlinien werden antithrombozytäre Präparate nicht zur Behandlung der IgAN vorgeschlagen (Evidenzgrad 2C). Asiatische Zentren verschreiben zum Teil antithrombozytäre Präparate wie Dipyridamol zur IgAN-Therapie. Die Datenlage bezieht sich aber auf wenige, meist nicht randomisierte Studien mit kleinen Patientenzahlen und insgesamt niedrigem Evidenzgrad26.
Fischöl: Laut KDIGO-Leitlinien wird Fischöl zur Therapie der IgAN vorgeschlagen, wenn die Proteinurie trotz 3–6-monatiger optimaler supportiver Therapie über 1 g/24 h persistiert (Evidenzgrad 2D).
Eine Metaanalyse aus dem Jahr 1997 konnte keine eindeutigen Hinweise in Bezug auf die Wirksamkeit von Fischöl bei der IgAN geben27. In einer im Jahr 2009 publizierten Studie wurden 15 italienische IgAN-Patienten zu einer alleinigen supportiven Therapie (ACEI) oder zusätzlich 3-mal 1 g Fischöl randomisiert28. Nach 6-monatiger Beobachtungszeit war die Proteinurie in der supportiv behandelten Gruppe nahezu unverändert (im Mittel ca. 1,5 g täglich), während sie in der Fischölgruppe um etwa 75 % gesunken war. Die Studie war jedoch nicht verblindet und aufgrund der geringen Fallzahl statistisch nicht aussagekräftig.
Tonsillektomie: Die KDIGO-Leitlinien schlagen eine Tonsillektomie zur Therapie der IgAN nicht vor (Evidenzgrad 2C).
Was tun bei fortgeschrittener CKD?
Die KDIGO-Leitlinien schlagen bei Patienten mit einer GFR < 30 ml/min keine immunsuppressive Therapie vor. Ausnahmen sind rapid progressive Verläufe, da bei hoch floriden Verläufen selbst bei Dialysepflichtigkeit zum Teil noch eine partielle Wiederherstellung der Nierenfunktion erlangt werden kann (Evidenzgrad 2C).
So gut wie in allen Studien wurden IgAN-Patienten mit GFR < 30 ml/min ausgeschlossen.
Eine Weiterführung der antiproteinurischen, antihypertensiven und der supportiven Therapie wird bei Patienten mit GFR < 30 ml/min allerdings vorgeschlagen (Evidenzgrad 2B).
Laufende Studien
Eine Übersicht der laufenden Studien ist den folgenden Internetseiten zu entnehmen: www.iigann.com und www.clinicaltrials.gov.