Adjuvante Therapie des malignen Melanoms
Bemerkenswert ist, dass neue Therapien beim malignen Melanom, die im metastasierten Stadium erfolgreich waren, diesen Erfolg auch in der adjuvanten Situation fortsetzen konnten: Das gilt für Immuncheckpoint-Inhibitoren wie auch für die Kombinationstherapie aus BRAF- und MEK-Inhibitoren. Innerhalb von drei Monaten, zwischen August und Oktober 2018, sind drei neue Therapieoptionen im adjuvanten Setting des malignen Melanoms zugelassen worden.
Dieser Erfolg war nach den Erfahrungen aus negativen Studien in der frühen Geschichte des Melanoms nicht selbstverständlich. So stand uns im adjuvanten Setting lange Zeit nur Interferon-alpha zur Verfügung. Interferon hat heute zwar noch einen gewissen Stellenwert, ist aber durch die deutlich besseren Ergebnisse mit zielgerichteten Therapien und Immuncheckpoint-Inhibitoren in den Hintergrund getreten.
Immuntherapie mit Checkpointinhibitoren
Der erste Ansatz mit einem Immuncheckpoint-Inhibitor war die EORTC-Studie 18071 mit hochdosiertem Ipilimumab (10 mg) bei Melanompatienten im Stadium III. Die Studie konnte zwar das Gesamtüberleben gegenüber Placebo signifikant verbessern und hat in den USA zur Zulassung geführt, sie wurde aber in Europa aufgrund der hohen Rate schwerer Nebenwirkungen und der ebenfalls hohen Abbruchrate nicht nachvollzogen.
CheckMate238: Die erste für die aktuelle Therapie des malignen Melanoms relevante Studie mit Immuncheckpoint-Inhibitoren war die CheckMate238-Studie mit Nivolumab vs. Ipilimumab (3 mg) bei Hochrisikopatienten in den Stadien IIIB/IIIC und IV nach Tumorresektion (Weber J et al., NEJM 2017). Die Therapiedauer betrug ein Jahr. Nivolumab konnte den primären Endpunkt rückfallfreies Überleben signifikant um 34 % (HR = 0,66; p < 0,001) verbessern (medianes Follow-up: 24 Monate). Das Ergebnis wurde unabhängig vom BRAF-Status erzielt und war zwischen den Stadien IIIB und IIIC sowie zwischen den Stadien III und IV vergleichbar. Das Fernmetastasen-freie Überleben von Stadium-III-Patienten war ebenfalls signifikant besser (HR = 0,76).
EORTC-1325/Keynote-054: Ende letzten Jahres wurde eine weitere Immuntherapiestudie vorgestellt, in der Pembrolizumab bei Hochrisikopatienten im Stadium III (IIIA/B/C) nach Tumorresektion gegen Placebo untersucht wurde (Eggermont A et al., NEJM 2018). Bei Auftreten eines Rezidivs konnten Patienten aus dem Placebo-Arm auf Pembrolizumab wechseln. Die Therapiedauer betrug ein Jahr. Pembrolizumab konnte in dieser Studie den primären Endpunkt rückfallfreies Überleben signifikant um 43 % (HR = 0,57; p < 0,0001) verbessern (medianes Follow-up: 1,3 Jahre). Das Fernmetastasen-freie Überleben war ebenfalls signifikant besser (HR = 0,53).
Zielgerichtete Therapie
Die erste Studie zur adjuvanten Therapie mit einem BRAF-Inhibitor war die BRIM-8-Studie mit Vemurafenib bei Melanompatienten in den Stadien II/III, die in zwei Kohorten unterteilt wurden. Die Studie hat den primären Endpunkt rezidivfreies Überleben in Kohorte 2 nicht erreichen können und muss insgesamt negativ bewertet werden. Der Grund liegt möglicherweise in der Patientenselektion oder vor allem darin, dass Vemurafenib zum damaligen Zeitpunkt als Monotherapie verabreicht wurde und nicht – wie heute Standard ist – in Kombination mit einem MEK-Inhibitor.
Combi-AD: Die erste positive Studie zur zielgerichteten Therapie im adjuvanten Setting ist Combi-AD mit Dabrafenib + Trametinib vs. Placebo bei BRAF-mutierten Melanompatienten im Stadium III (IIIA/B/C) nach Tumorresektion (Long G et al., NEJM 2017). Die Therapiedauer betrug ein Jahr. Im Ergebnis konnte das rezidivfreie Überleben mit der Kombinationstherapie um 51 % (HR = 0,49), das Fernmetastasen-freie Überleben um 47 % (HR = 0,53) und das Gesamtüberleben um 43 % (HR = 0,57) signifikant verbessert werden. Die Studie hat unter allen neuen Studien zur adjuvanten Therapie das längste Follow-up (44 Monate) und ist die erste, die eine Verbesserung des Gesamtüberlebens nachweisen konnte. Befürchtungen, dass nach einem initial guten Ansprechen Resistenzen auftreten würden, haben sich in dieser Studie nicht bewahrheitet – es zeigt sich ein früher und später klinischer Benefit mit einer RFS-Rate (rezidivfreies Überleben) von 54 % nach vier Jahren (Long G et al., ESMO 2018).
Zusammenfassung: Generelle Aspekte sind, dass die adjuvante Therapie ab dem Stadium III nach erfolgter Tumorresektion indiziert ist. Die Immuntherapie wurde unabhängig vom BRAF-Status untersucht, während die zielgerichtete Therapie eine BRAF-Mutation voraussetzt. Die Therapiedauer betrug in allen Studien jeweils ein Jahr. Primärer Endpunkt war das rezidivfreie Überleben, das jeweils signifikant verbessert wurde und markant besser ist als in den historischen Studien der Interferon-Ära. Zur aktuellen zielgerichteten Therapie sind erstmals auch Daten zum Gesamtüberleben verfügbar. In den Studien mit Immuntherapie ist das Follow-up zu kurz bzw. war in der Studie mit Pembrolizumab ein Crossover in den Verum-Arm vorgesehen. Was die Vergleichsarme betrifft, hatte nur die CheckMate238-Studie einen aktiven Kontrollarm (Nivolumab vs. Ipilimumab), während Keynote-054 (Pembrolizumab) und Combi-AD (Dabrafenib + Trametinib) gegen Placebo untersucht wurden. Die beiden Immuntherapie-Studien sind aufgrund des unterschiedlichen Patientenkollektivs und der Switch-Option in den Verum-Arm nur schwer miteinander vergleichbar. Im Endeffekt dürfte die Wirkung aber ähnlich gut sein. Head-to-Head-Vergleiche sind jedoch nicht verfügbar. Die Therapien unterscheiden sich im Verabreichungsmodus (zielgerichtete Therapie in Tablettenform, Immuntherapie als Infusion alle zwei oder alle drei Wochen) und im Nebenwirkungsprofil: Die Rate an Grad-III/IV-Toxizitäten ist mit zielgerichteter Therapie höher, allerdings sind die Nebenwirkungen nach Absetzen der Therapie reversibel. Immuntherapie hat insgesamt weniger Nebenwirkungen, allerdings können endokrinologische Nebenwirkungen wie Schilddrüsenunterfunktion oder Diabetes mellitus Typ 1 im Einzelfall lebenslang persistieren. Insgesamt bedarf es einer guten Aufklärung der Patienten, umso mehr, als es sich um eine adjuvante Therapie handelt.
Interessant, aber offen ist die Frage, wie man Patienten nach einem Rezidiv weiterbehandeln soll und wie diese Patienten auf die nachfolgende Therapie ansprechen (PFS2). Es gibt zu diesem Thema unterschiedliche Strategien – Wechsel der Therapie oder Reinduktion in Abhängigkeit von der Dauer des Ansprechens –, aber keine gesicherten Daten, welche Strategie die beste ist. Wird ein Patient unter laufender Therapie progredient, ist ein Wechsel indiziert – von Immuntherapie zu zielgerichteter Therapie und umgekehrt –, oder es kann, wenn z. B. Nivolumab verabreicht wurde, eine Kombination mit Ipilimumab erfolgreich sein. Wir wissen derzeit aber nicht, ob Patienten auf die Rezidivtherapie gleich gut oder schlechter ansprechen.
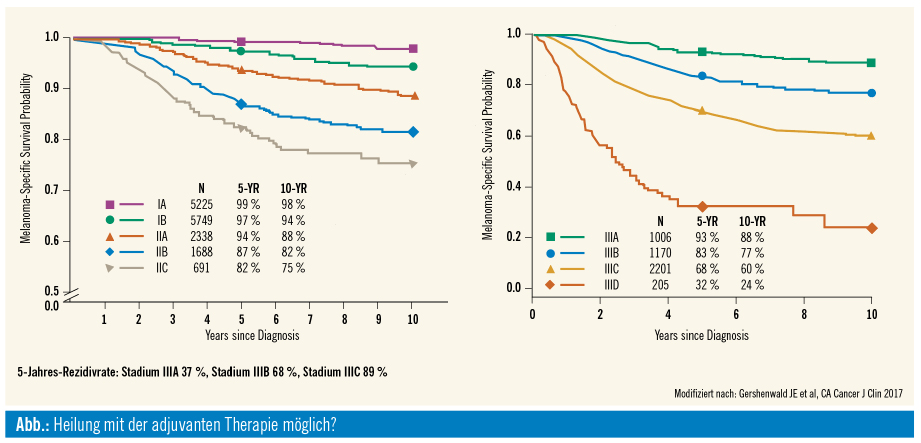
Eine wesentliche Änderung hat sich im Staging von Stadium-III-Patienten ergeben, neu dazugekommen ist ein Stadium IIID. Durch diese neue Aufteilung hat das heutige Stadium IIIA ein geringeres Rezidivrisiko als das Stadium IIIA, wie es in den adjuvanten Studien bisher vertreten war. Auswertungen der Studien Combi-AD und Keynote-054 zeigen aber, dass die Ergebnisse unabhängig vom Staging positiv bleiben. Die Zulassung erlaubt eine Therapie im gesamten Stadium III. Diskutiert wird, ob jeder Patient im Stadium IIIA wirklich eine Therapie benötigt (oder erst ab einer gewissen Metastasendicke in den Lymphknoten). Aus dem neuen Staging-System geht zudem hervor, dass Patienten im Stadium IIC ebenfalls Risikopatienten sind (ähnlich wie Patienten im Stadium IIIB), weshalb eine neue Studie in diesen früheren Tumorstadien bereits geplant ist (Keynote-716, Pembrolizumab, Stadium II). Ein weiterer neuer Trend sind Studien im neoadjuvanten Setting.
Insgesamt lässt sich zusammenfassen, dass die Erfolgsgeschichte mit neuen Substanzen auch in der adjuvanten Therapie des malignen Melanoms fortgesetzt wird. Wenngleich die Number needed to treat gegenüber der Interferon-Ära deutlich geringer ist und wesentlich mehr Patienten von der Therapie profitieren, ist eine Risiko-Nutzen-Abschätzung vor allem bei niedrigeren Tumorstadien wichtig.