Non-Melanoma Skin Cancer
Der nicht-melanozytäre Hautkrebs (non-melanoma skin cancer, NMSC) setzt sich aus unterschiedlichen Tumorerkrankungen zusammen, deren Inzidenz tendenziell ansteigend ist. Dem NMSC sollte deshalb große Aufmerksamkeit gewidmet werden. Früherkennung und rechtzeitige Intervention können die Krankheitsverläufe sehr positiv beeinflussen.
Für umfangreiche Informationen bietet die AWMF (Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V.) nützliche Leitlinien zu Diagnostik, Therapie und Nachsorge.
Basalzellkarzinom
Das Basaliom (Basalzellkarzinom, BCC) (Abb. 1) ist der häufigste maligne Tumor des Menschen in Mitteleuropa. Zu den Hauptursachen der BCC-Entstehung zählt vor allem die UV-Belastung, nach den AWMF-Leitlinien gibt es in Deutschland etwa 200 Neuerkrankungen pro 100.000 Einwohner pro Jahr. Diese Zahl ist höchstwahrscheinlich unterschätzt, zudem gibt es in Österreich eine vergleichsweise stärkere Lichtexposition, vor allem an Seen und in den Bergen. Eine vermehrte Inzidenz von BCCs tritt auch bei bestimmten Syndromen auf, darunter Gorlin-Goltz-Syndrom, Bazex-Dupré-Christol-Syndrom und Rombo-Syndrom – diese genetischen Formen (Genodermatosen) sind selten und erfordern ein angepasstes Therapiemanagement.
Die Ursprungszelle des Basalioms ist nicht sicher charakterisiert, die Ausgangsstruktur wird im primitiven Haarfollikel vermutet. Das BCC wächst vor allem lokal infiltrierend und destruierend, eine Metastasierung erfolgt sehr selten – die AWMF gibt Inzidenzen von 0,0028–0,55 % an, wobei die untere Grenze eher realistisch scheint.
Vielgestalt des Basalioms: Das BCC weist verschiedene Differenzierungsformen auf; die Tumoren haben follikuläre, sebozytäre oder adenoid-drüsige Erscheinungsstrukturen. An die unterschiedlichen makroskopischen und histologischen Erscheinungsformen sollte bei der diagnostischen Abklärung gedacht werden. Makroskopisch gibt es BCCs mit abgegrenzten Knoten, aber auch solche mit unterminierendem Wachstum, bei denen es keine klare Abgrenzung gibt. Beim sklerodermiformen Basaliom sind die Veränderungen sklerosiert und flächig, beim Rumpfhautbasaliom gleicht die Erscheinungsform eher einem Ekzem.
Mikrochirurgisch kontrollierte Chirurgie: Hinsichtlich der therapeutischen Maßnahmen steht die mikrographisch kontrollierte Chirurgie an erster Stelle. Das BCC entsteht tendenziell an lichtexponierten Arealen wie Gesicht oder bei Männern auch der Kopfhaut – um Gewebe-Defekte durch chirurgische Eingriffe so gering wie möglich zu halten, ist es wichtig, den Tumor so früh wie möglich zu erkennen. Die Operationsmethodik ist mit einer sehr geringen Rezidivrate assoziiert, da die Schnittränder histologisch aufgearbeitet und ein operativer Verschluss erst dann erfolgt, wenn im entfernten Gewebe keine Basaliomzellen mehr nachgewiesen werden konnten.
Systemtherapie: Die einzig wirkliche Systemtherapie beim BCC setzt am Hedgehog-Gen an, die Aktivierung des Sonic-Hedgehog-(SHH)-Signalwegs spielt eine zentrale Rolle in der Entstehung des BCC. Durch eine Mutation im Inhibitor Patched (PTCH) des SHH kommt es zu einer unkontrollierten Aktivierung von Smoothened (SMO), was zur Apoptoseresistenz von Keratinozyten führt.
Die BCC-Therapie mit Hedgehog-Inhibitoren (Vismodegib, Sonidegib) ist indiziert, wenn Tumoren nicht operabel sind. Eine weitere Einsatzmöglichkeit gibt es für die Genodermatosen, die PTCH-Mutation ist für das BCC bei bestimmten Syndromen verantwortlich (Gorlin-Goltz-Syndrom, Xeroderma pigmentosum).
Eine häufige Nebenwirkung ist z. B. Appetitlosigkeit und der starke Gewichtsverlust. Was die Nachsorge betrifft, sind im Zusammenhang mit dem Einsatz von Hedgehog-Inhibitoren noch Fragen offen, die weitere Studien erfordern, um beispielsweise zu klären, ob eine anschließende Exzision erfolgen sollte, um das Rezidivrisiko zu minimieren.
Strahlentherapie: Das BCC ist ein strahlensensibler Tumor, bei einer ungünstigen Lokalisation, wie beispielsweise dem Augenlied oder wenn Tränenwege involviert sind, kann eine Bestrahlung bei lokal fortgeschrittenen BCC-Formen erfolgen. Bei den Genodermatosen ist die Strahlentherapie kontraindiziert, da die Belastungen durch ionisierende Strahlung bei diesen Patienten zu vermeiden sind.
Plattenepithelkarzinom
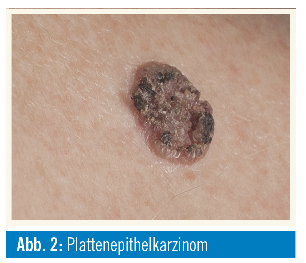
Auch das Plattenepithelkarzinom der Haut (PEK) (Abb. 2) ist in der Inzidenz stark ansteigend, insbesondere gefährdet sind immunsupprimierte Patienten, beispielsweise nach einer Organtransplantation.
Die Früherkennung von möglichen Vorstufen – aktinische Keratosen mit Feldkanzerisierung – ist von größter Wichtigkeit, da bei den PEKs die Möglichkeit einer lymphogenen Metastasierung besteht. Folgende prognostischen Faktoren für die Metastasierung und das krankheitsspezifische Überleben sind nach der aktuellen AWMF-Konsultationsfassung von Bedeutung: vertikale Tumordicke (> 6 mm), horizontale Tumordicke (≥ 2 cm), histologische Differenzierung (> Grad 3), Desmoplasie, perineurales Wachstum, Lokalisation (Unterlippe, Ohr), Immunsuppression (iatrogen oder erkrankungsbedingt).
Die Haupt-Erkrankungsursache ist auch beim PEK die kumulative UV-Exposition, weshalb der Tumor häufig bei älteren Patienten auftritt. Im Rahmen der diagnostischen Abklärung sollte eine makroskopische Beurteilung und Sonographie der drainierenden Lymphwege erfolgen; momentan gibt es keine konkreten diagnostischen Richtlinien (Evidenz) über die Art der bevorzugten Bildgebung. Bei den therapeutischen Maßnahmen steht ebenso wie beim BCC die chirurgische Entfernung des PEK an erster Stelle.
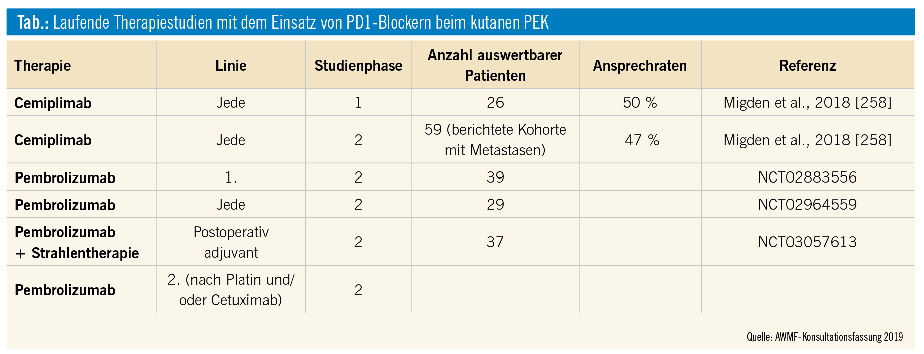
Metastasiertes Stadium: Aus Mangel an kontrollierten oder randomisierten Studien gibt es für das metastasierte PEK keine standardisierte Systemtherapie, eine Behandlung sollte vorzugsweise im Rahmen klinischer Studien erfolgen. In der Konsultationsfassung der AWMF sind die Evidenz-Daten zum Einsatz von Platin-basierter Chemotherapie, Interferon-alpha und 13-cis-Retinsäure sowie zu EGFR-Blockern zusammengefasst. PEKs weisen eine sehr hohe Mutationslast auf, welche bei anderen Tumorentitäten mit einem Ansprechen auf PD1-Inhibitoren assoziiert ist. Studien zu diesem Immuntherapie-Behandlungsansatz beim PEK laufen derzeit (Tab.).
Nachsorge: Die AWMF gibt hinsichtlich der Intervalle die Empfehlung einer risikoadaptierten Nachsorge nach Tumorstadien. Bei immunsupprimierten Patienten und bei histologisch entdifferenzierten PEK-Varianten sollte sehr engmaschig kontrolliert werden; bei gut differenzierten PEKs ist die Metastasierungsgefahr hingegen geringer.