Aktuelle Behandlungsstrategien bei Patienten mit multiplem Myelom
Indikation für die Therapieeinleitung
 Liegen myelombedingte Symptome bzw. eines oder mehrere der so genannten CRAB-Kriterien (Hyperkalzämie, myelombedingte Nierenfunktionseinschränkung, Anämie oder Knochenläsionen) vor, so sollte eine Myelomtherapie ein – geleitet werden. Die bisher mit konventionellen Substanzen durchgeführten Studien haben keinen Vorteil für einen frühzeitigen Therapiebeginn bei asymptomatischen Patienten aufgezeigt; eine derzeit mit Lenalidomid+Dexamethason laufende Studie weist allerdings auf subs tanzielle Vorteile eines frühzeitigen Therapiebeginns bei selektionierten Patienten mit Smouldering-Myelom mit einem hohen Risiko zur Transformation in ein aktives Myelom auf.
Liegen myelombedingte Symptome bzw. eines oder mehrere der so genannten CRAB-Kriterien (Hyperkalzämie, myelombedingte Nierenfunktionseinschränkung, Anämie oder Knochenläsionen) vor, so sollte eine Myelomtherapie ein – geleitet werden. Die bisher mit konventionellen Substanzen durchgeführten Studien haben keinen Vorteil für einen frühzeitigen Therapiebeginn bei asymptomatischen Patienten aufgezeigt; eine derzeit mit Lenalidomid+Dexamethason laufende Studie weist allerdings auf subs tanzielle Vorteile eines frühzeitigen Therapiebeginns bei selektionierten Patienten mit Smouldering-Myelom mit einem hohen Risiko zur Transformation in ein aktives Myelom auf.
Wahl der Erstlinienbehandlung
Prinzipiell soll bei jüngeren Patienten (≤ 65 Jahre) nach einer kurzen Induktionstherapie eine autologe Stammzelltransplantation angestrebt werden, während bei allen anderen Patienten eine konventionelle Chemotherapie eingeleitet werden soll.
Induktionsbehandlung vor Stammzelltransplantation
Entsprechend einem allgemeinen Konsens sollte heute für die Induktionstherapie vor autologer Stammzelltransplantation ein aus 3 Substanzen bestehendes Therapieregime eingesetzt werden; die Zugabe einer vierten Substanz führt zu keiner Verbesserung der Therapieergebnisse, aber zu erhöhter Toxizität. Insgesamt sollten 3 bis 4 Zyklen der gewählten Induktionstherapie vor der Stammzelltransplantation verabreicht werden; der Nutzen einer Erhöhung der Zahl der Zyklen ist nicht belegt. Anschließend erfolgt die Stammzelltransplantation mit Melphalan 200 mg/m2. Damit kann ein progressionsfreies Überleben von im Median 20–30 Monaten und ein medianes Gesamtüberleben von 6–8 Jahren erreicht werden. Gängige Therapieprotokolle, die in der Erstlinientherapie untersucht wurden, sind in Tab. 1 angeführt.
Konventionelle Chemotherapie
Bei Patienten, die für eine Stammzelltransplantation nicht in Frage kommen, empfiehlt sich die Einleitung einer Chemotherapie, die zumindest eine der neuen Substanzen (Thalidomid, Bortezomib, Lenalidomid) beinhalten sollte. Tab. 2 zeigt eine Auflistung der gängigen Therapieprotokolle.
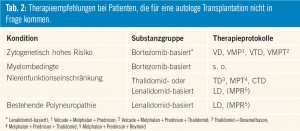 Die Wahl des Therapieprotokolls hängt von zytogenetischen Risikofaktoren, patientenspezifischen Charakteristika sowie der Verfügbarkeit der Medikamente aufgrund des Zulassungsstatus und der Finanzierbarkeit ab. Bei Patienten mit hohem zytogenetischen Risiko (t[4; 14], del 17p, ampl. 1q oder del 1p21, Hypodiploidie) sollten Bortezomib-basierte Kombinationen bevorzugt zum Einsatz kommen. Findet sich eine präexistente Neuropathie, so sollte aufgrund der fehlenden Neurotoxizität von Lenalidomid diese Substanz ohne Bortezomib und Thalidomid zum Einsatz kommen. Für ältere, gebrechliche und insbesondere für geriatrische Patienten liegen keine studienbasierten Daten vor. Hier empfiehlt sich nach sorgfältigem Assessment eine auf die Gesamtsituation des Patienten angepasste Therapie- und Dosiswahl. Die Ansprechraten auf gängige Therapieprotokolle sind in Tab. 3 angeführt.
Die Wahl des Therapieprotokolls hängt von zytogenetischen Risikofaktoren, patientenspezifischen Charakteristika sowie der Verfügbarkeit der Medikamente aufgrund des Zulassungsstatus und der Finanzierbarkeit ab. Bei Patienten mit hohem zytogenetischen Risiko (t[4; 14], del 17p, ampl. 1q oder del 1p21, Hypodiploidie) sollten Bortezomib-basierte Kombinationen bevorzugt zum Einsatz kommen. Findet sich eine präexistente Neuropathie, so sollte aufgrund der fehlenden Neurotoxizität von Lenalidomid diese Substanz ohne Bortezomib und Thalidomid zum Einsatz kommen. Für ältere, gebrechliche und insbesondere für geriatrische Patienten liegen keine studienbasierten Daten vor. Hier empfiehlt sich nach sorgfältigem Assessment eine auf die Gesamtsituation des Patienten angepasste Therapie- und Dosiswahl. Die Ansprechraten auf gängige Therapieprotokolle sind in Tab. 3 angeführt.
Konsolidierung und Erhaltungstherapie
Gegenwärtig wird versucht, mittels Konsolidierungstherapie nach absolvierter Erstlinienbehandlung sowohl die Qualität des Ansprechens als auch das progressionsfreie und das Gesamtüberleben zu verbessern. Neuere Untersuchungen zeigen einen Anstieg der Rate molekularer Remission mit einer VDT+Konsoli – dierungstherapie (Velcade+Dexamethason+ Thalidomid; 4 Zyklen) nach autologer Transplantation von 3 % auf 18 %. In Analogie zu Ergebnissen anderer Studien, die eine besonders lange progressionsfreie Überlebenszeit bei Patienten mit immunophänotypischer Remission gezeigt haben, wird bei Patienten mit molekularer Remission (mittels PCR definiert) eine besonders lange Überlebenszeit erwartet.
Frühere Versuche, mit einer Remissions – erhaltungstherapie die Überlebenszeit zu verlängern, haben keine überzeugenden Ergebnisse erbracht. Zwar lässt sich mit einer Interferon-Erhaltungsbehandlung das PFS um etwa 6 und das Gesamtüberleben um 4–6 Monate verlängern, die Therapie hat aber wegen der Interferonbedingten Nebenwirkungen keine breite Akzeptanz gefunden. Re zente Daten mit Lenalidomid-Erhaltungsbehandlung nach autologer Stamm zelltransplantation oder nach konventioneller Induktionsbehandlung (MPR: Melphalan+Prednison+Lenalidomid) haben im Vergleich mit der unbehandelten Kontrollgruppe zu einer Verdoppelung des progressionsfreien Überlebens geführt. In einer der beiden bisher nach autologer Transplantation durchgeführten Studien wurde auch eine Verlängerung des Gesamtüberlebens beobachtet. Thalidomid wurde sowohl nach autologer Transplantation als auch nach konventioneller Chemotherapie zur Remissionserhaltungsbehandlung herangezogen. In beiden Indikationen wurde eine Verlängerung des PFS erzielt, eine Verbesserung des Gesamtüberlebens wurde nur bei 3 von 6 Studien nach autologer Transplantation beobachtet.
Derzeit kann weder die Konsolidierungsbehandlung noch die Erhaltungstherapie als klinischer Standard betrachtet werden. Wird eine solche Strategie bei einzelnen Patienten überlegt, so sollten Vor- und Nachteile sorgfältig dargelegt werden, um den Patienten eine gut fundierte Entscheidung zu ermöglichen.
Rezidivtherapie
Nach erfolgreicher Erstlinientherapie kommt es bei einem Großteil der Patienten nach einer unterschiedlich langen Remissionsdauer zu einer neuerlichen Krankheitsprogression, wobei die mediane progressionsfreie Überlebenszeit nach autologer Transplantation bei etwa 2–3 Jahren und nach konventioneller Therapie bei 12–18 Monaten liegt. Die Selektion der optimalen Behandlung wird von verschiedenen Faktoren, wie Erfolg der Erstlinienbehandlung, Qualität und Dauer des Ansprechens, Toleranz, sowie von patientenspezifischen Faktoren wie Alter, Polymorbidität, Knochenmarkreserve und Patientenpräferenz abhängig gemacht. Prinzipiell kann bei erfolgreicher Erstlinientherapie und langem therapiefreien Intervall (> 6 Monate) das initial verwendete Regime wieder herangezogen werden; in diesem Fall ist jedoch mit einer geringeren Ansprechqualität und kürzeren Ansprechdauer als bei der Ersttherapie zu rechnen. Weiters kann bei jüngeren Patienten eine neuerliche Stammzelltransplantation überlegt werden. Bei der Mehrzahl der Patienten wird aber ein Wechsel auf ein neues Therapieregime vorgezogen werden. Hier wird man präferenziell auf eine neue, zuvor nicht eingesetzte Substanzkombination zugreifen.
Neue Therapieentwicklungen
Derzeit stehen zahlreiche neue Substanzen für die Therapie des multiplen Myeloms in klinischer Erprobung. Zu den in der Entwicklung weit fortgeschrittenen Medikamenten zählen der Proteasomen – inhibitor Carfilzomib sowie Pomalidomid als neue immunmodulierende Subs tanz. Mit beiden Substanzen können in Kombination mit Dexamethason bei nicht vorbehandelten Patienten Remissionsraten von mehr als 90 % ereicht werden. Zu den weiteren attraktiven neuen Subs – tanzen zählen unter anderem His ton- Deacetylase-Inhibitoren (Vorinostat, Panobinostat, Romidepsin), Tyrosinkinase- Inhibitoren (Masitinib), monoklonale Antikörper (Elotuzumab) und Inhibitoren von Adhäsionsmolekülen, die zur Abnabelung von Myelomzellen von der für ihr Überleben wichtigen Bindung ans Stroma und damit zur spontanen Apoptose oder zumindest verstärkten Chemosensitivität der Myelomzellen führen.
Für die nähere Zukunft sind wesentliche Fortschritte in der Behandlung des multiplen Myeloms zu erwarten.
Fazit für die Praxis
Durch die Einführung der neuen Substanzen Thalidomid, Bortezomib und Lenalidomid in die Therapie des multiplen Myeloms können sowohl in der Erstlinientherapie als auch bei Patienten mit Rezidiv höhere Ansprechraten sowie eine Verlängerung der progressionsfreien und der Gesamtüberlebenszeit erzielt werden. Patienten- und myelomspezifische Parameter, wie zytogenetische Faktoren, werden zunehmend für die Therapiewahl herangezogen; für die Zukunft ist eine zunehmende Individualisierung der Behandlung zu erwarten.
























































































