ASCO-GI 2012 Late-breaking Abstracts
GRANITE-1: fortgeschrittenes Magenkarzinom
Patienten mit fortgeschrittenem Magenkarzinom haben nach Versagen der Erstlinien-Chemotherapie eine eher ungünstige Prognose. Die verfügbaren Therapieoptionen bewirken nur geringe Benefits und gehen mit beträchtlichen Toxizitäten einher. Da der PI3K/Akt/mTOR-Pathway bei einem Gutteil der Magenkarzinome aktiviert ist, befindet sich der mTORInhibitor Everolimus in dieser Indikation in Testung. Positive Resultate von präklinischen Untersuchungen sowie Phase-I/II-Studien lieferten die Basis für die Evaluierung von Everolimus als Monotherapie in der randomisierten, doppelblinden Phase-III-Studie GRANITE-1, für die 656 Patienten aus 23 Ländern weltweit rekrutiert wurden. Die Teilnehmer, die nach einer oder zwei Chemotherapie-Linien eine Krankheitsprogression erfahren hatten, erhielten randomisiert entweder Everolimus 10 mg/d plus Best Supportive Care (BSC; n = 439) oder Placebo plus BSC (n = 217).
Kein OS-Benefit, aber PFS-Verlängerung: Hinsichtlich des als primärer Endpunkt definierten Gesamtüberlebens (OS) konnte keine signifikante Verbesserung durch die zielgerichtete Therapie festgestellt werden (median 5,39 vs. 4,34 Monate; p = 0,1244). Für das progressionsfreie Überleben (PFS) laut Untersucher resultierte dagegen ein signifikanter Vorteil (1,68 vs. 1,41 Monate; HR 0,66; p < 0,0001). Zu den häufigsten Grad-3/4-Nebenwirkungen zählten Anämie (16 % im Everolimus-Arm vs. 12,6 %), reduzierter Appetit (11,0 % vs. 5,6 %) und Müdigkeit (7,8 % vs. 5,1 %). Insgesamt standen die dokumentierten unerwünschten Effekte in Übereinstimmung mit dem bekannten Sicherheitsprofil.
CORRECT: Salvage-Therapie beim Kolorektalkarzinom
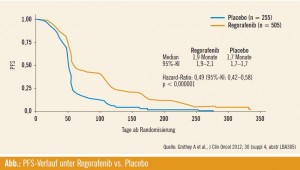
Regorafenib (BAY 73-4506) ist ein oraler Multikinaseinhibitor, der an einem breiten Spektrum aus angiogenen, onkogenen und stromalen Kinasen ansetzt. Die randomisierte, doppelblinde, in 16 Ländern durchgeführte Phase-III-Studie CORRECT evaluierte die Wirksamkeit und Sicherheit der Substanz bei Patienten mit metastasiertem kolorektalem Karzinom (mCRC), die unter den etablierten Behandlungsstrategien progredient geworden waren. Eine Progression musste den Einschlusskriterien zufolge unter der letzten Therapie oder maximal drei Monate später eingetreten sein. 505 Patienten wurden mit Regorafenib (160 mg/d über drei Wochen gefolgt von einer einwöchigen Pause) randomisiert plus BSC behandelt, 255 mit Placebo plus BSC.
Vorzeitiger Studienstopp: Bereits eine planmäßige Interimsanalyse erbrachte einen Vorteil für den Prüfarm im Hinblick auf den primären Endpunkt (OS). Durch die Anwendung von Regorafenib konnte das Mortalitätsrisiko signifikant um 23 % reduziert werden (medianes OS 6,4 vs. 5,0 Monate; p = 0,0052). Für das Progressionsrisiko fand sich eine hochsignifikante Reduktion um 51 % (p < 0,000001), wobei der mediane Unterschied (PFS 1,9 vs. 1,7 Monate) die Effektivität nicht wirklich wiedergibt: Nach einem anfänglich ähnlichen Verlauf weichen die Kurven weit auseinander (Abb.). Die Krankheitskontrollrate betrug 44,8 % vs. 15,3 % (p < 0,000001).
Als Multikinasehemmer war Regorafenib mit Nebenwirkungen wie Hand-Fuß-Syndrom, Müdigkeit, Diarrhö und Hypertonie assoziiert. Da die präspezifizierte OS-Wirksamkeitsgrenze bei der Zwischenanalyse überschritten war, empfahl das Datenüberwachungskomitee die Entblindung der Studie. Den Patienten im Kontrollarm wurde somit der Switch zur aktiven Therapie ermöglicht.
SPACE: Wirksamkeitssteigerung von TACE
Die globale Phase-II-Studie SPACE prüfte die Sicherheit und Wirksamkeit von Sorafenib zusätzlich zu transarterieller Chemoembolisation (TACE) mit DEBDOX (Doxorubicin-eluting beads) bei hepatozellulärem Karzinom (HCC) im intermediären Stadium (BCLC B). 307 Patienten mit asymptomatischen, nicht resezierbaren, multinodulären Tumoren ohne Gefäßinvasion und ohne extrahepatischen Befall erhielten randomisiert und doppelblind entweder Sorafenib 400 mg zweimal täglich oder Placebo. Bei allen Teilnehmern wurde eine TACE mit DEBDOX (Doxorubicin 150 mg) 3 bis 7 Tage nach der ersten Gabe der Studienmedikation sowie am Tag 1 der Zyklen 3, 7 und 13 und in der Folge alle sechs Zyklen durchgeführt. Als primärer Endpunkt war die Zeit bis zur Progression (TTP) laut unabhängigem Review definiert.
Im Vergleich zu TACE mit DEBDOX alleine konnte durch die Zugabe von Sorafenib eine Verlängerung der medianen TTP mit einer Risikoreduktion um 21 % erreicht werden (169 vs. 166 Tage; p = 0,072). Dieses positive Signal wurde durch die Verlängerung der Zeit bis zur vaskulären Invasion/extrahepatischen Ausbreitung zugunsten des Prüfarms bekräftigt (HR 0,621; p = 0,076). Die Kombination erwies sich als gut verträglich, unerwartete Sicherheitssignale wurden nicht registriert. Nun müssen die vielversprechenden Ergebnisse dieser hypothesengenerierenden Studie anhand der derzeit im Laufen befindlichen Phase-III-Studien zur Kombination von Sorafenib und TACE bestätigt werden.
1 Van Cutsem E et al., Phase III trial of everolimus in previously treated patients with advanced gastric cancer: GRANITE-1. J Clin Oncol 2012; 30 (suppl 4; abstr LBA3)
2 Grothey A et al., Results of a phase III randomized, double-blind, placebocontrolled, multicenter trial (CORRECT) of regorafenib plus best supportive care versus placebo plus BSC in patients with metastatic colorectal cancer who have progressed after standard therapies. J Clin Oncol 2012; 30 (suppl 4; abstr LBA385)
3 Lencioni R et al., Sorafenib or placebo in combination with transarterial chemoembolization (TACE) with doxorubicin-eluting beads (DEBDOX) for intermediate-stage hepatocellular carcinoma: Phase II, randomized, double-blind SPACE trial. J Clin Oncol 2012; 30 (suppl 4; abstr LBA154)