Neue Daten zur Behandlung von Non-Hodgkin-Lymphomen
Wie jedes Jahr waren auch beim diesjährigen ASH die Sitzungen mit klinischen Ergebnissen zur Therapie der Non- Hodgkin-Lymphome besonders gut besucht. Wenn es auch keine Studien gab, die unmittelbar den Behandlungsstandard verändern, so ergeben sich doch bei allen Lymphom-Entitäten neue Entwicklungen.
Follikuläres B-Zell-Lymphom
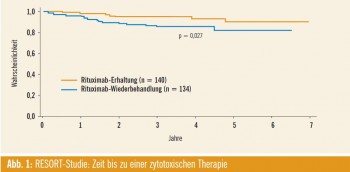
In der Sitzung „Late-breaking Abstracts“ wurde erstmals die sog. RESORT-Studie präsentiert. Dabei erhielten bislang unbehandelte Patienten mit follikulärem BZell- Lymphom (n = 384) und einer niedrigen Tumorlast nach GELF-Kriterien (Groupe d’Etude des Lymphomes Folliculaires) zunächst einen Zyklus Rituximab (R; 4 Applikationen in Standarddosis, eine Gabe pro Woche). Patienten, die nach dieser Induktion zumindest eine partielle Remission erreichten (n = 274), wurden anschließend zwischen R-Erhaltung (eine Gabe alle 3 Monate; n = 140) und RWiederbehandlung im Rezidiv (n = 134) randomisiert. Die Zeit bis zur Verabreichung einer zytotoxischen Therapie war im Behandlungsarm mit Rituximab-Erhaltungstherapie etwas länger (Abb. 1); demgegenüber stehen die Kosten von dreimal mehr Verabreichungen von Rituximab. 1
Mantelzell-Lymphom: EMN „Elderly“ Study
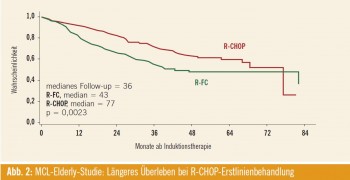
In diese multizentrische Studie des European Mantle Cell Lymphoma Network (EMN) wurden 560 Patienten mit neu diagnostiziertem Mantelzell-Lymphom im Stadium II–IV und einem Alter > 60 Jahre eingeschlossen. Die Patienten wurden zunächst zwischen R-CHOP (8 Zyklen zu je 3 Wochen) und R-FC (6 Zyklen zu je 4 Wochen) randomisiert. Patienten mit zumindest einer partiellen Remission auf die Induktionstherapie wurden ein zweites Mal randomisiert (n = 316): Interferon alpha versus Rituximab (alle 2 Monate bis zur Progression).
Ergebnisse: Das mediane Alter der Patienten lag bei 70 Jahren, und mehr als 90 % hatten ein intermediäres oder hohes Risiko anhand des MIPI (Mantle cell lymphoma International Prognostic Index). Patienten, die in den R-CHOP-Studienarm eingeschlossen wurden, hatten ein signifikant längeres Gesamtüberleben (Abb. 2). Dies war insbesondere auf die höhere Gesamtansprechrate (87 % bei R-CHOP vs. 78 % bei R-FC; p = 0,0508) sowie die geringere Rate an primär progredienter Erkrankung (5 % bei R-CHOP vs. 14 % bei R-FC) zurückzuführen.
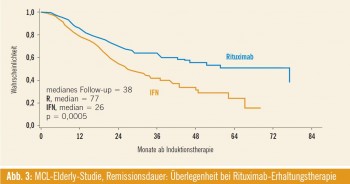
Abbildung 3 zeigt die mediane Remissionsdauer ab der zweiten Randomisierung (nach Induktionstherapie), die bei Rituximab- Erhaltung 77 Monate betrug, bei Interferon alpha hingegen nur 26 Monate (p = 0,0005). Dieser remissionsverlängernde Effekt von Rituximab war bei R-CHOP-Vorbehandlung, nicht jedoch im R-FC-Studienarm zu beobachten.
Hinsichtlich des Gesamtüberlebens zeigt sich bislang ein deutlicher Trend zugunsten der Patienten im Behandlungsarm mit Rituximab, wenn auch derzeit noch nicht mit statistischer Signifikanz (4-Jahres- Überleben von 77 % bei Rituximab versus 62 % bei Interferon; p = 0,17). Die besten Daten hinsichtlich der Überlebenszeit fanden sich bei Patienten mit RCHOP- Induktionstherapie gefolgt von Rituximab- Erhaltung: Dabei wurde das mediane Überleben noch nicht erreicht, die projizierte Überlebensrate nach 72 Monaten lag bei ca. 80 %. R-CHOP gefolgt von Interferon-Erhaltung ergab eine mediane Überlebenszeit von 58 Monaten.
Toxizitätsdaten weisen auf eine bessere Verträglichkeit von Rituximab gegenüber Interferon alpha hin (weniger Hämatotoxizität, geringere Rate an ZNS-Nebenwirkungen sowie deutlich weniger Fatigue- Symptomatik). Auch bei der Rate an Therapieabbrüchen, die nicht durch ein Lymphomrezidiv bedingt war, zeigte sich Interferon dem Rituximab signifikant unterlegen (80 % vs. 34 %; p < 0,001).
Schlussfolgerung: Aufgrund dieser Daten, die einen Vorteil für die R-CHOP-Induktionstherapie sowie eine Verdoppelung der Remissionsdauer bei Patienten mit Ansprechen auf die Induktionstherapie zeigen, wird von dieser Studiengruppe die Therapie mit R-CHOP, gefolgt von Rituximab-Erhaltungstherapie, als neuer Standard bei älteren Patienten mit Mantelzell- Lymphom angesehen.2
Diffus großzelliges B-Zell-Lymphom (DLBCL)
Für die Therapie des DLBCL gilt R-CHOP weiterhin als Standard in der Primärbehandlung. Eine klinische Herausforderung sind Patientenpopulationen mit Risikofaktoren, wobei sich einige Studien mit dieser Thematik befassen.
SMARTE-R-CHOP-14 Trial: Basierend auf pharmakokinetischen Daten (prolongierte Rituximab-Serumspiegel bei längerem Intervall der Rituximab-Applikation) wurde von der deutschen Lymphom-Studiengruppe der SMARTE-R-CHOP-14- Trial entworfen: 6 Zyklen CHOP-14 mit 8 Gaben von Rituximab an den Tagen –4, –1, 14, 28, 56, 99, 155, 239 (eingeschlossen wurden Patienten mit DLBCL im Alter zwischen 60 und 80 Jahren). Die Ergebnisse dieser Phase-II-Studie wurden mit dem Outcome des Studienarms mit R-CHOP-14 aus der RICOVER- 60-Studie (6-mal CHOP-14 mit 8 Gaben von Rituximab alle 14 Tage) verglichen. Durch die Behandlung mit SMARTE-RCHOP- 14 konnte für die Subgruppe der Patienten mit IPI > 2 eine Verbesserung des ereignisfreien Überlebens (67 % vs. 54 % bei 36 Monaten; p = 0,030) sowie des Gesamtüberlebens (80 % vs. 67 % bei 36 Monaten; p = 0,034) gezeigt werden.3 Idente Überlebensdaten fanden sich mit beiden Behandlungsregimen für Patienten mit IPI 1 und 2. Eine prospektive, randomisierte Studie (OPTIMAL > 60) wird nun zur Validierung dieser Beobachtungen durchgeführt.
Dosisadaptiertes (DA)-EPOCH: 68 Patienten mit DLBCL und altersadap – tiertem IPI > 1. Die Behandlung mit DA-EPOCH führte zu einer Gesamt – ansprechrate von 89 % und einer CR/Cru-Rate von 80 % (unabhängig bestätigte/ unbestätigte Komplettremissionsrate). Bei einem medianen Followup von 55 Monaten beträgt das pro – gressionsfreie Überleben 62 %. Von Interesse ist die Beobachtung, dass die Behandlungsergebnisse zwischen Patienten mit GCB- (germinal centre Bcell) und ABC-Subtyp (activated B-cell) nicht unterschiedlich waren (Cave: Bestimmung der DLBCL-Subtypen immunhistochemisch anhand des Hans-Algorithmus und nicht mittels Genexpressionsanalysen). 4 Daher wird von der CALGB (Cancer and Leukemia Group B) eine prospektive Studie von DA-EPOCH versus R-CHOP durchgeführt.
R-ACVBP: Diese Studie (GELA-Trial LNH03-2B) wurde bereits beim ASH 2010 präsentiert und zeigte einen Vorteil von R-ACVBP gegenüber R-CHOP. Aktuell wurden die Ergebnisse für die GCB und Non-GCB-Subgruppen präsentiert (Cave: auch hier basierend auf Immunhistochemie). Das progressionsfreie 3- Jahres-Überleben war beim GCB-Subtyp (n = 101) in beiden Behandlungsarmen ident (80 % versus 78 %). Beim prognostisch ungünstigeren Non-GCB-Subtyp (n = 128) zeigte sich allerdings ein Vorteil für die Patienten, die mit R-ACVBP behandelt wurden (90 % vs. 70 % bei R-CHOP).5
T-Zell-Lymphome
Gerade bei den T-Zell-Lymphomen besteht ein besonderer „medical need“ für effektive Therapieansätze, weshalb Daten zu neuen Substanzen besonders aufmerksam verfolgt werden.
Romidepsin: Diese Auswertung der bereits am ASH 2010 vorgestellten Studie mit dem Histondeacetylaseinhibitor Romidepsin zeigte eine Ansprechrate von 33 % (28 von 117 Patienten mit rezidiviertem/ refraktärem peripheren T-Zell- Lymphom). Die Ansprechraten waren dabei unabhängig vom histologischen Subtyp (ALK-1-negatives anaplastisches großzelliges Lymphom [ALCL], angioimmunoblastisches T-Zell-Lymphom, andere periphere T-Zell-Lymphome).6
Brentuximab-Vedotin: Studien-Update von 58 Patienten mit rezidiviertem/refraktären CD30+ ALCL, die mit Brentuximab- Vedotin als Monotherapie behandelt wurden.7 86 % der Patienten erreichten zumindest eine PR, 59 % der Patienten eine CR/Cru. Die mediane Remissionsdauer betrug 13,2 Monate (median noch nicht erreicht bei Patienten in CR) und war damit signifikant länger als die Remissionsdauer der vorangegangenen Therapielinie (median 5,9 Monate).
KEY MESSAGES
Follikuläres B-Zell-Lymphom
- Rituximab-Erhaltungstherapie verlängert die Zeit bis zur zytotoxischen Therapie
Mantelzell-Lymphom
- Höhere Ansprechraten und längeres Gesamtüberleben in der „Elderly“-Studie des Europäischen Mantelzell-Lymphom-Netzwerks (EMN) bei Patienten im medianen Alter von 70 Jahren durch R-CHOP + Rituximab-Erhaltung gegenüber R-FC + Rituximab-Erhaltung; nach R-FC empfiehlt sich in dieser Studie keine Rituximab-Erhaltungstherapie
Diffus großzelliges B-Zell-Lymphom (DLBCL)
- Versuche der Therapieoptimierung durch Variationen des Zytostatika-Cocktails, dosisintensiv mit R-ACVBP (franz. GELA-Regime) oder EPOCH-R, dosisdicht mit dem deutschen SMARTE-R-CHOP-14-Regime, hier unter Berücksichtigung pharmakokinetischer Parameter des CD20-Antikörpers und daraus abgeleiteter Dosierungsmodifikationen sowie unter Einbeziehung prognoserelevanter B-Zell-Phänotypen
T-Zell-Lymphome
- Bei der seltenen Gruppe der T-Zell-Non-Hodgkin-Lymphome mit oft schlechter Prognose (z. B. ALK-negative Patienten) könnten neue Substanzen wie Romidepsin oder Brentuximab-Vedotin die therapeutischen Möglichkeiten erweitern
1 Kahl BS et al., ASH 2011, LBA-6
2 Kluin-Nelemans JC et al., R-CHOP versus R-FC followed by maintenance with rituximab versus interferon-alpha: outcome of the first randomized trial for elderly patients with mantle cell lymphoma. ASH 2011, Abstr. # 439
3 Pfreundschuh M et al., Improved outcome of elderly, poor-prognosis DLBCL patients with 6x CHOP-14 and 8 applications of rituximab given over an extended period: Results of the SMARTE-R-CHOP-14 trial of the German High-grade non-Hodgkin lymphoma Study Group (DSHNHL). ASH 2011, Abstr. # 592
4 Purroy et al., Dose-adjusted EPOCH plus rituximab in untreated patients with poor prognosis large B-cell, with analysis of germinal center and activated B-cell biomarkers. A phase IV study conducted by the Spanish PETHEMA Group. ASH 2011, Abstr. # 593
5 Molina T et al., R-ACVBP benefits to younger patients with non-germinal centre DLBCL as compared to R-CHOP in the GELA trial LNH03-2B. ASH 2011, Abstr. # 2632
6 Coiffier B et al., Analysis of patients with common peripheral T-cell lymphoma subtypes from a phase 2 study of romidepsin in relapsed or refractory peripheral T-cell lymphoma. ASH 2011, Abstr. # 591
7 Advani R et al., Brentuximab Vedotin (SGN-35) in patients with relapsed or refractory systemic anaplastic large cell lymphoma: a phase 2 study update. ASH 2011, Abstr. # 443