Behandlung des HER2−positiven Mammakarzinoms in der kurativen und palliativen Situation
In den 1980ern wurde der Rezeptor und Signalweg HER2/neu als schlechter prognostischer Marker der metastasierten Brustkrebserkrankung und als neues therapeutisches Ziel identifiziert. In der weiteren Entwicklung hat sich die besondere Relevanz bestätigt, und wir konnten in den letzten 3 Jahrzenten mitverfolgen, wie sich die Geschichte der HER2/neu-positiven Brustkrebserkrankung entwickelt und ändert. Der Anteil der HER2/neu-positiven Mammakarzinome macht etwa 15 % der Gesamtkarzinome aus, und etwas mehr als die Hälfte exprimiert auch die Hormonrezeptoren. Mittlerweile haben wir zugelassene gegen HER2/neu gerichtete Medikamente im fortgeschrittenen Stadium, inklusive Trastuzumab (Herceptin® und aktuell auch bereits zugelassene und in Zulassung befindliche Biosimilars), Pertuzumab, Lapatinib, und T-DM1, das nach erfolgter Zulassung durch die European Medical Agency EMA bald auch in Österreich erhältliche Neratinib und eine Reihe von weiteren Medikamenten die derzeit in klinischer Prüfung oder auch in Zulassung sind. Die meisten der angeführten Medikamente sind im fortgeschrittenen Stadium zugelassen und ein Teil auch für die Behandlung des frühen neoadjuvanten und/oder adjuvanten Stadiums. Die Zulassung für Neratinib ist für die adjuvante Behandlung und eingeschränkt auf Hormonrezeptor-positive Patientinnen gültig.
Therapie im kurativen Ansatz
Die Diagnose im lokalisierten Stadium (Primum und gegebenenfalls Befall der regionalen Lymphknoten) bedeutet eine potenziell kurative Situation, mit Risiko der Rezidivierung abhängig von Risikofaktoren. Eine Neigung zur präoperativen systemischen Therapie ist in den letzten Jahren insbesondere in der Behandlung von Primärtumoren mit aggressiverer Biologie entstanden. Die Entscheidung zur Art der Therapie, zu ihrer Komplexität und gegebenenfalls ihrer Dauer wird zunehmend vom Rezidivrisiko abhängig gemacht, und dieses hängt eindeutig mit dem Stadium der Erkrankung zum Zeitpunkt der Diagnose zusammen.
Seit der Publikation der NOAH-Studie hat nicht nur die neoadjuvante Therapie deutlich zugenommen, sondern auch der Einsatz der Immuntherapie bereits in der präoperativen Phase. Die NOAH-Studie hat gezeigt, dass Trastuzumab zur deutlichen Verbesserung der pathologisch kompletten Remission und der gesamten Remission führt. Die NeoSphere-Studie testete die Kombination von Pertuzumab und Trastuzumab entweder als isolierte Immuntherapie oder als einzelne Antikörpergabe mit Docetaxel im Vergleich zur Kombination von Pertuzumab und Trastuzumab mit Docetaxel präoperativ. Im Anschluss an die Operation erhielten alle Patientinnen adjuvant die noch ausstehende Chemotherapie und Trastuzumab. Die Ergebnisse dieser Studie führten zur Zulassung von Pertuzumab neoadjuvant in Kombination mit Trastuzumab und Chemotherapie, da die pathologische komplette Remission im Vergleich zu den anderen Armen deutlich verbessert war. Die neoadjuvanten Ergebnisse wurden nochmals in der TRYPHAENA-Studie bestätigt. Die Zulassung war mit der Bestätigung des positiven Ergebnisses in der adjuvanten Studie APHINITY verbunden. Aus den neoadjuvanten Studien haben wir gelernt, dass das Erreichen einer pathologisch kompletten Remission prognostisch günstig ist und dass dieser Effekt in Hormonrezeptor-negativen Patientinnen betonter ist. Eine pathologisch komplette Remission wird konsequent in allen neoadjuvanten Studien mit höherer Wahrscheinlichkeit in dieser Untergruppe mit häufigeren aggressiveren Tumoren erreicht. Wie die Langzeitergebnisse der NeoSphere-Studie gezeigt haben, bleibt trotzdem zu bedenken, dass das Erreichen einer pathologisch kompletten Remission keine sichere Heilung bedeutet, da in der Gruppe der Patientinnen mit pathologisch kompletter Remission 12 % der Patientinnen auch ein Rezidiv erlitten: damit war die Rate zwar deutlich niedriger als in der Gruppe, die keine volle Remission erreichte (18 %); es sind aber auch Patientinnen mit pathologischer Komplettremission weiterhin einem Risiko ausgesetzt. Diese Fakten könnten beider Überlegung eine Rolle spielen, wie die adjuvante Therapie bei individuellen Patientinnen gestaltet werden soll.
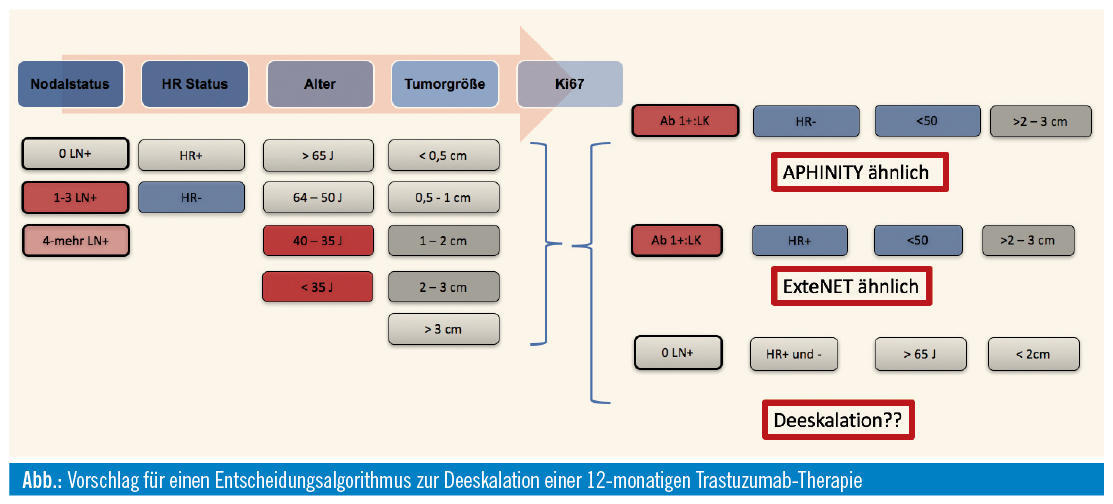
Die Abbildung zeigt, welche Parameter bei der Entscheidung zur adjuvanten Therapie in Betracht gezogen werden sollen und wie diese beeinflusst werden kann. Es scheint immer klarer zu werden, dass in frühen Stadien die HER2/neu-positiven Patientinnen immer differenzierter behandelt werden sollen und dass die einheitliche Behandlung mit Trastuzumab für ein Jahr immer mehr der Vergangenheit angehört. Da einige Studien, die zur Entscheidung beitragen, adjuvante Studien waren und die Mehrheit der Patientinnen bereits neoadjuvant behandelt wird, wird man im Alltag sehr oft zu einer übergreifenden Entscheidung mit Erkenntnissen aus mehreren Studien in unterschiedlichen Indikationen gezwungen. In den neoadjuvanten Studien erhielten die Patientinnen insgesamt ein Jahr lang adjuvant Trastuzumab. In der adjuvanten APHINITY-Studie zogen aber Patientinnen, die Lymphknoten-positiv waren und ein Jahr lang zusätzliches Pertuzumab erhielten, die meisten Vorteile. Die Zulassung von adjuvantem Pertuzumab erfolgte für Hochrisikopatientinnen. Es scheint deshalb besonders wichtig, bei Patientinnen möglichst genau zum Zeitpunkt der Diagnose das klinische Stadium zu bestimmen. Die Gruppe der Patientinnen mit primär klinisch positiver Axilla sollte auf jeden Fall für die Zugabe von Pertuzumab über eine Zeitspanne von einem Jahr evaluiert werden. Sollten diese Patientinnen auf die neoadjuvante Therapie reagieren, wäre eine Fortführung der Therapie auch dann zu erwägen, wenn eine pathologisch komplette Remission erreicht wurde. Im Falle der Hormonrezeptorexpression wird für diese Patientinnen nach der Zulassung von Neratinib in Österreich nach einem Jahr Trastuzumab eventuell ein Jahr Neratinib unter Beachtung der Nebenwirkungen, insbesondere von Durchfall, angeschlossen.
Für ältere Patientinnen mit kleinen Tumoren und negativen Lymphknoten sollte eine eventuelle Deeskalation der Therapie überlegt werden. Hier sollte insbesondere erwogen werden, Trastuzumab in den 6 Monaten nach erfolgreicher Chemotherapie zu verabreichen, da die Persephone-Studie, eine große Studie mit 4.000 Patientinnen, nun gezeigt hat, dass eine kürzere Verabreichungszeit von 6 Monaten längeren Zeitspannen nicht unterlegen ist.
Palliative Therapie
Die ersten Studien, die zur Zulassung von Trastuzumab zur Behandlung der HER2/neu-positiven metastasierten oder fortgeschrittenen Brustkrebserkrankung führten, testeten Trastuzumab in Kombination mit unterschiedlichen Monochemotherapien, allen voran mit Taxanen. In der CLEOPATRA-Studie wurde die Kombination von Pertuzumab und Trastuzumab plus Docetaxel mit der damals aktuellen Erstlinientherapie Docetaxel und Trastuzumab verglichen. Der Anstieg im progressionsfreien Überleben war von 12, 4 Monate auf 18,7 Monate (> 6 Monate, HR 0,68 (95%-KI 0,58–0,80), und auch das Gesamtüberleben konnte von 40,8 auf 56,5 Monate (HR 0,68; 95%-KI 0,56–0,84) deutlich verlängert werden. Damit wurde die Kombination der Taxane mit der dualen HER2/neu-Inhibition in der Erstlinie als Therapie erster Wahl etabliert. Allerdings ist auch zu betonen, dass nur weniger als 25 % der Patientinnen, die in dieser Studie eingeschlossen waren, mit Trastuzumab vorbehandelt wurden. Heutzutage haben wir aber oft die Situation, dass Patientinnen primär bereits mit dualer HER2/-Modulation in der kurativen Situation behandelt wurden und wir keine Daten darüber haben, wie dann die derzeit zugelassene Erstlinientherapie wirkt. Die ersten Analysen aus dem sogenannten „Real-Time“-Setting deuten darauf hin, dass der Vorteil in der vorbehandelten Patientinnenpopulation deutlich geringer ist.
In der EMILIA-Studie wurde die Zweitlinientherapie mit Capecitabin und Lapatinib mit dem in der Behandlung solider Tumoren ersten verfügbaren Antikörperkonjugat T-DM1 verglichen, und es konnte auch in der zweiten Linie ein weiterer Vorteil erreicht werden. Der Anstieg des progressionsfreien Überlebens war von 6,4 Monate auf 9,6 Monate (HR 0,65; 95%-KI 0,55–0,77) und im Gesamtüberleben konnte ein Gewinn von 25,9 auf 29,9 Monate erreicht werden, HR 0,75 (95%-KI 0,64–0,88). Da die EMILIA-Studie noch zu einer Zeit durchgeführt wurde, als die Erstlinientherapie der Wahl eine Kombination von Docetaxel mit der HER2/neu-Monotherapie Trastuzumab war, blieb trotz der Zulassung in der Zweitlinie die Frage offen, wie der zu erwartende Vorteil nach der dualen Blockade mit Trastuzumab und Pertuzumab zu erwarten sei. Eine retrospektive Studie, publiziert von Dzimitrowicz et al. im Journal of Clinical Oncology 2016, hatte diese Fragestellung im Fokus und zeigte, dass T-DM1 auch nach der Kombination von Trastuzumab und Pertuzumab aktiv ist, wenn auch weniger als bei nichtvorbehandelten Patientinnen oder nach alleiniger Trastuzumab-Vorbehandlung. Die Kombination von Capecitabin mit Lapatinib wurde jedenfalls als nebenwirkungsreichere und weniger aktive Kombination in spätere Linien gereiht. Die Aktivität von T-DM1 wurde auch in der THERESA-Studie bestätigt, in späteren Linien und im Vergleich zu anderen.
Weitere Daten werden auch aus dem internationalen Register Samantha erwartet. In späteren Linien sind die Beweise für die Therapie schwächer, und es bleibt offener, welche Kombinationen einzusetzen sind. Auch neue therapeutische Ansätze wie die Kombination mit Immun-Checkpoint-Inhibitoren (PANACEA-Studie) oder mit CDK4/6-Inhibitoren sind in Testung und vielversprechend, und es sind neue Medikamente, auch neue Konjugate, in Testung. Die Behandlung von HER2/neu-positiven metastasierten Patientinnen bleibt eine Herausforderung mit immer längeren Verläufen und immer besseren Ergebnissen.
Resümee
Der Verlauf der HER2/neu-positiven Erkrankungen im frühen kurativen Ansatz, aber auch in der palliativen Situation wurde durch Einsatz von gezielten Therapien deutlich verbessert. In der kurativen Situation gibt es derzeit mehr Entscheidungsdynamik, und neue Standards werden aktuell festgelegt. In der Palliation kommen weitere Ansätze, welche die Behandlung der Erkrankung in der baldigen Zukunft nochmals verbessern werden.