Neoadjuvante Therapie des Mammakarzinoms
Die neoadjuvante (präoperative) systemische Therapie (NAT) des Mammakarzinoms ist ein seit Jahrzehnten bewährtes Therapiekonzept und grundsätzlich für alle Frauen eine Option, bei denen eine Indikation für eine adjuvante systemische Chemotherapie besteht.1 Die primären Zielsetzungen der neoadjuvanten Therapie umfassen a) die Verbesserung des chirurgischen und kosmetischen Ergebnisses durch „downstaging“ des Tumors, b) eine frühe Einschätzung des Ansprechens und tumorbiologischen Verhaltens und c) die Verbesserung des onkologischen Outcomes und die Senkung der Mortalität.1 NAT ist gemäß den rezenten Leitlinien der bevorzugte Therapieansatz beim Stadium-II/III-HER2-positiven und triplenegativen (TNT) Mammakarzinom.2
Während kein signifikanter Unterschied im Gesamtüberleben zwischen neoadjuvanter und adjuvanter systemischer Therapie in der Gesamtpopulation gezeigt werden konnte, erscheint der klinische Endpunkt des pathologischen kompletten Ansprechens (pCR) nach neoadjuvanter Therapie für das onkologische Outcome wie unten angeführt relevanter.
Pathologisches komplettes Ansprechen
pCR ist definiert als die Absenz eines residualen invasiven Tumoranteils. Große Metaanalysen von Studien mit bis zu 12.000 Patientinnen konnten demonstrieren, dass Patienten mit einer pathologischen Komplettremission (ypT0; ypN0) ein überlegenes Gesamtüberleben und ereignisfreies Überleben (EFS) hatten im Vergleich zu Patientinnen, bei denen keine pCR erzielt werden konnte (Abb.).3–5 Diese Korrelation zeigte sich bei TNT- und HER2-positiven Tumoren besonders deutlich.
Abgesehen davon scheinen höhere pCR-Raten bei TNT- und HER2-positiven Tumoren mit der Anzahl an tumorinfiltrierenden Lymphozyten (TIL) assoziiert zu sein, während eine PIK3CA-Mutation das Gegenteil zu bewirken scheint.6, 7 Obwohl die prognostische Rolle einer pCR in statistischen Analysen hinterfragt wurde, hat sich dieser Endpunkt als Surrogatmarker für OS und EFS nach neoadjuvanter Therapie etabliert und wird sowohl von der amerikanischen (FDA) als auch von der europäischen (EMA) Zulassungsbehörde als Endpunkt für neoadjuvante Studien anerkannt.8, 9
Seitdem die NSABP-B-27-Studie zeigen konnte, dass der Zusatz von 4 Zyklen Docetaxel im prä- oder postoperativen Setting zu 4 Zyklen Doxorubicin/Cyclophosphamid zu einer höheren pCR-Rate führen konnte (26,1 % vs. 12,9 %), wurden zahlreiche Studien mit neuen Substanzen oder alternativen Protokollen durchgeführt.10 Die wichtigsten neuen neoadjuvanten Therapiekonzepte werden in den folgenden Absätzen vorgestellt.
Zytotoxische neoadjuvante Therapie
nab-Paclitaxel
Die Phase-III-Studie GeparSepto verglich nab-Paclitaxel mit konventionellen Paclitaxel jeweils gefolgt von Epirubicin/Cyclophosphamid bei 1.206 Patienten. Die pCR-Rate mit nab-Paclitaxel war signifikant höher (38 %) verglichen mit dem Standardarm (29 %), wobei die Rate an sensorischer Neuropathie ebenfalls erhöht war.11 Besonders TNT-Patienten profitierten. Das Risiko für ein Rezidiv war ebenfalls verringert (HR 0,69; 0,54–0,89).12 Interessanterweise konnten diese Ergebnisse von der (kleineren) ETNA-Studie nicht bestätigt werden. Es zeigten sich ähnliche pCR-Raten, wobei angemerkt werden muss, dass in dieser Studie die Verabreichung eines Anthrazyklins optional war.13 Insgesamt stellt nab-Paclitaxel für ausgewählte Patienten jedoch durchaus eine Therapieoption dar.
Carboplatin
Platinbasierte neoadjuvante Therapie wird vor allem bei TNT kontroversiell diskutiert. Bereits die Phase-II-GeparSixto-Studie, die wöchentliches liposomales Doxorubicin/Paclitaxel/Bevacizumab mit oder ohne Carboplatin untersuchte, konnte eine gesteigerte pCR-Rate im Carboplatin-Arm demonstrieren (53,2 % vs. 36,9 %).14 Der Effekt von Carboplatin war vor allem auf die BRCA-Wildtyp-Patienten beschränkt. In der Phase-III-Studie BrigtTNess, die die Zugabe von Carboplatin (mit oder ohne Veliparib) zu einer Standard neoadjuvanten Therapie mit Paclitaxel gefolgt von Doxorubicin/Cyclophosphamid untersuchte, konnte gezeigt werden, das die pCR-Raten in den Carboplatin-Armen (Carboplatin plus Veliparib: 53,2 %; Carboplatin: 57,5 %) verglichen mit dem Kontrollarm (31 %) deutlich höher waren.15 Veliparib zeigte keinen zusätzlichen Vorteil. Eine rezente Metaanalyse konnte ebenfalls zeigen, dass Platintherapie die pCR-Raten in einer TNT-Population von 37 % auf 52 % signifikant erhöht.16 Einschränkend sei darauf hingewiesen, dass es zu mehr hämatologischen Toxizitäten kommen kann und das OS nicht signifikant unterschiedlich war.16 In Zusammenschau der Datenlage erscheint Carboplatin als Teil der neoadjuvanten Therapie in einer TNT-Population als valide Therapieoption, obwohl die Stellung eines Platins in diesem Setting noch nicht abschließend geklärt ist.
Zielgerichtete neoadjuvante Therapie
Zahlreiche Studien evaluierten die Zugabe von zielgerichteten Therapien im neoadjuvanten Setting. Der Großteil dieser Studien führte zu keiner Änderung in der klinischen Praxis. Die Ausnahme bilden Studien zur zielgerichteten Therapie bei HER2-positiven Tumoren. Die Zugabe des Anti-HER2-Antikörpers Trastuzumab (T) zu einer Standardchemotherapie führte zu einer signifikanten Verdoppelung der pCR.17 Die pCR-Raten können durch die Zugabe von Pertuzumab (P) zum Standard-Chemotherapie-plus-Trastuzumab-Protokoll weiter gesteigert werden (auf ca. 50 %) wie Phase-II-Studien (NeoSphere und TRYPHAENA) demonstrieren konnten.18, 19 Ein DFS-Vorteil zeigte sich in der NeoSphere-Studie jedoch nicht, wobei diese Studie statistisch dafür nicht gepowert war.
Im Bestreben, bei HER2-positiven Patienten eine Therapie-Deeskalation zu erreichen, wurde die Phase-II-Studie ADAPT der Westdeutschen Studiengruppe durchgeführt, die demonstriert, dass wöchentliches Paclitaxel plus Trastuzumab/Pertuzumab für 12 Wochen verglichen mit Trastuzumab/Pertuzumab alleine mit einer pCR von 90,5 % vs. 36 % der Chemotherapie-freien Alternative überlegen ist, wobei die Fallzahl im Chemotherapiearm mit 42 Patienten klein war.20
Obwohl die Addition des EGFR/HER2-Tyrosinkinase-Inhibitors Lapatinib zur Standard-Chemo-Trastuzumab-Therapie die pCR-Raten ebenfalls steigern konnte, wie in der Phase-III-Studie NeoALLTO evaluiert, hat sich dieser Ansatz aufgrund höherer Toxizitäten nicht durchgesetzt.21
Zusätzliche Gabe von endokriner Therapie zur Standard-NAT bei HER2-positiven Tumoren bringt keinen zusätzlichen Vorteil, wie die Phase-III-Studie NSABP B-52 zeigen konnte.22
Das Antikörper-Wirkstoff-Konjugat Trastuzumab-Emtansin (T-DM1) wurde ebenfalls im neoadjuvanten Setting evaluiert. In der oben genannten ADAPT-Studie wurde zusätzlich bei HER2-positiven Patienten die Kombination von T-DM1 mit endokriner Therapie, mit T-DM1 alleine und Trastuzumab plus endokrine Therapie verglichen. Die pCR-Raten waren mit T-DM1 signifikant höher als mit Trastuzumab (45,8 %; 40,5 % vs. 6,7 %).9 In der Phase-III-Studie KRISTINE, die T-DM1/Pertuzumab mit Docetaxel/Carboplatin plus TP untersuchte, fand sich ein Vorteil in der pCR-Rate mit klassischer Therapie (44,4 % vs. 55,7 %).23
In Zusammenschau dieser Studienergebnisse bildet daher Trastuzumab/Pertuzumab plus Chemotherapie den Standard für die neoadjuvante Therapie im HER2-positiven Setting.
Da der RANK-Ligand-Antikörper Denosumab im adjuvanten Setting, wie in der ABCSG-Studie 18 berichtet, Aktivität gezeigt hatte, sind auch Studien in der neoadjuvanten Situation von Interesse. Die deutsche Brustkrebs-Studiengruppe untersucht diese Fragestellung in der GeparX-Studie, wobei die Ergebnisse noch ausständig sind. Eine weitere offene Fragestellung ist der Stellwert der PARP-Inhibitoren wie Olaparib oder Veliparib in der neoadjuvanten Therapie bei BRCA-mutierten Patientinnen. Erste Ergebnisse einer Phase-II-Studie mit dem PARP-Inhibitor Talazoparib als Monotherapie, die am ASCO 2018 Annual Meeting präsentiert wurde, zeigten bei BRCA-TNT-Patienten eine pCR-Rate von 53 %.24
Immuntherapie
Die Zulassung der PD-1/PDL-1-Checkpoint-Inhibitoren hat eine weitere Therapieoption in der Onkologie etabliert. In der Therapie des Mammakarzinoms beschränken sich die Erfolge dieser Therapiestrategie derzeit auf triplenegative Tumoren, wobei eine rezente Pressemeldung der ersten positiven Phase-III-Studie (IMpassion 130) im metastasierten Setting in Kombination mit nab-Paclitaxel für Aufsehen gesorgt hat.
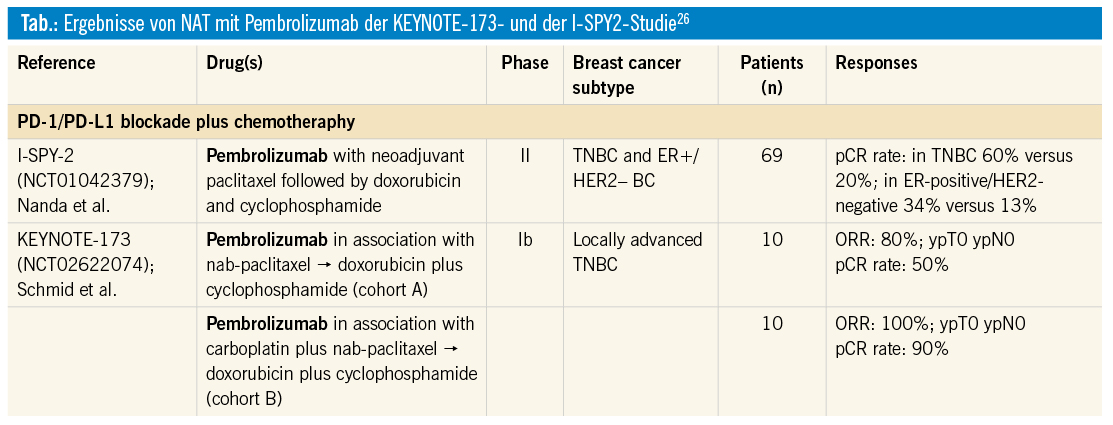
In der neoadjuvanten Situation ist noch keine positive Phase-III-Studie publiziert. Kleinere Studie lieferten jedoch vielversprechende Ergebnisse. In der am ASCO Annual Meeting 2018 präsentierten GeparNuevo-Studie wurde der PDL-1-Inhibitor Durvalumab mit Standard-Chemotherapie bestehend aus nab-Paclitaxel und Epirubicin/Cyclophosphamid bei TNT-Patienten kombiniert und mit Placebo verglichen. In der Durvalumab-Gruppe wurde ein nichtsignifikanter Anstieg der pCR-Raten von 44,2 % auf 53,4 % detektiert.25 Weitere vielversprechende Ergebnisse wurden mit dem PD-1-Inhibitor Pembrolizumab in der KEYNOTE-173- und in der I-SPY2-Studie erzielt. Die Ergebnisse dieser Studien sind in der Tabelle zusammengefasst.
Damit die Immuntherapie auch Platz in der täglichen klinischen Praxis findet, werden die Ergebnisse von Phase-III-Studien wie z. B. KEYNOTE-522 mit Pembrolizumab oder GeparDouze mit Atezolizumab mit Spannung erwartet.
Neoendokrine Therapien
Im Gegensatz zu triplenegativen und HER2-positiven Tumoren finden sich bei hormonrezeptor-(HR-)positiven, HER2-negativen Tumoren deutlich geringere pCR-Raten nach neoadjuvanter Chemotherapie. In einer Metaanalyse konnte gezeigt werden, dass der OS-Vorteil einer Polychemotherapie in älteren postmenopausalen Patientinnen mit HR-positiven Tumoren nur ca. 4 % beträgt.27 Speziell für eine ältere, oft multimorbide Patientenpopulation mit niedrig proliferativen Tumoren wurde daher das Konzept der neoendokrinen Therapie (NET) entwickelt. NET alleine resultiert in einer pCR-Rate von 10 %.28 Studienergebnisse deuten in der oben definierten Patientenpopulation darauf hin, dass NET einer Chemotherapie nicht unterlegen ist.9 Eine protrahierte Behandlung mit einem Aromataseinhibitor von 6–12 Monaten erhöht die pCR-Rate und ist Tamoxifen überlegen.9 Eine Metaanalyse konnte ebenfalls zeigen, dass die Ansprechraten von NET und neoadjuvanter Chemotherapie ähnlich waren, bei niedrigerer Toxizität mit NET.29
Zukünftige Studien verfolgen Kombinationsstrategien mit PI3K- oder CDK4/6-Inhibitoren und neoendokriner Therapie und erweitern die potenzielle Anwendbarkeit auch auf eine Population mit erhöhtem Risiko. So untersuchte die NA-PHER2-Studie die Kombination von Trastuzumab/Pertuzumab/Fulvestrant und dem CDK4/6-Inhibitor Palbociclib bei HR-positivem HER2-positivem Mammakarzinom in neoadjuvanter Intention. Eine pCR-Rate von 29 % wurde berichtet.30 Abschließend sei erwähnt, dass die Kombination eines CDK4/6-Inhibitors mit endokriner Therapie nicht nur im neoadjuvanten, sondern auch im adjuvanten Setting intensiv untersucht wird und die Ergebnisse der ABCSG-42/PALLAS-Studie mit großer Spannung erwartet werden.
17 Buzdar AU, Ibrahim NK, Francis D, et al. Significantly higher pathologic complete remission rate after neoadjuvant therapy with trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2005; 23:3676–85.























































































_Felicitas_Matern_opt.jpg)

