CAR-T-Zellen bei soliden Tumoren
Die Modifikationen körpereigener Abwehrzellen über gentechnologische Mechanismen, die die zentralen Strukturen der Antigenerkennung verbessern bzw. reaktivieren und die die spezifischen Signale entlang des T-Zell-Rezeptors zur letztlich ultimativen Zerstörung der jeweiligen anzugreifenden Tumorzellen vermitteln, stellen tatsächlich einen Meilenstein in der Entwicklung der Immuntherapien, ja der Tumortherapie insgesamt dar. Dies begründet sich zum einen auf dem raschen proof of principle bei CD19-positiven B-Zell-Neoplasien.
Sehr viel mehr ist die Erwartungshaltung, die derzeit noch bestehenden Schwierigkeiten und Hürden bei der Behandlung solider Tumoren zu überwinden, aber durch folgende Faktoren begründet:
- Die Technologie erlaubt es, fast jede Form von Abwehrzellen in gewünschter Richtung zu modifizieren, wobei diese Modifikation einerseits an apheretisierten Zellen des peripheren Blutes erfolgen kann, aber auch an Tumor-infiltrierenden Lymphozyten eines Biopsats eines soliden Tumors oder etwa mittels der CRISPR/Cas9-Technologie durch in situ Modifikation der Abwehrzellen innerhalb des soliden Tumors.
- Der Vektor kann in multipler Weise modifiziert werden. Bei fast zwei Drittel aller soliden Tumoren können die Abwehrzellen nicht in den Tumor eindringen und reihen sich entweder pallisadenhaft an der Zirkumferenz des Tumors an oder werden vollständig aus Zentrum und Peripherie des Tumors ferngehalten (immunologische Wüste). Es können aber Konstrukte gebildet werden, die zur Expression eines Rezeptors für spezifische Chemokine des individuellen Tumors führen, über die der Tumor spezifisch die modifizierten Abwehrzellen anlockt. Viele Tumoren sind sehr stromareich, und die Signatur der Stromagenexpression im Tumorgewebe hat sich als einer der wichtigsten Prädiktoren der Response auf Immuntherapien erwiesen. Tatsächlich ist das Stroma von soliden Tumoren hoch aberrant und hemmt nicht nur die Infiltration des Tumors durch Abwehrzellen, sondern auch deren Funktion. CAR-T-Zellen können nun so konstruiert werden, dass sie einerseits anti-FAP (focal adhesion protein)-Moleküle produzieren und damit Krebs-assoziierte Fibroblasten angreifen und dadurch das Tumorwachstum vieler Tumoren in experimentellen Systemen hemmen können; sie können andererseits auch zur Freisetzung von Heparanase konstruiert werden und damit die Tumorinvasion durch T-Zellen erleichtern. Auch kann die hohe Immunsuppression durch PD-L1/PD1-Interaktion besser inhibiert werden, wenn nicht systemisch die inhibierenden Checkpoint-Inhibitoren administriert, sondern diese lokal durch das CAR-Konstrukt der Abwehrzellen freigesetzt werden.
- Ein wesentlicher Teil der Problematik von CAR-Technologien bei soliden Tumoren besteht in der Wahl geeigneter, möglichst tumorspezifischer Antigenstrukturen einerseits und der heterogenen Expression solcher Antigene an Tumorzellsubpopulationen andererseits. Während der Verlust von B-Zellen, wie er durch Anti-CD19-CAR-T-Zellen vermittelt wird, bereits mit den Anti-CD20-Antikörpern der Vergangenheit als klinisch handhabbar bewiesen wurde, hat es mit Karzinom-assoziierten Antigenen zum Teil massive und in Einzelfällen auch tödliche Toxizitäten gegeben – und es sind die Heterogenitäten auch ein Grund für die verminderte Wirksamkeit. Dem kann technologisch mehrfach begegnet werden, indem zur Toxizitätsvermeidung/-verminderung CAR-Konstrukte gebildet werden, die gegen Farbstoffe gerichtet sind, sodass nach Spritzen von niedrigen Dosen von Farbstoff-markierten Antikörpern gegen zahlreiche Oberflächenantigene von Tumoren vorwiegend Tumorzellen eliminiert werden, die nicht nur ein, sondern viele Oberflächenantigene des Tumors porträtieren. Alternativ können Konstrukte gebildet werden, in denen der T-Zell-Rezeptor nur dann aktiviert werden kann, wenn zumindest zwei Tumor-assoziierte Antigene gleichzeitig vorhanden sind. Auf diese Weise kann der Unterschied der Tumorziele gegenüber normalen Strukturen signifikant erhöht werden. Letztlich können aber auch Suizidgene eingeführt werden, mit denen eine nur zeitlich limitierte Funktion der CAR-T-Zellen und damit limitierte Toxizität gewährleistet wird.
Stand der Klinik dieser Technologie bei CAR-T-Zellen
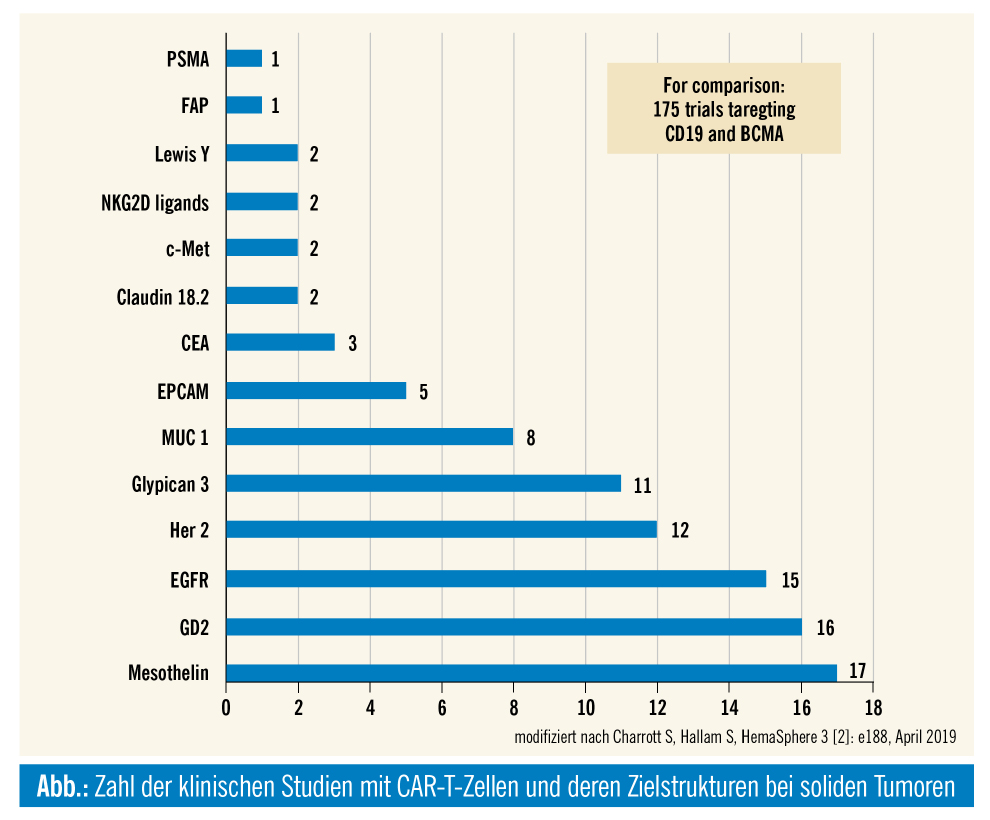
Bis Mai 2019 wurden 160 beendete oder laufende Studien bei soliden Tumoren gemeldet. In der Abb. ist eine Auswahl bisher angesteuerter Antigenstrukturen bei soliden Tumoren dargestellt.
Betrachtet man die damit erzielten Resultate, so zeigt sich, dass anti EGFRvIII-CAR-T-Zellen nach i. v.-Infusion bei Glioblastomen das Tumorgewebe erreichen und auch aktiviert werden, dass allerdings auch rasch immunsuppressive Microenvironment-Reaktionen auftreten. Vereinzelt wurden mit Anti-Her2-CAR-T-Zellen bei diesem Tumor v. a. nach intracavitärer Applikation länger dauernde Remissionen beschrieben.
Auf Infusion von Anti-GD2-CAR-T-Zellen wurden bei 3 von 11 Kindern mit fortgeschrittenen Neuroblastomen komplette Remissionen gesehen.
Anti-Her2-CAR-T-Zellen wurden auch bei Sarkompatienten nach vorausgehender Lymphodepletion eingesetzt, wobei in einer Phase-I-Studie einer von zehn massiv vorbehandelten Patienten eine CR erreichte.
Bei Patienten mit Mesothelin-exprimierenden Tumoren und Befall der Pleura konnte in einer Phase-I-Studie gezeigt werden, dass nach intrapleuraler Injektion die langfristige Persistenz der CAR-T-Zellen im Blut mit einer Remission verbunden war. Interessanterweise konnte im Rückfall nach Applikation von Anti-PD1-Antikörpern eine erneute Remission beobachtet werden, was auch für eine Kombinationstherapie spricht. In einer Phase-I-Studie zur Kombination Mesothelin-spezifischer CAR-T-Zellen mit Pembrolizumab, in der Patienten mit Bronchus- und Mammakarzinomen enthalten waren, wurde eine 72 %ige Ansprechrate mit 2 von 21 dauerhaften CRs beobachtet.
In einer weiteren Phase-I-Studie bei metastasierten Adenokarzinomen (7 Magenkarzinome, 5 Pankreaskarzinome) zeigte die Applikation von a-Claudin-18.2-CAR-T-Zellen eine objektive Responserate von 33 % mit einem Fall von CR.
Erfolgreiches Beispiel für das Erreichen reduzierter Toxizität kann im Angreifen autologer Prostatakarzinom-Stammzell-Antigene gesehen werden. Bei Patienten mit Karzinomen des Hals-Nasen-Ohren-Trakts werden CAR-T-Zellen mit zwei chimären Rezeptoren gegen Her2, Her3 und EGFR sowie mit dem IL-4-Rezeptor ohne vorangegangene Lymphodepletion intratumoral injiziert. 9 von 15 Patienten zeigten bei einer Auswertung im Jänner 2019 eine stabile Erkrankung mit Hinweisen auf eine Prolongation des Überlebens. Immerhin acht Target-Strukturen werden beispielsweise mit NKG2D-CAR-T-Zellen angegriffen, und die wiederholte i. v.-Verabreichung zeigte für CYAD01 bei Kolorektal- und Ovarialkarzinomen eine 29 %ige SD-Rate.
Insgesamt kann mit diesen ausgewählten Beispielen die Breite der Entwicklung der CAR-T-Zell-Ansätze bei soliden Tumoren illustriert werden.
Resümee
Knapp 25 % aller derzeit laufenden Studien zu CAR-T-Zellen finden derzeit bei soliden Tumoren statt, und die Zahl wächst rasch. Ein wesentlicher Teil dieser Studien testet die lokale Anwendung in Körperhöhlen oder die intratumorale Applikation. Auch wenn die Entwicklung klinischen Erfolgs deutlich langsamer als bei CD19-positiven Neoplasien verläuft, deuten sich verfolgenswerte Ansätze an.
Europäische Forschung muss große Anstrengungen unternehmen, um zur Entwicklung v. a. in China, USA und Israel aufschließen zu können.
al., Engineered T Cells: The Promise and Challenges of Cancer Immunotherapy. Nat Rev Cancer 2016; 16 (9): 566-81