Eine komplett neue Therapieoption bei Kindern und Jugendlichen
Die bisher erfolgreichste Zelltherapie bei Kindern und Jugendlichen mit akuten Leukämien ist die allogene Stammzelltransplantation (SZT). Voraussetzung hierfür ist allerdings die Erreichung einer kompletten Remission vor einer SZT – unabhängig vom Spendertyp, der Stammzellart und der angewandten Strahlen-/Chemotherapie. Hier stellt die Anwendung von autologen chimären Antigen-Rezeptor-T-Zellen (CAR-T-Zellen) eine komplett neue Therapieoption dar. Es ist nicht mehr notwendig, dass ein Patient vor der Sammlung von eigenen Lymphozyten keine Leukämie aufweist, und es ist auch nicht mehr notwendig, dass Kinder und Jugendliche vor der Reinfusion der genetisch modifizierten Lymphozyten blastenfrei sind.
Dies wurde eindrucksvoll an einigen Kindern an der Universität Pennsylvania bewiesen, die eine therapierefraktäre akute lymphoblastische Leukämie (ALL) hatten und durch die Infusion von CAR-T-Zellen vorübergehend oder dauerhaft eine Remission erreichten.
In der Folge wurde in Phase-I- und -II-Studien der Stellenwert dieser neuen Therapie international untersucht – das St. Anna Kinderspital in Wien war als eines von sieben europäischen Zentren an der Zulassungsstudie beteiligt.
Wie es funktioniert – wichtige Komponenten
Anders als bei Erwachsenen kommen nur wenige Kinder und Jugendliche in der Erstbehandlung in eine therapieresistente Situation. Mehr als 90 % der Patienten sprechen auf moderne Chemotherapie an. Nach einem Rückfall, zum Teil nach SZT, oder bei einer Nonresponse auf Chemotherapie hat sich allerdings gezeigt, dass genetisch modifizierte autologe Zellen, die mit einem chimären Antigenrezeptor (CAR) ausgestattet werden, eine hervorragende neue Möglichkeit zur Leukämiebekämpfung sind.
Dies geschieht mithilfe viraler Vektoren, die die genetische Information für den CAR auf die T-Zellen übertragen und stabil in das Genom der T-Zellen inserieren. So wird auch bei Aktivierung und Teilung der T-Zellen die genetische Information für den CAR an die Tochterzellen weitergegeben.
CARs setzen sich aus einer extrazellulären Bindungsdomäne, einer Linkerregion („hinge“), einer Transmembrandomäne und einer intrazellularen Signalsequenz zusammen. Die Bindungsdomäne, ein Antikörperfragment, ist für das Erkennen der Leukämiezelle zuständig und bindet deren Oberflächenantigen. Die Transmembrandomäne sorgt für eine Verankerung und Präsentation des CAR auf der Oberfläche der T-Zellen.
Die zweite für die therapeutische Aktivität entscheidende Komponente ist die Signalsequenz, die nach Bindung des CAR an Tumorzellen für eine Aktivierung der T-Zellen sorgt. Unterschiedliche Signalsequenzen werden derzeit in den in klinischen Studien befindlichen CARs verwendet. Bei den CARs, die für Kinder zugelassen sind, handelt es sich um eine von 4-1BB abgeleitete Sequenz zusammen mit der Signaldomäne von CD3zeta. Die mittels CAR-Gentransfer modifizierten T-Zellen werden expandiert und nach Konditionierung der Patienten wieder reimplantiert. Die Konditionierung, die zumeist aus lymphodepletierender Chemotherapie (wie Cyclophosphamid und Fludarabin) besteht, führt zu einer Reduzierung der Anzahl der körpereigenen Immunzellen und schafft im Organismus des Patienten günstige Bedingungen für die Expansion der infundierten CAR-T-Zellen.
Erste klinische Erfolge mit Tisagenlecleucel
Für Kinder und junge Erwachsene, die an einer B-Zell-basierten ALL erkrankt sind und die auf Standardtherapie nicht mehr ansprechen, hat die CD19-spezifische CAR-T-Zell-Therapie von Novartis unter dem Handelsnamen Kymriah® kürzlich Marktzulassung in den USA und Europa erhalten.
In der Zulassungsstudie wurden Patienten mit refraktärer CD19-positiver B-ALL eingeschlossen, die zwischen 3 und 21 Jahre alt waren und mehr als 5 % leukämische Blasten im Knochenmark hatten. Ausschlusskriterien waren vorangegangene Anti-CD19-Therapien und isolierte ZNS-Rezidive.
Alle Patienten erhielten eine lymphodepletierende Chemotherapie mit Cyclophosphamid und Fludarabin und im Anschluss eine einmalige Infusion von Tisagenlecleucel.
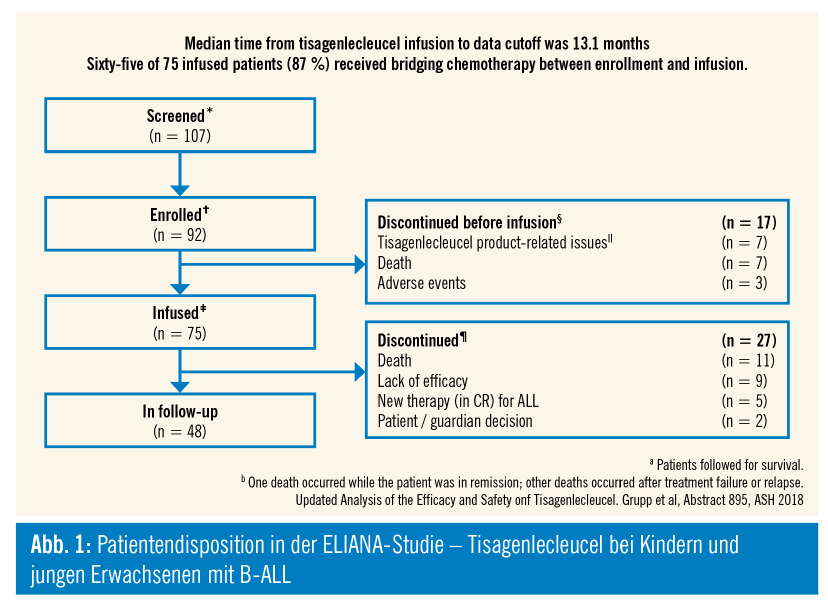
Das initiale Ansprechen auf die CAR-T-Zell-Therapie war hoch: 81 % der Patienten erreichten innerhalb von 3 Monaten eine komplette Remission. Danach erlitten 19 Patienten einen neuerlichen Rückfall, die meisten waren CD19-negativ.
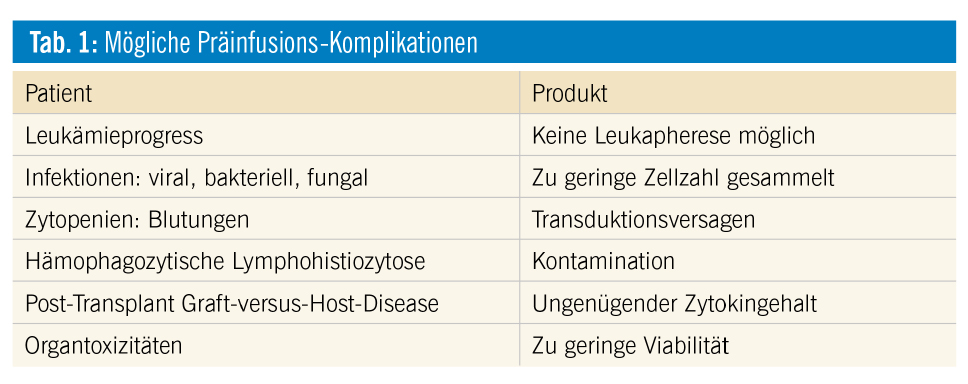
Der Zeitraum zwischen Leukapherese und der Reinfusion beträgt zwischen 4 und 16 Wochen und muss häufig mit einer weiteren Chemotherapie überbrückt werden. In dieser kritischen Phase kann es zu toxischen, aber vor allem zu schweren Infektionen kommen, manche Patienten versterben auch an der Leukämieprogression.
Nicht für alle Patienten ist es möglich, ein funktionierendes CAR-T-Zell-Produkt zu generieren. In manchen Fällen können nicht ausreichend Lymphozyten gesammelt werden, bei sehr kleinen Kindern ist eine Leukapherese nicht erfolgreich. Wenn nach einer allogenen SZT die Patienten noch immunsupprimiert sind, kann die Expansion der transduzierten Zellen nicht genügen, um eine ausreichende Zahl an CAR-T-Zellen zu infundieren.
Post-Infusions-Komplikationen
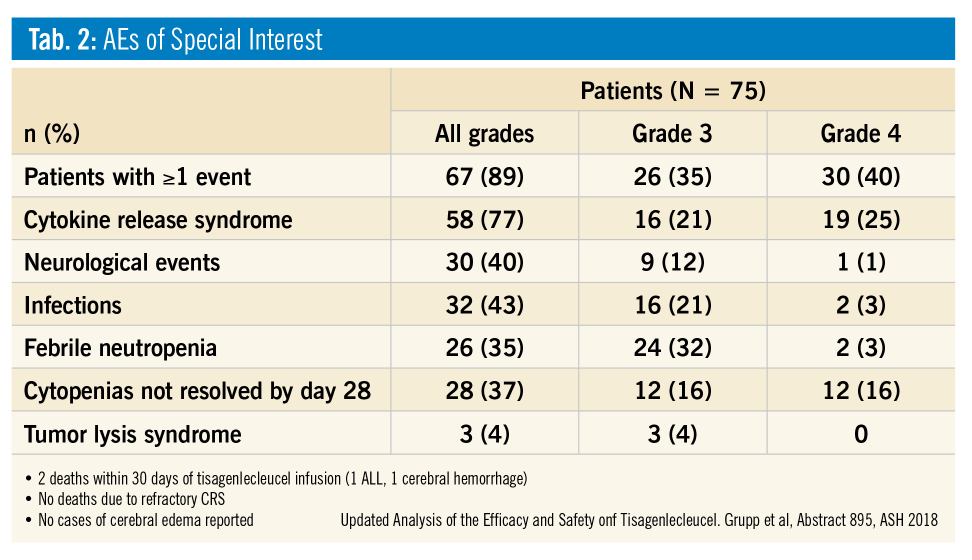
Die Reinfusion der CAR-T-Zellen führt – abhängig von der Leukämiezell-Last zum Zeitpunkt der Behandlung – aber auch durch die Persistenz von Virusinfektionen zu Entzündungsreaktionen, die durch die Freisetzung von inflammatorischen Zytokinen verursacht werden (Cytokine-Release-Syndrome, CRS). Die häufigsten Symptome sind Fieber, Flüssigkeitseinlagerungen in Geweben, Niereninsuffizienz/-versagen sowie manchmal lebensbedrohliche ZNS-Komplikationen (Hirnödem, Delier, „aseptische Enzephalitis“) und Makrophagen-Aktivierungs-Syndrom sowie Tumorlyse-Syndrom. Die meisten akuten Nebenwirkungen treten in den ersten 8 Wochen nach Infusion auf. Mit der Etablierung eines IL6-Rezeptor-Antikörpers (Tocilizumab) können die Symptome des schweren CRS gemildert werden. Der Einsatz von Corticosteroiden kann zu einer verringerten Wirkung der CAR-T-Zellen führen.
Eine weitere therapieassoziierte Komplikation sind langdauernde, z. T. persistierende Panzytopenien, ausgelöst durch die Erschöpfung der körpereigenen Stammzellreserven – v. a. bei lang und hoch vorbehandelten Patienten.
Zu den derzeit bekannten Langzeitnebenwirkungen gehören die persistierende B-Zell-Aplasie, die in Zukunft schwerwiegende Probleme für pädiatrische Patienten bedeuten könnte, da diese Gruppe keine Impfungen erhalten kann. Dadurch können schwere virale Infektionen auch lange nach der CAR-T-Zell-Verabreichung entstehen. Die meisten Patienten erhalten in regelmäßigen Abständen Immunglobuline substituiert, entweder intravenös oder subkutan. Auch über Autoimmunerkrankungen wie hämolytische Anämie, Nephritis, Thyreoiditis und andere wird berichtet.
Zusammenfassung
Derzeit ist Kymriah® das einzige für Kinder, Jugendliche und junge Erwachsene zugelassene CAR-T-Zell-Produkt zur Therapie der therapieresistenten akuten CD19-positiven B-ALL. Das initiale Ansprechen auf die Behandlung ist hoch, akute schwere Nebenwirkungen können durch erfahrene Teams in spezialisierten Einheiten meist beherrscht werden. Um in Zukunft Leukämierezidive effektiver verhindern zu können, werden derzeit zahlreiche Therapieverbesserungen untersucht, z. B. der Einsatz von kombinierten CAR-T-Zellen (CD19 + CD22), humanisierten CAR-T-Zellen, allogenen CAR-T-Zellen oder adaptiven Zellen. Die dezentrale Produktion von CAR-T-Zellen wird das Intervall zwischen Leukapherese und Infusion verkürzen. Darüber hinaus wird der Einsatz dieser Zellen in einem früheren Krankheitsstadium Hoffnung auf weitere Verbesserungen bringen. Um diese neuen Therapiemodalitäten effektiv zu untersuchen und zu nutzen, sind internationale Kooperationen im Rahmen von prospektiven Studien unerlässlich.