COVID-19 und Lunge
Infektiosität Aerosol und klinischer Verlauf
Aerosol (Airborne)- und Tröpfcheninfektion sind für die Infektion mit dem COVID-19-Virus verantwortlich. Aerosole bestehen aus dispers in der Luft verteilten festen oder flüssigen Bestandteilen.
Um diese in einer zur Infektion mit dem Virus führenden Menge aufzunehmen, sind verschiedene Faktoren erforderlich. Neben räumlicher Nähe zwischen Keimausscheider und Rezipient muss eine nennenswerte Viruslast des durch die Atmung und ggf. Husten entstehenden Bioaerosols übertragen werden und auch eine gewisse Expositionsdauer ist nötig. Bestandteile eines solchen Bioaerosols sind üblicherweise zwischen 0,3 µm und 100 µm groß. Aerosole geringerer Partikelgrößen verteilen sich eher in der Umgebungsluft, während sich jene mit Partikelgrößen über 5 µm an Oberflächen ablagern. Speicheltröpfchen und Expektorat und Aerosole um die 100 µm breiten sich normalerweise in einem Radius von 1–2 Metern aus. Im Unterschied dazu können sich kleine Aerosole bis 10 µm jedoch bis zu Hunderte von Metern ausbreiten. Für MERS, SARS, H1N1 und speziell Masern ist eine solche Ausbreitung über größere Distanzen beschrieben. Bei COVID-19 scheint aber eine Aerosolexposition im Nahbereich oder eine direkte Tröpfcheninfektion nötig zu sein. Beispielsweise Singen im Chor oder länger andauernde engere Kontakte, längere Besprechungen ohne nötige Distanz ect. haben nachgewiesenermaßen zu Infektionsclustern geführt.
Bei Aerosolen scheint die höchste Ansteckungsgefahr für COVID-19 in der Frühphase der Erkrankung präsent zu sein, da die Virusausscheidung schon 1–3 Tage vor Symptombeginn stattfindet und ihren Peak bei Erkrankungsbeginn hat. Deshalb werden etwa 40–80 % der Transmissionen durch a- oder präsymptomatische Personen verursacht. Husten und Niesen sind zur Transmission allerdings nicht notwendig.
Händewaschen und das Tragen von Masken können vor allem in dieser Frühphase der Erkrankung die Aerosol- und Tröpfchen-basierte Übertragung vermindern. Ma et al. verglichen die Wirksamkeit von Händewaschen bei verschiedenen Chlorin-Konzentrationen sowie unterschiedlichen Arten von Masken und stellten fest, dass bereits durch Händewaschen mit Seife über 96 % der Viren von den Händen entfernt wurden. Bei den Masken blockierten bereits einfache Stoffmasken über 95 % der Aerosole und medizinische Masken sogar über 99 %. Das Tragen von Masken und regelmäßiges Händewaschen sowie soziale Distanz können also dazu beitragen, die exponentielle Verbreitung des Virus einzuschränken. Diese Maßnahmen haben auch in Österreich funktioniert.
Zum Tragen von Masken scheinen auch epidemiologische Daten wertvolle Informationen beitragen zu können. Wie Chen et al. berichten, empfahl Taiwan sehr früh in der Pandemie die Verwendung von Masken, während Singapur dies erst später in der Pandemie tat. Am 3. 4. 2020 wurden in Taiwan 348 COVID-19-Fälle verzeichnet (1,46/100.000), in Singapur 1.114 (19,07/100.000). Masken helfen, die Übertragung von Aerosolen von infizierten Personen und vor allem die präsymptomatische Übertragung zu verringern.
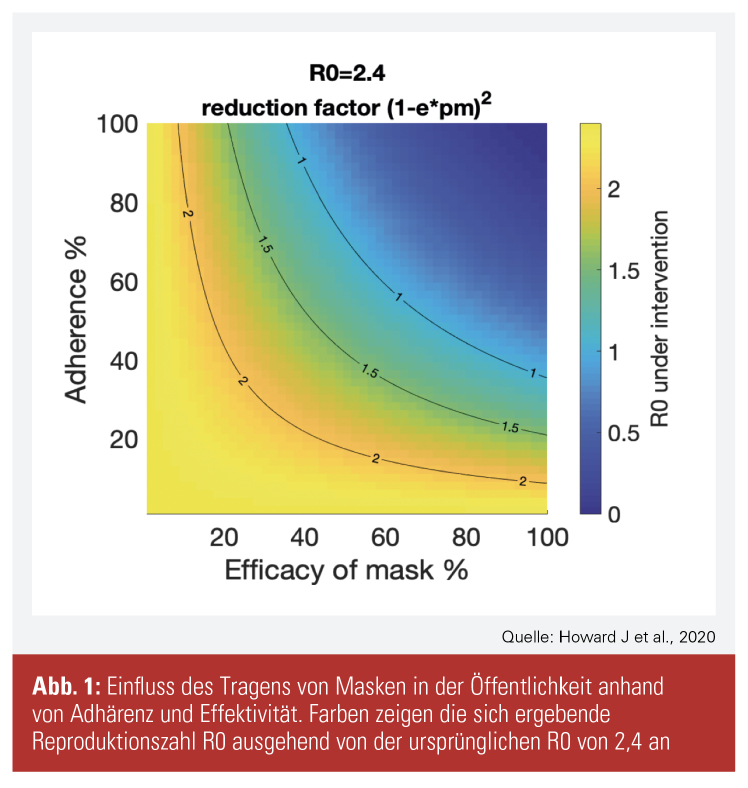
Ein epidemiologisches Modell, das ebenfalls für einen positiven Einfluss des Tragens von Masken in der Öffentlichkeit spricht, wird in Abbildung 1 dargestellt (Howard J et al., 2020). Die Reproduktionszahl für COVID-19 wird mit einem R0 von 2,4 geschätzt. Das Ziel von gesundheitspolitischen Maßnahmen ist, diese Reproduktionszahl auf unter 1,0 zu reduzieren. Bei einer Adhärenz von 50 % und einer Effektivität der Masken von 50 % würde die Reproduktionszahl R0 auf 1,35 sinken, was bereits eine signifikante Verringerung der Ausbreitung bedeutet: Bei 100 Fällen zu Monatsbeginn wären bei einer R0 von 2,4 zu Monatsende 31.280 Fälle zu erwarten, bei einer R0 von 1,35 nur 584 Fälle. Je höher die Adhärenz und die Effektivität der Masken, desto einfacher kann also die Reproduktionszahl auf unter 1,0 reduziert werden.
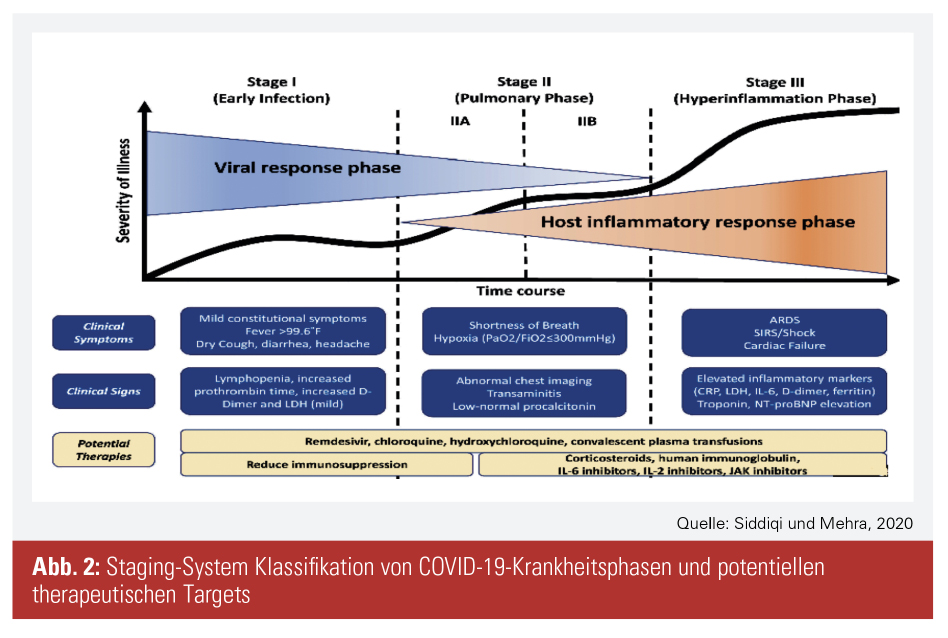
Staging-System: Siddiqi und Mehra empfehlen ein Staging-System für COVID-19-Infektionen, das aus drei Phasen besteht (Abb. 2). In Phase 1, der frühen Infektion, kommt es zur Manifestierung der Krankheit und Symptomen wie Fieber und trockenem Husten. Falls ein anti-virales Medikament sich als hilfreich herausstellt, könne es in dieser Phase die Dauer der Symptome verringern und eine Progression der Schwere der Erkrankung verhindern. In Phase 2 kommt es zu Virus-Multiplikation und lokalisierter Inflammation in der Lunge. Wenn es hierbei auch zu einer Hypoxie kommt, wird möglicherweise eine Atemtherapie benötigt, weswegen anti-inflammatorische Therapien wie etwa Kortikosteroide in Erwägung gezogen werden sollten. Ein kleiner Teil der Patienten geht in die dritte Phase über, in der es zu einer extra-pulmonalen systemischen Hyperinflammation kommt. Die Therapie sollte sich in dieser Phase darauf konzentrieren, die systemische Inflammation zu verringern, bevor sie in einem Multiorganversagen resultiert. Diese Punkte müssen bedacht werden, wenn über Versorgung von Patienten mit hypoxischem Lungenversagen durch COVID-19 diskutiert wird.
Atemhilfen bei hypoxischem Lungenversagen
Bei COVID-19-Patienten ist auffällig, dass bei schlechter Oxygenierung die empfundene Atemnot häufig geringer ist und sich aber in dieser Phase nach 7–10 Tagen Krankheit rasch ein intubationspflichtiges ARDS entwickeln kann. Bei klinischer Verschlechterung nach einer Woche in Heimquarantäne muss der Patient jedenfalls genauestens ärztlich kontrolliert werden und gegebenenfalls rasch an eine Klinik überwiesen werden. Im frühen ARDS hat sich die nicht-invasive Ventilation (NIV) bewährt. Gerade hämatologische Patienten erkranken während einer immunsuppressiven Phase durch Chemotherapie häufig an Pneumonien mit hypoxischem Lungenversagen. Wir hatten in dieser Gruppe durch frühen Einsatz der NIV gute klinische Ergebnisse und konnten in ca. 50 % eine Intubation verhindern. Es ist wahrscheinlich, dass COVID-19-Patienten ebenfalls von einer NIV profitieren, allerdings ist bis zur Viral Clearence diese an Normalstationen nicht empfohlen. Obwohl die Dispersion ausgeatmeter Luft bei nicht-invasiver Ventilation durch verschiedene Interfaces/Filter eingeschränkt ist, haben nicht alle Krankenhäuser Zugang zu solchen Interfaces bzw. ausreichende Schutzausrüstung zur Verfügung, um solche aerosol-generierenden Prozeduren durchzuführen. Derzeit wird der Einsatz nicht-invasiver Ventilation bei COVID-19 in der Literatur allerdings kontrovers beurteilt.
Es kann aber schwerlich sinnvoll sein, Patienten, die einen Bedarf an nicht-invasiver Beatmung haben, diese aufgrund einer allgemeinen Infektionsgefahr vorzuenthalten.
In einer rezenten Publikation wurde die NIV-Helmbeatmung empfohlen, da sie ein geschlossenes System darstellt und auch virale Filter integriert werden können.
Komorbiditäten und Verlauf
COVID-19-Patienten mit Komorbiditäten haben ein höheres Risiko für schwere Krankheitsverläufe und die Anzahl der Komorbiditäten korreliert mit einem schlechteren Outcome. Daten aus China zeigen, dass 25,1 % der Patienten mindestens eine Komorbidität aufweisen und 8,2 % an zwei oder mehr Begleiterkrankungen leiden. Am häufigsten kam hierbei Hypertonie vor (16,9 %), gefolgt von Diabetes (8,2 %).
Einige Komorbiditäten konnten als Risikofaktoren für das Überleben identifiziert werden, dazu zählen COPD (Hazard Ratio [HR] = 2,68), Diabetes (HR = 1,59), arterielle Hypertonie (HR = 1,58) und maligne Erkrankungen (HR = 3,5).
89 % der in Österreich verstorbenen Patienten waren über 74 Jahre alt, sodass sowohl altersbedingte Komorbiditäten, aber auch ein insuffizientes Immunsystem als Ursache angenommen werden können. Wir haben an unserer Abteilung die Komorbiditäten von 900 CLL-Patienten untersucht und hier war in der unter und über 65-jährigen Gruppe zwar eine erhöhte Komorbiditätsrate erkennbar, aber diese war bei weitem nicht so stark unterschiedlich, dass die Komorbiditäten alleinige Ursache dieses Unterschiedes in der Mortalität sein können, sondern der funktionelle Zustand der Organe und des Immunsystems eine Rolle spielen müsste.
Differentialdiagnostik: Angesichts der hohen Zahl zirkulierender Atemwegsviren ist die Differenzierung von COVID-19 von anderen Erregern, insbesondere der Influenza-, RS-Viren, wichtig und erfolgt hauptsächlich anhand von Proben aus dem oberen (nasopharyngeal) oder unteren (induziertes Sputum, endotracheale Aspirate, bronchoalveoläre Lavage) Atemtrakt für die Reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR) und bakterielle Kulturen zum Ausschluss begleitender Infektionen.
Sterblichkeit: Während die Mortalität unter infizierten Patienten generell mit zwischen 0,5 % und 4,1 % publiziert wurde, ist sie bei jenen Patienten, die einen Krankenhausaufenthalt benötigen, zwischen 5 % und 15 %. Bei Patienten, die kritisch erkranken, gibt es derzeit eine noch breitere Streuung zur Angabe der Sterblichkeit, die in der frühen Hubei-Provinz-Fallserie zwischen 22 % und 62 % liegt. Es muss auch die Anzahl an nosokomialen Infektionen generell berücksichtigt werden, die in Italien und Spanien deutlich höher ist als in Deutschland und Österreich (siehe Einleitung). Besonders die Mortalität der Tubus-assoziierten bakteriellen Infektionen könnte in diesen Ländern höher sein.
Schneller Progress zu ARDS
Das klinische Spektrum der Symptomatik der COVID-19-Infektion reicht von asymptomatischen Trägern über lediglich milde Symptome zeigenden Patienten bis hin zu schweren und kritischen Verläufen mit hypoxischem Lungenversagen. Bisherige Daten lassen annehmen, dass Patienten mit Dyspnoe, hohem Alter (> 60 Jahre) oder zusätzlichen Komorbiditäten genauer beobachtet werden sollten, da es hier zur schnellen Progression bis zu akutem respiratorischem Versagen (ARDS) kommen kann. In den letzteren Fällen ist intensivmedizinisches Monitoring unter Beatmungsbereitschaft angezeigt. Eventuelle Begleitinfektionen dürfen nicht übersehen werden.
Etwa 10 % der Patienten auf der Intensivstation benötigen aufgrund eines Lungenversagens extrakorporale Membranoxygenierung (ECMO) und die 28-Tage-Sterberate lag bei jenen Patienten, die ein ARDS entwickelten, bei 74 %.
COVID-19 verursacht häufig bilaterale Pneumonien, was konsekutiv zu rapider Verschlechterung der Lungenfunktion führt. Von den Patienten, die aufgrund des klinischen Zustandsbildes eine Intensivbetreuung benötigen, entwickelt fast ein Drittel ein ARDS. Unter Beachtung der evidenzbasierten Behandlungsleitlinien für ARDS sollten konservative Flüssigkeitsstrategien, empirisch ein früher Antibiotika-Einsatz bei Verdacht auf bakterielle Koinfektion, lungenprotektive Beatmung, gegebenenfalls in Bauchlage, und bei Fehlen von Kontraindikationen eine etwaige Berücksichtigung der extrakorporalen Membranoxygenierung (ECMO) bei refraktärer Hypoxämie erwogen werden.
Septischer Schock und spezifische Organdysfunktionen wie akute Nierenfunktionseinschränkungen treten bei Patienten mit einer kritischen Krankheit im Zusammenhang mit COVID-19 in einem signifikanten Anteil auf und sind mit einer steigenden Sterblichkeit verbunden. Diesbezüglich gelten die Empfehlungen der intensivmedizinischen Gesellschaften für die Behandlung nach den verfügbaren evidenzbasierten Richtlinien.
ARDS Berliner Definition
Das akute respiratorische Lungenversagen (ARDS) ist eine Reaktion der Lunge auf exogene oder endogene schädigende Faktoren. Es gilt als potentiell vital bedrohliche Situation. Letztlich führt die Kaskade der ablaufenden pathophysiologischen Reaktionen (v. a. der diffuse Alveolarschaden) zu einer massiven Einschränkung der Oxygenierung. Begleitend tritt häufig ein Multiorganversagen im Rahmen der systemischen inflammatorischen Response (SIRS) auf. Als labormedizinischer Hinweis für einen ernsten Verlauf können das Auftreten einer ausgeprägten Lymphozytopenie (mit oder ohne Leukozytopenie), Eosinophilie, erhöhte proinflammatorische Marker (z. B. CRP, D-Dimer) und eine hohe LDH gesehen werden.
Bei der Berlin-Definition des ARDS müssen zunächst sowohl klinische, radiologische und atemmechanische Befunde berücksichtigt werden sowie der Horovitz-Quotient: Der Horovitz-Quotient dient der Komplettierung der Diagnose eines ARDS und zur Einteilung des Schweregrads. Dieser wird mittels des Quotienten aus PaO2 und FIO2 (= Oxygenierungsindex; gemessen immer bei PEEP ≥ 5 cm H2O) ausgedrückt:
- Grad 1 – mild: PaO2/FIO2 = 201–300 mmHg
- Grad 2 – moderat: PaO2/FIO2 = 101–200 mmHg
- Grad 3 – schwer: PaO2/FIO2 ≤ 100 mmHg
Histopathologische Veränderungen
Histopathologische Veränderungen in der Lunge, die mittels Biopsie von mit COVID-19 infizierten Patienten gewonnen wurden, zeigten diffuse alveoläre Schäden. Diese sind jedoch unspezifisch und könnten im Rahmen unterschiedlicher Erkrankungen auftreten, die ebenso in ein ARDS münden können. Die wesentliche Diagnostik ergibt sich aus der PCR und dem typischen CT.
Radiologische Veränderungen
Bei Durchführung einer Thorax-CT besteht angesichts des typischen Bildes bilateraler Veränderungen eine hohe Wahrscheinlichkeit, eine COVID-19-Infektion zu erkennen. Daher hat sich die CT als Standardmethode für eine schnelle klinische Verdachtsdiagnose von COVID-19 weitgehend etabliert. Dadurch ist noch vor Einlangen der spezifischen Testergebnisse eine frühe Detektion und Isolation der Betroffenen möglich. COVID-19 (SARS-2), SARS und MERS zeigen zwar radiologische Ähnlichkeiten, es wurden aber auch Unterschiede gefunden wie etwa eine höhere Häufigkeit multifokaler Betroffenheit in der Lunge.
Wenn gar nichts mehr geht: ECMO Tocilizumab (Ruxolitinib?) und Remdesivir
In einigen Fällen kann es notwendig sein, bei COVID-19-Infektion auf experimentelle Therapien zurückzugreifen wie etwa ECMO oder Tocilizumab. ECMO (extrakorporale Membranoxygenierung) wurde bereits bisher als Therapie bei ARDS verwendet und wird auch bei COVID-19-Fällen mit refraktärer Hypoxämie angewandt. Die meisten Studien aus China haben das klinische Outcome der ECMO-Therapien nicht angegeben, weshalb bisher auch nicht klar ist, ob für SARS-CoV-2-Patienten der Einsatz zu einer Verbesserung desselben geführt hat.
Unkontrollierte Hyperinflammation kann ein Faktor für die Schwere des Krankheitsverlaufs bei COVID-19 sein und es stellt sich die Frage, ob Immunsuppression eine positive Wirkung darauf haben könnte. Metha et al. verweisen etwa auf Tocilizumab, einen IL-6-Rezeptor-Blocker, der hierfür eingesetzt werden könnte. Laut den Autoren sollten COVID-19-Patienten auf Hyperinflammation gescreent werden, um Patienten zu identifizieren, die von einer Immunsuppression profitieren könnten. Dieses Bild ist einer hämophagozytischen Lymphohistiozytose nicht unähnlich. Allerdings ist es auch möglich, dass nicht die Hyperinflammation per se fatal ist, sondern eine erhöhte unkontrollierte Viruslast bei Immunschwäche diese Inflammation antreibt und Immunsuppression einen negativen Effekt haben könnte (Ritchie und Singanayagam, 2020). Es muss also abgewogen werden, ob ein Patient immunsuppressiv behandelt werden soll, um die Inflammation zu reduzieren, oder ob es wichtiger ist, die Viruslast zu verringern. Auch Ruxolitinib könnte diese HLH-ähnlichen Inflammationsreaktionen eindämmen. Wir haben bei HLH dieses Medikament bereits erfolgreich eingesetzt.
Remdesivir: In einer rezenten Studie wurde 61 Patienten mit COVID-19-Infektion im Rahmen eines compassionate use-Programms Remdesivir verabreicht. Von diesen Patienten konnten 53 analysiert werden. Bei 68 % konnte nach Therapiebeginn eine Verbesserung der Oxygenierung beobachtet werden. Bei den intubierten Patienten war eine Mortalität von 18 % während der Behandlung zu beobachten, bei den nicht-invasiv beatmeten eine Mortalität von 5 %, was verglichen mit der publizierten Mortalitätsrate von etwa 60 % sehr niedrig ist. Eine klare Empfehlung kann aber erst abgegeben werden, wenn randomisierte Studien publiziert wurden.
Mortalitäts- und Neuinfektionsraten
Die publizierten Todesraten der Covid-19-Infizierten, die sich aus der Anzahl der nachgewiesenen Infektionen und Verstorbenen berechnen, reichten in verschiedenen Ländern am 31. 3. 2020 von 1,1 % in Deutschland bis 11,7 % in Italien, was eine hohe Variabilität der Infrastruktur oder der Detektionsraten vermuten lässt. Es ist jedoch unwahrscheinlich, dass sich die wahre, vom Virus verursachte Todesrate in den Ländern so stark unterscheidet. Speziell die Todeszahlen in Bezug auf nachgewiesene Infektionen sind jedoch eine schlechte Maßzahl für eine verlässliche Todesratenangabe bei einer unklaren Anzahl Infizierter.
Während die aktuelle Infektionsrate schwer abzuschätzen ist, ist die Dunkelziffer von Personen, die mit COVID-19-Infektion sterben, gering. Bommer und Vollmer versuchten deshalb, mittels Todesraten Schätzungen für die Infektionsrate anzustellen. Als Grundlage für die Berechnung der Todesraten verschiedener Länder verwendeten sie altersspezifische Schätzungen einer rezenten Publikation mit Daten aus China. Aufgrund der umfangreichen Testungen und des Monitorings dieser Patienten ist eine Unterschätzung der Todesrate bei diesen Patienten unwahrscheinlich.
Diese Todesrate wurde dann für andere Länder bezüglich der Altersverteilungen korrigiert, woraus sich für Deutschland, Italien und Österreich die in Tabelle 1 in der zweiten Zeile abgebildeten Werte ergaben.
Da die durchschnittliche Zeit zwischen Auftreten der Symptome und Tod 18 Tage beträgt und man annimmt, dass Personen etwa vier Tage nach Auftreten der Symptome getestet werden, versuchten die Autoren, eine Schätzung für die Anzahl der Infizierten am 17. 3. zu erstellen, indem sie aus der Anzahl der Verstorbenen am 31. 3. rückrechneten.
Die Anzahl der bestätigten Fälle am 17. 3. ist in den meisten Ländern jedoch niedriger, als die Anzahl der Toten am 31. 3. erwarten lassen würde.
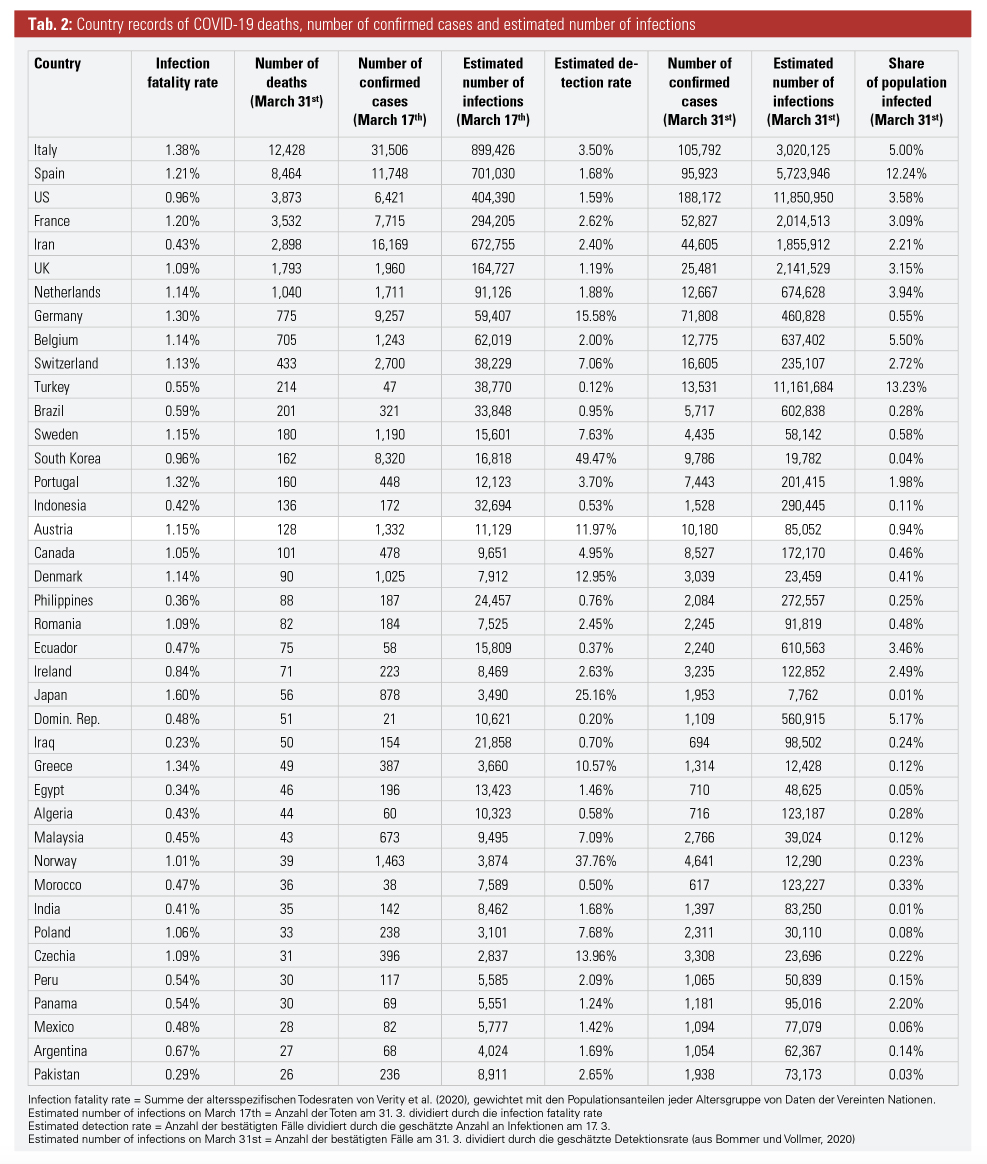
In Tabelle 2 (übernommen aus Bommer und Vollmer, 2020) werden einige Werte für verschiedene Länder geschätzt. Folgende Werte wurden hierbei berechnet:
Infection fatality rate = Summe der altersspezifischen Todesraten von Verity et al. (2020), gewichtet mit den Populationsanteilen jeder Altersgruppe von Daten der Vereinten Nationen
Estimated number of infections on March 17th = Anzahl der Toten am 31. 3. dividiert durch die infection fatality rate.
Estimated detection rate = Anzahl der bestätigten Fälle dividiert durch die geschätzte Anzahl an Infektionen am 17. 3.
Estimated number of infections on March 31st = Anzahl der bestätigten Fälle am 31. 3. dividiert durch die geschätzte Detektionsrate.
Für Österreich liegt die von Bommer und Vollmer nach Verity et al. geschätzte Todesrate bei 1,15 %. Die geschätzte Anzahl an Infektionen am 17. 3. ergibt sich aus der Division der bestätigten Todesfälle am 31. 3. (128) durch die geschätzte Todesrate (0,0115). Damit ist die geschätzte Anzahl an Infektionen am 17. 3. mit circa 11.000 um ein Vielfaches höher als die bestätigte Anzahl vom 17. 3. (1.332). Daraus lässt sich eine Detektionsrate in Österreich von gerade einmal 11,97 % errechnen (Anzahl der bestätigten Fälle am 17. 3. dividiert durch die geschätzte Anzahl am 17. 3.).
Weiters kann die geschätzte Anzahl der Infektionen am 31. 3. berechnet werden, indem die bestätigte Anzahl am 31. 3. (10.180) durch die geschätzte Detektionsrate (0,1197) dividiert wird. Am 21. 4. gab es in Wien 21 bestätigte Neuinfektionen mit COVID-19.
Geht man von der früher beschriebenen Detektionsrate von 11,97 % aus, wären jedoch 177 Neuinfektionen an diesem Tag wahrscheinlich. Die Infection fatality rate von 1,15 % ist damit in 2 Wochen am 3. 5. circa 2, jedenfalls mit einer Anzahl im einstelligen Bereich an COVID-19 verstorbenen Patienten ist zu rechnen.
Alle diese Modelle sind jedoch nur eine grobe Orientierungshilfe für die Einschätzung der Situation.
Koautoren:
Prim. Priv.-Doz. Dr. Bernd Lamprecht
Klinik für Lungenheilkunde, Kepler Universitätsklinikum Linz
OA Dr. Michael Fillitz
Hämato-Onkologie und Innere Medizin, 3. Medizinischen Abteilung, Hanusch Krankenhaus, Wien
Robert Spörk, MSc.
Ludwig Boltzmann Institut für Hämatologie und Onkologie, Wien
Univ.-Prof. Dr. Peter Valent
Ludwig Boltzmann Institut für Hämatologie und Onkologie, Wien
Univ.-Prof. Dr. Thomas Staudinger
Intensivstation, Universitätsklinik für Innere Medizin I, Medizinische Universität Wien
Univ.-Prof. Dr. Florian Thalhammer
Klinische Abteilung für Infektionen und Tropenmedizin, Universitätsklinik für Innere Medizin I, Medizinische Universität Wien