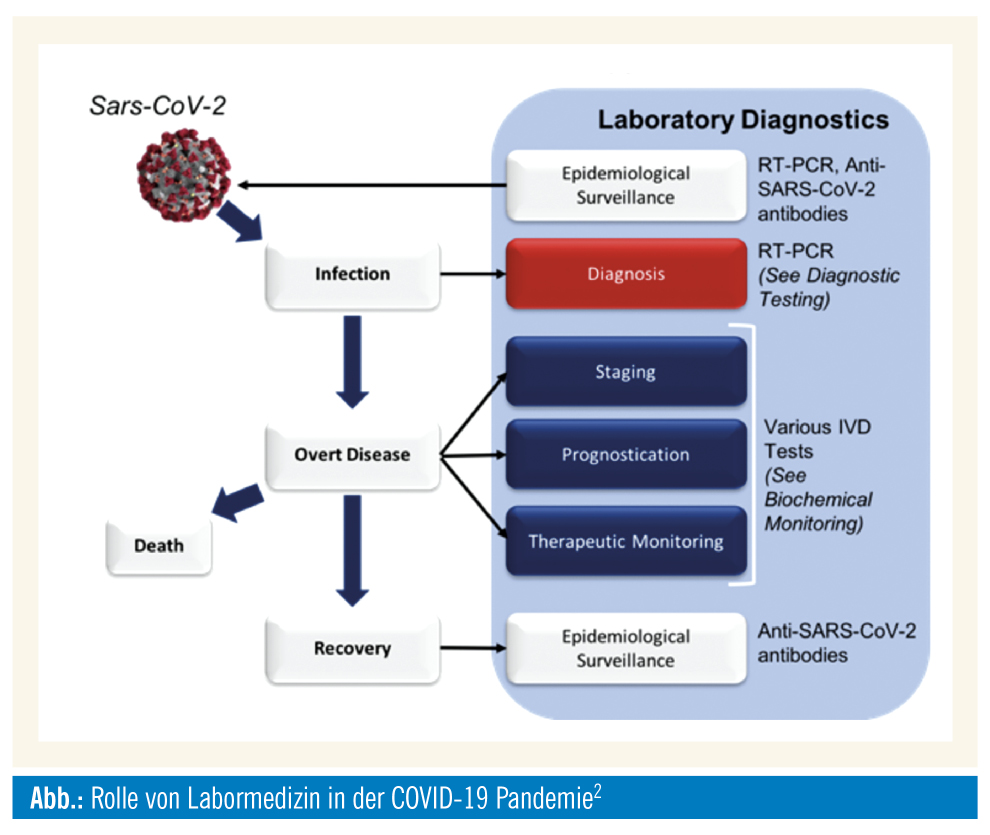
Labordiagnostik
Laborveränderungen
Bei Patienten mit COVID-19 finden sich im Routinelabor je nach Schweregrad der Erkrankung Anzeichen einer unspezifischen Entzündungsreaktion. So kann es sowohl zu einer Leukopenie als auch zu einer Leukozytose kommen, wohingegen eine Lymphopenie relativ oft zu beobachten ist1. Mehr als die Hälfte der Patienten mit COVID-19 präsentieren sich mit einem erhöhten C-reaktiven Protein. Daneben können auch Parameter wie die Laktatdehydrogenase, das Ferritin oder die Transaminasen erhöht sein. Im Gegensatz dazu wurde eine Abnahme des Gesamtcholesterins und des Serumalbumins in chinesischen Kohorten beschrieben3, 4. Ferner kann es im Rahmen der akuten Phase zu einer Aktivierung der Gerinnung kommen5, wobei die Höhe des D-Dimers mit der Mortalität assoziiert ist6 und der DIC-Score angewendet werden kann7. Procalcitonin ist bei besonders schweren Verläufen erhöht8, kann also bei weniger schweren Verläufen zur Differentialdiagnose einer bakteriellen Pneumonie herangezogen werden. Zur Abschätzung der Prognose wurden bisher der MuLBSTA-Score sowie der Charlson-Komorbiditätsindex für Viruspneumonien verwendet9, 10. Hierbei ist zu beachten, dass der MuLBSTA-Score zwar für virale Pneumonien verwendet wird, aber nicht spezifisch für COVID-19-Pneumonien validiert ist.
COVID-19 Diagnostik
Der Goldstandard für die Diagnose einer akuten Infektion mit SARS-CoV-2 ist der direkte Erregernachweis mittels Polymerase- Kettenreaktion (PCR)11, 12. Neben dem vom Referenzlabor für Coronavirus (Charité Berlin) entwickelten PCR-Nachweissystem13 stehen aktuell eine Reihe kommerzieller Testsysteme zur Verfügung14. Ein hohes Maß an Qualitätssicherung ist für valide und reproduzierbare Resultate in allen Untersuchungsphasen (Abstrich, Transport, Analytik) von entscheidender Bedeutung12. Da die verwendeten PCR-Testsysteme z. T. unterschiedliche Gensequenzen von SARS-CoV-2 detektieren, unterscheiden sich die Tests hinsichtlich ihrer Sensitivität und Spezifität. Allerdings kann laut einer aktuellen Studie von einer hohen Sensitivität ausgegangen werden13.
Probenmaterial für die PCR-Diagnostik zum Erregernachweis15: Bei Verdacht auf das Vorliegen einer Infektion mit dem neuartigen Coronavirus (SARS-CoV-2) sollten je nach klinischer Situation möglichst Proben parallel aus den oberen (Nasopharynx-Abstrich oder -Spülung, Oropharynx-Abstrich) und tieferen Atemwegen (bronchoalveoläre Lavage, Sputum, Trachealsekret) entnommen werden. Für Hinweise zur korrekten Durchführung der Probenentnahme wird auf WHO-Dokumente verwiesen16, 17.
Verpackung und Versand15: Klinische Proben von Verdachtsfällen zum Nachweis von SARS-CoV-2 sind als „Biologischer Stoff, Kategorie B“ der UN-Nr. 3373 zuzuordnen und nach Maßgabe der Verpackungsanweisung P650 zu verpacken. Die Verpackung besteht aus 3 Komponenten, Primär- (Probengefäß), Sekundär- (flüssigkeitsdicht verschraubtes Schutzgefäß), Außenverpackung (kistenförmige Verpackung), die oft kommerziell erhältlich sind. Der Versand sollte, wenn möglich, gekühlt erfolgen.
Indikationen
- Bei symptomatischen Personen entsprechend den Empfehlungen des Robert Koch Instituts18 und der WHO17.
- Differentialdiagnostische Abklärung, wenn ein klinischer Verdacht besteht aufgrund von Anamnese, Symptomen oder Befunden, die mit einer COVID-19-Erkrankung vereinbar sind und eine Diagnose für eine andere Erkrankung fehlt, die das Krankheitsbild ausreichend erklärt.
- Von einer Testung von asymptomatischen Personen wird aufgrund der unklaren Aussagekraft eines negativen Ergebnisses und zur Schonung von Testkapazitäten grundsätzlich abgeraten.
Ein negatives PCR-Ergebnis schließt die Möglichkeit einer Infektion mit SARS-CoV-2 nicht vollständig aus. Falsch-negative Ergebnisse können z. B. aufgrund schlechter Probenqualität, unsachgemäßem Transport oder ungünstigem Zeitpunkt (bezogen auf den Krankheitsverlauf) der Probenentnahme nicht ausgeschlossen werden. Wenn ein Patient mit begründetem Verdacht auf SARS-CoV-2-Infektion in der initialen PCR negativ getestet wird, wird eine erneute Probenentnahme und -untersuchung empfohlen18.
Zusätzlich sollten die Proben differentialdiagnostisch auch auf andere in Frage kommende Erreger untersucht werden15.
Rezente Daten aus Deutschland weisen darauf hin, dass die Infektiosität von SARS-CoV-2 zu Beginn der Erkrankung am höchsten ist19. Aufgrund der Ähnlichkeit zum ursprünglichen SARS-Virus ging man zunächst von einer ähnlichen Transmissionsrate und einem primären Befall der tiefen Atemwege aus. Es konnte jedoch gezeigt werden, dass sich das neue SARS-Coronavirus in Bezug auf das betroffene Gewebe stark vom ursprünglichen SARS-Virus unterscheidet, was auch eine leichtere Übertragbarkeit erklären würde. Im Gegensatz zu dem ersten SARS-Virus, welches die höchste Virusausscheidung erst 7 bis 10 Tage nach Erkrankungsbeginn erreicht, ist diese bei SARS-CoV-2 bereits zu Beginn hoch. Die Vermutung, dass die Infektion im oberen Respirationstrakt beginnt und sich infolge auf die unteren Atemwege ausbreitet, konnte durch den Nachweis von viraler mRNA bestätigt werden. Das hohe Ansteckungspotential, insbesondere für das medizinische Personal, könnte ebenfalls auf die hohe Virus-Last in respiratorischen Sekreten zurückzuführen sein.
In China konnte man bei Patienten, die von COVID-19 genesen waren, relativ lange Viren im Sputum oder Stuhl nachweisen20. Der Nachweis von viraler RNA in den Abstrichen erlaubt jedoch nur indirekte Hinweise auf die Ansteckungsfähigkeit. Durch den Nachweis von zytopathischen Effekten in Zellkulturen konnten lebende Viren in Abstrichen nachgewiesen werden19. Zwar war dies in der ersten Woche problemlos möglich (in 17 % der Abstriche und in 89 % der Sputumproben), jedoch waren nach dem 8. Tag keine lebenden Viren mehr nachzuweisen, obwohl die Virusgene weiterhin vorhanden waren. In den Stuhlproben konnten in keinem Fall lebende Viren detektiert werden, obwohl die Virusgene dort in hoher Konzentration nachweisbar waren.
Die Autoren gehen davon aus, dass sich die Viren zwar im Gastrointestinaltrakt replizieren können, eine Transmission über die Faeces jedoch fraglich bis unwahrscheinlich ist, da der Virus im Labor aus den Faeces nicht mehr nachgezüchtet werden kann. Im Urin oder Blut konnte keine virale RNA nachgewiesen werden. Da intakte Viren erst ab einer Konzentration von 105 Kopien des Virus-Erbguts detektierbar sind, könnte eine quantitative Bestimmung der Virusgene im Abstrich zur Einschätzung der Infektiosität bei den Patienten eingesetzt werden19.
Pool-Testen von SARS-CoV-2
Um die Testkapazitäten weltweit zu erhöhen, könnte das Testen von Probenpools angewendet werden. Die Methode des Probenpoolings kam bereits zur Diagnose und Identifizierung anderer respiratorischer Viren erfolgreich zum Einsatz21, 22. Ob ein solcher Ansatz auch bei SARS-CoV-2 angewendet werden kann, muss noch untersucht werden. Auf jeden Fall könnte dadurch eine Erweiterung der Screening-Untersuchungen gerade für systemrelevante Berufsgruppen, wie z. B. das medizinische Personal, massiv unterstützt werden.
Antikörpertests
Es ist anzunehmen, dass bei COVID-19, so wie bei anderen viralen Infektionen auch, die virale RNA ab einem bestimmten Zeitpunkt nicht mehr verlässlich nachweisbar ist23. Mittels Antikörpertests können die Antikörper-Klassen IgG, IgM und IgA nachgewiesen werden. Klassischerweise kommt es bei den Infektionen zunächst zu einem signifikanten Anstieg der IgM- und IgA-Antikörper, während IgG-Antikörper erst später ansteigen. Interessanterweise konnte bei SARS-CoV-2-Infektionen ein früherer Anstieg von IgG-Antikörpern beobachtet werden19, 24.
Eine wichtige Voraussetzung für die Entwicklung eines zuverlässigen Antikörper-Tests ist sowohl eine hohe Spezifität als auch eine geringe Kreuzreaktivität gegenüber anderen humanen Coronaviren (HCoV-HKU1, HCoV-NL63, HCoVOC43 und HCoV-229E). Mit den ELISA-Techniken kann man jedoch keine Aussage über die Funktionalität der Antikörper treffen. Detektion von neutralisierten Antikörpern gegen SARS-CoV-2 gelingt in der Regel nur im Neutralisationstest.
Indikationen
- Rückverfolgung von Infektionsketten: Bisher nicht erkannte und bereits länger andauernde oder zurückliegende Infektionen könnten identifiziert werden und dementsprechende Maßnahmen eingeleitet werden25.
- Kriterien zur Entlassung der Patienten aus dem Krankenhaus26: In einer aktuellen Studie aus Deutschland entwickelte die Hälfte der Patienten bis zum 7. Tag nach Symptombeginn Antikörper gegen das Virus. Nach zwei Wochen fielen die Antikörper-Tests bei allen Patienten positiv aus19. Auf Basis dieser Daten schlagen die Autoren der Studie vor, dass COVID-19-Patienten bei knapper Bettenkapazität in die häusliche Quarantäne entlassen werden können, wenn sich nach dem 10. Tag der Erkrankung weniger als 105 Kopien der Viren- RNA im Sputum nachweisen lassen.
- Nachweis einer zurückliegenden Infektion27: Mit einem Antikörper-Test könnten die Gesundheitsbehörden in Serosurveys den Immunstatus der Bevölkerung erfassen. Im medizinischen Bereich könnten durch die Antikörper-Testung gezielt Ärzte und Pflegende mit positivem Antikörper-Test für die Betreuung von Patienten mit COVID-19 zur Verfügung gestellt werden. Dazu muss allerdings gesagt werden, dass die Testsysteme derzeit noch nicht alle hochspezifisch sind und es auch unklar bleibt, ob im Einzelfall immer auch eine komplette Immunität erworben wird.
- Epidemiologische Untersuchungen28: Mit den PCR-Tests lassen sich nur aktive Infektionen erkennen, wenn sich das Virus gerade im Körper vermehrt. Es ist allerdings davon auszugehen, dass viele Infektionen nicht bemerkt werden, weil der Verlauf asymptomatisch ist oder die Symptome als Zeichen einer anderen Erkrankung gedeutet werden.
- Ermittlung rekonvaleszenter Personen zur Behandlung einer aktiven Infektion: An einer Klinik in China haben 5 Patienten mit schwerer COVID-19 das Plasma von Menschen erhalten, die von der Krankheit genesen sind29. Obwohl positive Erfahrungen von einer SARS-Epidemie und Influenza A H1N1/2009 vorliegen, ist die Effektivität der Serumtherapie bei COVID-19 aufgrund der geringen Fallzahl nicht bestätigt. Für eine Wirksamkeit spricht allerdings, dass nach der Infusion des Plasmas bei den Patienten Antikörper-Konzentrationen gefunden wurden, die für eine Neutralisierung ausreichen sollten, und parallel die Viruslast bei den Patienten zurückging29.
- Diese Tests sind für immunsupprimierte Personen aufgrund mangelnder bzw. zu geringer Antikörperbildung kontraindiziert11.
Immunität
Erste Studien haben gezeigt, dass Personen nach durchgemachter SARS-CoV-2-Infektion spezifische Antikörper entwickeln30.
Aufgrund der Tierversuche an Rhesusaffen27, früheren Erkenntnissen zu SARS sowie Plausibilitäts- und Machbarkeitsannahmen bestehe für die Genese ein sehr geringes Reinfektionsrisiko. Die Erfahrungen mit anderen Coronavirus-Infektionen (SARS und MERS) deuten darauf hin, dass die Immunität bis zu drei Jahre anhalten könnte31. Wie regelhaft und dauerhaft ein solcher Immunstatus individuell aufgebaut wird, ist jedoch noch ungewiss, daher seien serologische Längsschnittstudien erforderlich, die die Immunität der Patienten über einen längeren Zeitraum untersuchen32.
iao SY et al. Evolving status of the 2019 novel coronavirus infection: Proposal of conventional serologic assays for disease diagnosis and infection monitoring. J Med Virol 2020; 92 (5): 464-7