Medikamentöse Therapie des metastasierten Nierenzellkarzinoms
Randomisierte Studien zur Erstlinientherapie
Mit Ausnahme von Sorafenib zeigten alle neuen Therapien in der Erstlinienbehandlung einen Vorteil in Bezug auf Ansprechrate und progressionsfreies Überleben (PFS) im Vergleich zu Interferonalpha oder Placebo (Tab. 1).
| Tab. 1: Randomisierte Studien zur Erstlinientherapie | |||
|---|---|---|---|
| Substanz | Komparator | ORR % | PFS Monate |
| Sunitinib1,2 | IFN-alpha | 47 vs. 12 | 11 vs. 5 |
| Bev+IFN3 | IFN-alpha | 31 vs. 12 | 10,2 vs. 5,4 |
| Bev+IFN4 | IFN-alpha | 26 vs. 13 | 8,5 vs. 5,2 |
| Sorafenib5 | IFN-alpha | 5.2 vs. 8,4 | 5,7 vs 5,6 |
| Pazopanib6 | Placebo | 32 (vs. 4) | 11,1 (vs. 2,8) |
| Tems7 | IFN-alpha* | 8.6 vs. 4,8 | 3,8 vs. 1,9 |
| * bzw. IFN-alpha+Temsirolimus 1 Motzer RJ, NEJM 2007; 2 Motzer RJ, J Clin Oncol 2009; 3 Escudier B, Lancet 2007; 4 Rini B, J Clin Oncol 2008; 5 Escudier B, J Clin Oncol 2009; 6 Sternberg CN, J Clin Oncol 2010; 7 Hudes G, New Engl J Med 2007 |
|||
Bedeutung moderner Therapien für die Prognose der Patienten
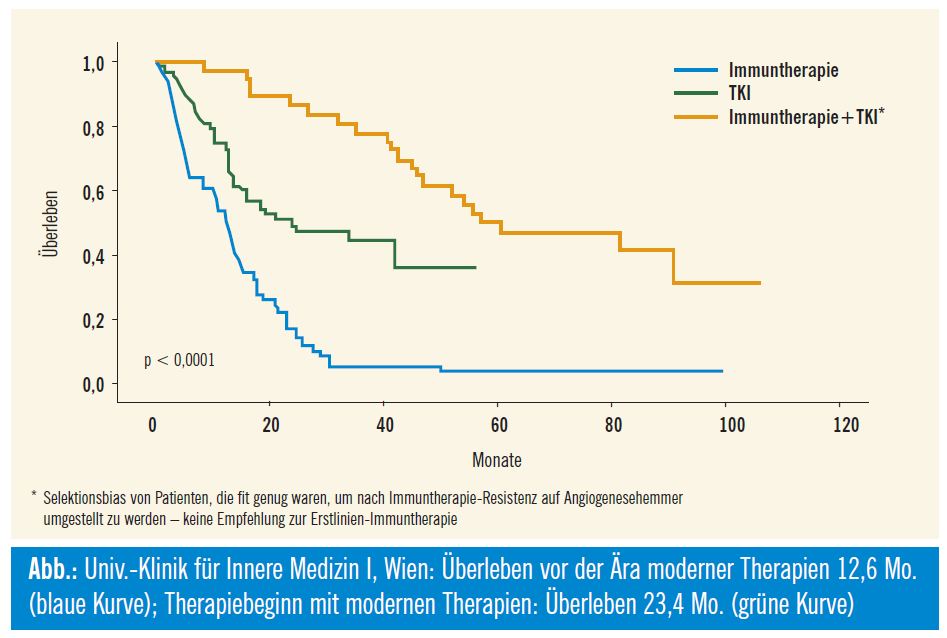
Ein statistisch signifikanter Vorteil in Bezug auf das Gesamtüberleben konnte in den Phase-III-Studien nicht demonstriert werden, da Post-Studien-Therapien und Crossover-Design der Studien diesen Effekt verfälschen. Ein großer Einfluss auf das Gesamtüberleben ist natürlich dennoch gegeben: In einer Metaanalyse konnten Delea und Kollegen zeigen, dass das PFS ein valider Studienendpunkt für die Bedeutung einer Nierenzellkarzinomtherapie ist: In dieser Analyse wurden Daten von 6182 Patienten erhoben, um den Therapieeffekt der Verbesserung des PFS und seine Bedeutung für das Gesamtüberleben zu untersuchen: demnach ist eine Verbesserung des progressionsfreien Überlebens von 1 Monat mit einer Verlängerung des Überlebens um 1,4 Monate assoziiert (Delea et al., ASCO 2009, Abstr. #5105). Noch deutlicher wird der Unterschied erkennbar, wenn man die Daten der eigenen Patienten, die man über Jahre betreut hat, analysiert: Patienten, die an der Universitätsklinik für Innere Medizin I, Wien, wegen eines Nierenzellkarzinoms noch in der Ära vor den modernen Therapien behandelt wurden, hatten ein medianes Überleben von 12,6 Monaten (95%-CI: 9,515,6), was dem internationalen Standard entspricht. Im Vergleich dazu haben Patienten, die von Beginn an mit modernen Therapien behandelt wurden (First Line mit Sunitinib oder Bevacizumab+IFN oder Sorafenib oder Sorafenib+Bevacizumab), ein medianes Überleben von 23,4 Monaten (95%-CI: 6,240,6) p < 0.0001 (Abb.).
Das in der Kurve dargestellte deutlich bessere Abschneiden jener Patienten, die zuerst noch Immuntherapie erhielten und nach erfolgter Progression auf Angiogeneseinhibitoren umgestellt wurden, ist ein Selektionsbias, da diese Population fit genug war, die Ära moderner Therapie zu erleben. Dies soll keinesfalls dazu veranlassen, Patienten in der Erstlinie mit Immuntherapie zu behandeln.
Je nach verwendeter Substanz kommt es nach einer medianen Therapiedauer von ca. 11 Monaten zur Progression der Erkrankung. Dies ist durch erworbene Resistenzmechanismen verursacht. Mehrere Faktoren sind vermutlich für diese Resistenzen verantwortlich:
-
Alternative proangiogenetische Pathways können aktiv werden (z.B. über den Fibroblasten-Wachstumsfaktor oder Angiopoietin).
-
Rekrutierung von Vorläuferzellen aus dem Knochenmark, aus denen Endothelzellen werden; dieser Prozess wird durch tumorassoziierte Makrophagen unterstützt.
-
Zunehmende Rekrutierung von Perizyten, die Endothelzellen strukturell unterstützen.
-
Migration der Tumorzellen aus den therapieinduzierten hypoxischen Arealen in Organe mit adäquater Oxygenierung.
Randomisierte Studien zur Zweitlinientherapie
Nach Versagen der Erstlinientherapien ist bislang nur eine Substanz, der orale mTOR-Inhibitor Everolimus, zugelassen. Diese Substanz hat in einer placebokontrollierten Phase-III-Studie bei Patienten, die auf Sunitinib und/oder Sorafenib progredient waren, einen klaren Benefit gegenüber Placebo gezeigt (PFS 4,9 vs. 1,9 Monate, HR: 0,30), Motzer RJ et al., Lancet 2008). Weitere Zweitlinientherapien sind derzeit Gegenstand klinischer Studien: z.B. wird der potente VEGF-Inhibitor Axitinib derzeit in einer randomisierten Studie im Vergleich zu Sorafenib bei Patienten geprüft, die auf Sunitinib progredient sind. Die Ergebnisse daraus werden im Juni 2011 erwartet. Auch FGF-Inhibitoren sind derzeit von besonderem klinischen Interesse.
Nach Versagen einer Zytokintherapie gelten Sorafenib oder Pazopanib als Standardtherapie (Tab. 2). Naturgemäß ist diese Population kaum mehr anzutreffen, da die meisten Patienten heute eine Erstlinientherapie erhalten, die auf VEGF-Inhibition beruht.
| Tab. 2: Randomisierte Studien zur Zweitlinientherapie | ||||
|---|---|---|---|---|
| Refraktär gegen | Substanz | ORR % | PFS (Monate) | HR |
| Zytokine | Sorafenib1 | 10 | 6 vs. 3 | 0,44 |
| Zytokine | Pazopanib2 | 29 | 7,4 vs. 4,2 | 0,54 |
| SUN/SOR | Everolimus3 | 1 | 4,9 vs. 1,9 | 0,30 |
| 1 Escudier B et al., New Engl J Med 2007; 2 Sternberg C et al., J Clin Oncol 2010; 3 Motzer RJ et al., Lancet 2008 | ||||
Nebenwirkungen moderner RCC-Therapien
Je nach verwendeter Substanz gibt es ein breites Spektrum an potenziellen Toxizitäten. Im Vordergrund der Anti-VEGF-TKI stehen Hypertonie (die mittlerweile ein anerkannter Biomarker für gutes Ansprechen ist), Diarrhoe, Fatigue, metabolische Störungen wie Hypothyreose (ebenfalls ein potenzieller Biomarker), Hyper- oder Hypoglykämien, Hauttoxizitäten, kardiale Toxizität und Stomatitis. mTOR-Inhibitoren können ebenfalls Hyperglykämien, aber auch Hyperlipidämien verursachen, und bei einer nicht unerheblichen Zahl von Patienten kommt es zu einer Pneumonitis, die als Typ-4-Hypersensitivitätsreaktion angesehen wird. Durch entsprechende prophylaktische Maßnahmen und frühzeitige spezifische supportive Therapien sind diese Nebenwirkungen sehr gut beherrschbar, sofern der behandelnde Arzt über ausreichend Erfahrung mit den jeweiligen Substanzen verfügt.
Dies ist insofern wichtig, als die Therapiedosis und Therapiedauer für den Therapieerfolg entscheidend sind. Ein Absetzen oder eine Dosisreduktion sollte daher so selten wie möglich und nur bei ausgewählten Patienten vorkommen.
Aus dem bisher Gesagten ergibt sich beim metastasierten Nierenzellkarzinom ein aktueller Therapiealgorithmus, der in Tabelle 3 dargestellt ist.
| Tab. 3: Therapiealgorithmus beim metastasierten Nierenzellkarzinom | |||
|---|---|---|---|
| Linie/Risiko | Erste Wahl | Option | |
| Erstlinientherapie | |||
| Gut/interm. | cc | Sunitinib oder Bev+IFN oder Pazopanib |
HD-IL-2 nur Studie |
| non-cc | Studie | Sunitinib | |
| Ungünstig | cc | Temsirolimus | Sunitinib |
| non- cc | Temsirolimus | Studie | |
| Zweitlinientherapie | |||
| Nach Zytokin | – | Sorafenib Pazopanib |
Sunitinib |
| Nach VEGFR-TKI | – | Everolimus | Studie oder anderer TKI |
| Nach Bev+IFN | – | Sunitinib? | Studie oder anderer TKI |
| cc = clear cell; Risiko: bezieht sich auf Motzer RJ, J Clin Oncol 2002, MSKCC Risikoklassifikation | |||
Die Qual der Wahl
Erstlinientherapie bei Patienten mit gutem oder intermediären Risiko: In der Erstlinientherapie stehen bei dieser Population 3 Optionen zur Verfügung. Derzeit laufende Studien versuchen, direkte Vergleiche zu ziehen. Bis etwaige Über- oder Unterlegenheiten der einen gegenüber der anderen Strategie bewiesen sind, kann keine generelle Empfehlung erfolgen. Welche Option tatsächlich zum Einsatz kommt, sollte vom individuellen Patientenprofil abhängig gemacht werden. Dabei sind Begleitmorbiditäten, individuelles Therapieziel (Remission, Lebensqualität) sowie Unterschiede im Toxizitätsprofil zu beachten.
Entwicklung des Therapiealgorithmus in den kommenden Jahren
Die sehr vorläufige Darstellung des aktuellen Therapiestandards wird sich in den nächsten Jahren unter Umständen erheblich verändern, da viele Fragen offen sind bzw. neue sehr wirksame Substanzen bereits in der Pipeline sind:
1. Sequenz: Noch ungeklärt ist, ob starke Kinaseinhibitoren wie Sunitinib oder Pazopanib zwangsläufig sofort zum Einsatz kommen müssen. Aus retrospektiven Analysen geht hervor, dass auch die Sequenz Bevacizumab+Interferon gefolgt von Sunitinib sehr wirksam sein kann. Einschränkend muss man an dieser Stelle natürlich festhalten, dass es sich um hypothesengenerierende Subgruppenanalysen handelt dennoch ist dieser Aspekt in randomisierten Studien zu überprüfen. Leider wird in den dazu laufenden Studien bislang kein sinnvoller Endpunkt gewählt. Der einzig sinnvolle Endpunkt einer Studie, welche die optimale Sequenz untersucht, muss das Gesamtüberleben sein. Hingegen werden bei derzeit durchgeführten Sequenzstudien neue, nicht validierte Endpunkte wie zweites PFS gewählt: Diese Studien werden demnach wenig Aussagekraft haben.
2. Rolle von Interferon-alpha: Unklar ist immer noch, ob man diese Substanz heute schon völlig abschreiben kann. Möglicherweise hat IFN-alpha eine Bedeutung nach oder während einer Anti-VEGF-Therapie. Experimentelle Analysen zeigen, dass Multikinaseinhibitoren die Zahl der regulatorischen T-Zellen reduzieren können, was ein Ansprechen auf eine nachfolgende IFN-Therapie optimieren könnte. Leider ist dieser interessante Ansatz derzeit nicht Gegenstand einer klinischen Prüfung.
3. Rolle von Sorafenib: Der Multikinaseinhibitor Sorafenib hat nach einer positiven Phase-III-Studie im Vergleich zu Placebo (bei zytokinrefraktären Patienten) in einer späteren randomisierten Phase-II-Studie keinen Vorteil gegenüber IFN-alpha in der Erstlinie gezeigt. Seither ist die Rolle von Sorafenib in der derzeitigen RCC-Population unklar. Das mögliche Potenzial dieser Substanz in einer höheren als der bisher verwendeten Dosierung wurde bislang nicht weiter untersucht, obwohl es dazu interessante Phase-II-Daten mit hohen Remissionsraten gibt (Amato RJ et al., ASCO 2008, Abstr. #5122 und ASCO 2007, Abstr. #5026).
4. Die interessanteste neue Therapie ist der Tyrosinkinaseinhibitor Tivozanib, der im niedrigsten (nanomolaren) Dosisbereich die höchste In-vitro-Inhibition der VEGFR-Tyrosinkinasen 1, 2, 3 erreicht. Mit dieser Substanz konnte bei therapienaiven, nephrektomierten Patienten ein progressionsfreies Überleben von 14,3 Monaten und eine Ansprechrate von 32% erreicht werden. Eine randomisierte Phase-II-Studie (vs. Sorafenib) wurde bereits initiiert, eine Phase-III-Studie (vs. Sunitinib) ist geplant. Tivozanib und Axitinib sind derzeit die potentesten VEGF-Signalweg- Inhibitoren (Bhargava et al., ASCO 2010, Abstr. #4599).
Ebenfalls zunehmend interessant werden Inhibitoren des Fibroblasten-Wachstumsfaktors in der Therapie des mRCC gesehen. Vor allem nach Versagen einer Anti- VEGF-Therapie scheint FGF einen alternativen proangiogenen Pathway zu vermitteln, wodurch sich mit diesen Substanzen in der Zweitlinientherapie neue Optionen eröffnen könnten.
5. Studien zur Kombinationstherapie werden zwar weiter durchgeführt, aber die ersten klinischen Ergebnisse waren in Bezug auf die Risiko-Benefit-Ratio eher enttäuschend.
6. Eine Empfehlung für die optimale Therapie des nichtklarzelligen Nierenzellkarzinoms kann nach wie vor nicht gegeben werden: Wenngleich Multikinaseinhibitoren und mTOR-Inhibitoren bis zu einem gewissen Grad wirksam sind, ist ein Durchbruch ähnlich wie bei den klarzelligen Karzinomen noch nicht in Sicht.
Fact-Box
-
Moderne Therapien haben die Prognose der Patienten mit Nierenzellkarzinom entscheidend verbessert.
-
Die richtige Anwendung der Therapie in Bezug auf Dosis und Therapiedauer erfordert große Erfahrung des behandelnden Arztes.
-
Der momentane Therapiealgorithmus sieht in der Erstlinie bei Patienten mit gutem oder intermediärem Risikoprofil Sunitinib oder Bevacizumab+IFN-alpha oder Pazopanib vor. Bei Patienten mit ungünstigem Risikoprofil gilt Temsirolimus als Standard. In der Zweitlinie nach Versagen eines VEGF-TKI ist Everolimus die Therapie der Wahl. Dieser Algorithmus kann sich in den kommenden Jahren aufgrund der derzeit laufenden und bereits geplanten Studien rasch verändern