NCIC-CTG-MA.27-Studie: Anastrozol vs. Exemestan – Erster „Head to Head“-Vergleich zweier Aromatasehemmer
Kontext
Anastrozol ist derzeit als primäre Therapie für postmenopausale Patientinnen nach hormonrezeptorpositivem Mammakarzinom registriert. Exemestan ist für das gleiche Patientengut als Folgetherapie zwei bis drei Jahren nach einer initialen Tamoxifen-Therapie zugelassen.
Obwohl beide Substanzen zu den Aromatasehemmern gerechnet werden, bestehen dennoch strukturelle und funktionelle Unterschiede. Exemestan ist ein steroidaler Aromatasehemmer, hemmt die Aromatase irreversibel und weist androgene Eigenschaften auf. Zudem soll Exemestan anders als Anastrozol nicht die Bildung von intratumoraler Aromatase induzieren.
Anastrozol hingegen hemmt als nichtsteroidaler Aromatasehemmer die Aromatase reversibel und weist keine androgenen Eigenschaften auf.
Aufgrund dieser unterschiedlichen Charakteristika wurde eine wirkungsvollere Unterdrückung der Östrogenproduktion zugunsten von Exemestan und aufgrund der androgenen Eigenschaften noch ein zusätzlicher antitumoraler Effekt postuliert. Ebenso wurde eine günstige Beeinflussung der Serumlipide und des Knochenstoffwechsels im Zusammenhang mit den androgenen Eigenschaften vermutet.
Studiendesign
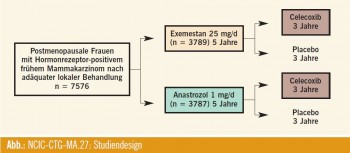
Die am SABCS 2010 präsentierte Studie war ein direkter Vergleich der Effektivität und Sicherheit beider Aromatasehemmer in der adjuvanten Therapie postmenopausaler hormonrezeptorpositiver Brustkrebspatientinnen. 7576 Patientinnen wurden zwischen Mai 2003 und Juli 2008 in die Studie eingebracht. Stratifiziert wurden die Patientinnen nach Lymphknotenbefall (positiv, negativ, unbekannt), nach adjuvanter Chemotherapie (ja, nein) und adjuvanter Gabe von Trastuzumab (ja, nein). Danach erfolgte die Randomisierung entweder in Exemestan 25 mg/d (3789 Patientinnen) oder Anastrozol 1 mg/d (3787 Patientinnen) für fünf Jahre (Abb.). In einer ursprünglichen zusätzlichen Randomisierung erhielten 1622 Teilnehmer entweder Celecoxib 400 mg zweimal täglich oder Placebo für drei Jahre. Diese letztgenannte Untersuchung wurde 2004 beendet, nachdem bei 59 Prozent der Patientinnen erhöhte Risikofaktoren für kardiale Erkrankungen aufgetreten waren.
Einschluss- und Ausschlussparameter: Es wurden Patientinnen in die Studie aufgenommen, die vor einer adjuvanten Chemotherapie bereits postmenopausal waren (älter als 55 Jahre und Amenorrhoe zumindest für 12 Monate, beidseitige Ovarektomie, 55 Jahre und jünger mit Amenorrhoe länger als 12 Monate und postmenopausaler Serumspiegel für FSH), bei denen ein rezeptorpositives invasives Mammakarzinom diagnostiziert war und die sich in einem guten Allgemeinzustand (ECOG _ 2) befanden. Ausschlusskriterien waren lokal fortgeschrittene oder metastasierte Mammakarzinome, eine gleichzeitige Therapie mit SERM oder eine gleichzeitige Hormonersatztherapie sowie eine vorangegangene Therapie mit Aromatasehemmern oder eine Therapie mit Raloxifen innerhalb der letzten drei Wochen. Zwei Drittel der Patientinnen hatten Tumoren kleiner als 2 cm und waren nodal negativ. Ein Drittel des Kollektivs hatte adjuvant eine Chemotherapie erhalten.
Studienziele
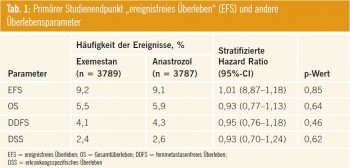
Als primärer Endpunkt wurde das ereignisfreie Überleben (EFS) definiert, sekundäre Studienziele waren u.a. das Gesamtüberleben (OS), das metastasenfreie Überleben (DDFS), zusätzlich wurde das Auftreten von Frakturen, kardiovaskulären Erkrankungen, Veränderungen der Brustdichte, Toxizitäten und die Lebensqualität ermittelt.
Ergebnisse
Die Ergebnisse dieser Studie wurden nach einem mittleren Nachbeobachtungszeitraum von 4,1 Jahren präsentiert. Das primäre Studienziel, das ereignisfreie Überleben, war zwischen beiden Therapiearmen nicht unterschiedlich (HR 1,02; 0,87–1,18 [95%-CI]; p = 0,85). Auch in Hinsicht auf die anderen Überlebensparameter waren beide Aromatasehemmer gleich wirksam (Tab. 1). Die Rate an Komplikationen betrug 9,2 % für Exemestan bzw. 9,1 % für Anastrozol. Es gab keinen Unterschied zwischen beiden Therapieoptionen bei jenen Patientinnen, die adjuvant eine Chemotherapie erhalten hatten (HR 1,02; 0,80–1,29 [95%-CI]; p = 0,887) oder die chemonaiv waren (HR 1,01; 0,84–1,23 [95%- CI]; p = 0,894). Ebenso wenig war der Nodalstatus für den Erfolg der einzelnen Therapieoptionen maßgeblich.
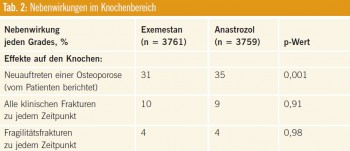
Nebenwirkungen: 70 Prozent der aufgetretenen Nebenwirkungen lagen im Grad-1,2-Bereich. Exemestan zeichnete sich wie zu erwarten durch höhere androgene Wirkungen und Nebenwirkungen aus: So war eine neu diagnostizierte Osteoporose (Tab. 2) unter Exemestan signifikant seltener als unter Anastrozol, die Anzahl der beobachteten Frakturen war jedoch in beiden Therapiearmen gleich.
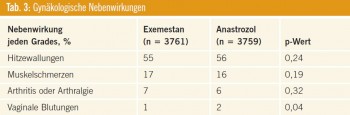
Die gynäkologischen Nebenwirkungen (Tab. 3) waren in beiden Gruppen nicht unterschiedlich, lediglich vaginale Blutungen wurden unter Anastrozol gering häufiger verzeichnet.
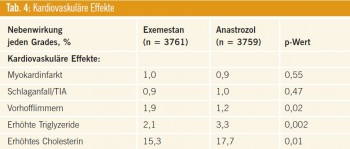
Bezüglich kardialer und vaskulärer Nebenwirkungen zeigte Exemestan ein güns – tigeres Lipidprofil, jedoch wurden Herzrhythmusstörungen häufiger beobachtet (Tab. 4). Akne und Virilisierung sowie erhöhte Leber-Transaminasen und Bilirubin- Werte wurden ebenfalls unter dem steroidalen Aromatasehemmer Exemes – tan häufiger registriert.
Zusammenfassung
In diesem ersten direkten Vergleich eines steroidalen und eines nichtsteroidalen Aromatasehemmers wurden für postmenopausale Patientinnen mit rezeptorpositivem invasivem Mammakarzinom keine Unterschiede bezüglich der Überlebensparameter verzeichnet. Die Ereignisrate war in beiden Therapiearmen gering, das krankheitsfreie Überleben betrug nach einem mittleren Nachbeobachtungszeitraum von 4,1 Jahren 91 Prozent. Unterschiede wurden im Nebenwirkungsprofil beobachtet. Anastrozol war mit einer höheren Inzidenz für Osteoporose, einem schlechteren Profil der Serumlipide und mit geringeren vaginalen Blutungen assoziiert. Exemestan zeigte häufiger Herzrhythmusstörungen und androgene Nebenwirkungen.
Bei vergleichbarer Effektivität beider Substanzen besteht nunmehr die Möglichkeit, anhand des Nebenwirkungsprofils die für die einzelne Patientin günstigere Therapieoption zu wählen.
1 Howell A and Bergh J, J Clin Oncol 2010; 28:4548–4550
2 Robertson JFR et al., Cancer Res 2001; 61:6739–6746
3 Chia S et al., J Clin Oncol 2008; 26:1664–1670
4 Di Leo A et al., J Clin Oncol 2010; 28:4594–4600
5 Robertson JFR et al., Cancer Res 2010; 70 (Suppl. 2):76S
6 Rae JM et al., Cancer Res 2010; 70 (Suppl. 2):78S
7 Leyland-Jones B et al., Cancer Res 2010; 70 (Suppl. 2):78S
8 Bartlett JMS et al., Cancer Res 2010; 70 (Suppl. 2):80S