Schluckrehabilitation nach multimodaler Therapie
Nach Therapie von Kopf-Hals-Tumoren können Störungen der Primärfunktionen Atmung mit oftmaliger Notwendigkeit einer passageren oder permanenten Sicherung des Atemwegs über ein Tracheostoma und Schlucken (Dysphagie = Störung der Aufnahme/des Transportes der Nahrung von der Mundhöhle in den Magen) sowie der Sekundärfunktionen Phonation (Dysphonie) und Artikulation (Dysglossie) auftreten. Sowohl Chirurgie als auch eine Radio(chemo)therapie sowie v. a. deren Kombination (multimodale Therapie) können eine Dysphagie nach sich ziehen. Organerhaltende Therapiekonzepte resultieren nicht in einer Erhaltung der Organfunktionen1. Sollte eine Dysphagie mit Aspiration (Eindringen von Speichel/Nahrung in den Atemweg unterhalb der Stimmlippen-ebene, Abb.) vorliegen, besteht durch Malnutration, Dehydratation oder bronchopulmonale Komplikationen potenziell eine vitale Gefährdung. Von den Betroffenen werden Dysphagie und non-orale Sondenernährung als größte Beeinträchtigungen erlebt2, 3, sodass die Wiedererlangung der Schluckfunktion als Schlüsselfaktor für den funktionellen Outcome nach Kopf-Hals-Tumoren gilt.
Schluckstörungen nach Kopf-Hals-Malignomen
Die Prävalenz von posttherapeutischen Schluckstörungen wird in Abhängigkeit von Tumorlokalisation und Tumorstadium, Art der Therapie sowie Zeitpunkt und Art der Erfassung (subj. Angabe oder instrumentelle Diagnostik) sehr unterschiedlich angegeben (28,6–75 %4–8). Die höchste Dysphagie-Prävalenz wurde nach Radiochemotherapie, multimodaler Therapie und salvage surgery beobachtet. In den letzten zehn Jahren hat sich die Dysphagie-Prävalenz trotz Weiterentwicklung von Chirurgie und Strahlentherapie nicht verringert, sondern nahm sogar zu9. Auch individuelle Patientenfaktoren einschließlich der sog. „funktionellen Reserve“ (Kompensationsfähigkeit des Patienten) und des Lebensalters10 haben Einfluss auf die Schluckfunktion.
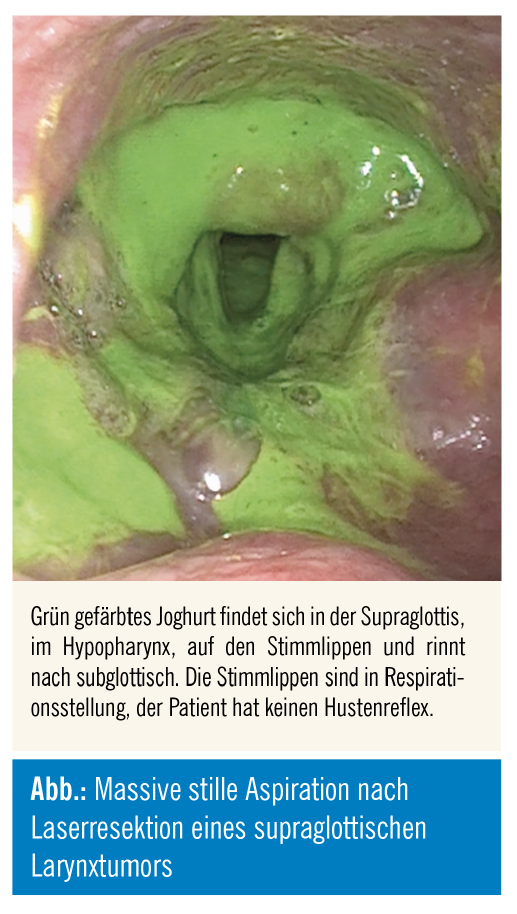
Dysphagie/Aspiration nach Teilresektion im Bereich des oberen Aerodigestivtraktes: Nach Teilresektionen im Bereich des oberen Aerodigestivtraktes (Mundhöhle, Zunge, Zungengrund, Pharynx, Larynx) und einer Neck-Dissection können sowohl Bolustransport als auch laryngeale Schutzfunktion vor einer Aspiration beeinträchtigt sein. Meist sind für eine Aspiration zwei oder mehrere Ursachen verantwortlich bzw. es liegen kombinierte Aspirationsformen vor. Eine Aspiration ohne Hustenreflex (sog. stille oder stumme Aspiration) wird oftmals nicht bemerkt und erst durch eine Pneumonie auffällig. Obwohl einzelne Resektionen bestimmte Funktionsdefizite erwarten lassen, werden oftmals große quantitative und qualitative Unterschiede der postoperativen Schluckfunktion beobachtet. Daher ist eine exakte instrumentelle Diagnostik vor Beginn der Schluckrehabilitation unverzichtbar.
Dysphagie/Aspiration nach Radiochemotherapie von Kopf-Hals-Malignomen: Nach Strahlentherapie (primär, adjuvant) werden v. a. folgende schluckrelevante Veränderungen beobachtet: Xerostomie, Dysgeusie, Abnahme der oralen und pharyngealen Motilität, eingeschränkte Epiglottiskippung und Larynxelevation (sog. „frozen larynx“ bei völligem Fehlen der Larynxelevation) und Sensibilitätsstörungen. Etwa 65 % der Patienten leiden in den ersten drei Monaten nach Strahlentherapie an einer Schluckstörung11, nach 24 Monaten noch 14 %12. Eine Aspirationspneumonie wird im ersten Jahr nach Strahlentherapie bei 5,3 % der Patienten beobachtet13. Selbst Jahre nach Abschluss einer Strahlentherapie kann eine sogenannte late onset Dysphagie auftreten14, 15. Modifikation der Strahlentherapie, wie z. B. Dosisreduktion bei schluckrelevanten Strukturen oder intensitätsmodulierte Strahlentherapie14, 16–18, sollen helfen, die Schluckfunktion weniger zu beeinträchtigen. Eine konkomitante Chemotherapie erhöht sowohl Schweregrad der akuten Strahlentoxizität als auch den Anteil schluckgestörter Patienten selbst 12 Monate nach Strahlentherapie19, 20. Dysphagie nach Laryngektomie: Nach kompletter Kehlkopfentfernung kommt es durch Wegfall des Tongenerators Larynx zu einer Trennung des Atemweges vom Vokaltrakt, wodurch der Patient zum permanenten Halsatmer wird. Schluckstörungen nach Laryngektomie sind mit etwa 10–48 % gar nicht so selten21, 22. Deren Auftreten wird u. a. durch fehlenden negativen hypopharyngealen Druck, gestörte Öffnung/Spasmus des oberen ösophagealen Sphinkters, Motilitätsstörungen des zervikalen Ösophagus, gestörte ösophageale Motilität, Gewebsfibrosen und Narbenstrikturen sowie gastroösophagealen Reflux begünstigt. Eine Aspiration ist nur bei Fistelbildung oder Komplikationen eines tracheoösophagealen Shunts (Stimmprothese) möglich.
Schluckdiagnostik – Voraussetzung für Schluckrehabilitation/-therapie
Voraussetzung für die Schluckrehabilitation ist eine sorgfältige HNO-ärztlich/phoniatrische Schluckdiagnostik. Dabei erfolgen der Ausschluss/Nachweis einer Aspiration, die Aufdeckung der Pathophysiologie, der Art und des Ausmaßes der Schluckstörung, Austestung kompensatorischer und adaptiver Therapiemethoden, eine Prognoseabschätzung sowie eine Empfehlung über die Art der Ernährung (oral/non-oral).
Aufgrund von Sensibilitätsstörungen mit divergierenden subjektiven Angaben der betroffenen Patienten über ihre Schluckfunktion23 und des möglichen Vorliegens einer stillen Aspiration ist eine instrumentelle dynamische Diagnostik unverzichtbar. Am häufigsten wird eine Videoendoskopie des Schluckaktes (FEES, fiberoptic [flexible] endoscopic evaluation of swallowing24), die die pharyngeale Schluckphase analysiert, als Teil der HNO-ärztlichen/phoniatrischen Untersuchung vorgenommen. Idealerweise erfolgt eine Videodokumentation, die eine bessere Beurteilungsreliabilität und -validität sowie eine anschauliche Befundbesprechung mit dem Patienten und im Team ermöglicht25. Die FEES wird nach dem standardisierten Langmore-Protokoll26, das an die Patientenbedürfnisse angepasst wird, vorgenommen: Dabei erfolgt eine direkte Visualisierung des oberen Aerodigestivtraktes mit Beobachtung in Ruhe, bei Phonation und beim Schlucken von Speichel und gefärbter Nahrung in unterschiedlicher Konsistenz und Menge, um ein individuelles Störungsprofil zu erhalten. Weiters werden kompensatorische Methoden (Haltungsänderungen, Schluckmanöver) und Änderungen der Nahrungskonsistenz bereits im Hinblick auf die Therapie überprüft, ob sie die Schluckfunktion verbessern können. Der Schweregrad der Dysphagie wird von der Menge des Aspirates, vom Vorhandensein eines Hustenreflexes und der Möglichkeit des willkürlichen Abhustens bestimmt. Die Verwendung von Schweregrad-Skalen, wie der Penetration-Aspiration-Scale nach Rosenbek27 (validierte deutsche Fassung28), erleichtert die Vergleichbarkeit der Befunde. In vielen Fällen ist komplementär eine Röntgen-Videocinematographie des Schluckaktes29, die den Bolus von der Mundhöhle bis in den Magen und somit alle Schluckphasen darstellt, indiziert. Diese kann auch simultan mit der FEES erfolgen30.
Schluckrehabilitation und logopädische Dysphagie-Therapie
Die Schluckrehabilitation nach Kopf-Hals-Malignomen ist ein interdisziplinäres und multiprofessionelles Arbeitsfeld, in dem HNO-Ärzten/Phoniatern und Logopäden als unverzichtbaren Partnern große Bedeutung zukommt. Eine logopädische Therapie zur Verbesserung von Schlucken, Stimme und Artikulation ist unverzichtbar31, 32. Ein statistisch signifikanter prognostischer Faktor für eine erfolgreiche Schlucktherapie ist neben Tumorstadium und Aspirationsgrad ein möglichst früher Therapiebeginn33, 34. Diskutiert wird zunehmend eine prophylaktische Schlucktherapie bereits vor Beginn einer Radiatio35, 36.
Auf der Grundlage der HNO-ärztlichen/phoniatrischen Diagnostik einschließlich FEES sowie der Röntgen-Videocinematographie werden gemeinsam mit der Logopädie erreichbare Schluckrehabilitationsziele definiert und ein individuell ausgerichtetes Therapiekonzept geplant. Die Tab. (mod. nach37, 38) gibt einen Überblick über die Schluckrehabilitation. Die funktionelle logopädische Schlucktherapie umfasst als maßgeschneidertes Funktionstraining kausale, kompensatorische und adaptive Therapieverfahren38. Berücksichtigung finden ein exspiratorisches Muskeltraining39, die Optimierung der Koordination von Atmen und Schlucken40 sowie die Verbesserung des Abhustens zur Reinigung der Trachea von Aspirat41. Wichtiger Therapiebestandteil ist ein adäquates Trachealkanülenmanagement: Aus funktioneller Sicht wird eine Sprechkanüle, optimalerweise mit Sprechventil, zur fingerfreien Phonation angestrebt, damit eine laryngeale Belüftung zur Verbesserung der Larynxsensibilität sowie Phonation und Abräuspern/Abhusten möglich sind. Eine suffiziente Ernährung muss sichergestellt sein. Bei länger als 3–4 Wochen dauernder non-oraler Ernährung ist meist eine PEG-Sonde empfohlen. Wenn möglich, sollte eine völlige orale Nahrungskarenz („Nothing per oral“) vermieden werden.