Therapie invasiver Pilzinfektionen in der Hämatoonkologie
Invasive Pilzinfektionen sind eine wesentliche Ursache von Morbidität und Letalität bei Patienten mit malignen hämatologischen Systemerkrankungen. Als Hochrisikogruppe gelten schwer immunsupprimierte Patienten wie Leukämiekranke oder Patienten mit malignen Lymphomen, die eine intensive Therapie (Chemotherapie, ausgedehnte Strahlentherapie) benötigen oder mit einer Stammzell-Transplantation behandelt werden und lange Phasen der Granulozytopenie durchmachen müssen.
Erregerspektrum und Risikofaktoren
Candida- und Aspergillus-Spezies (Sp.) haben die größte Bedeutung als Erreger von Pilzinfektionen. Candida albicans ist der häufigste Erreger der invasiven Candida-Infektionen.1 Von den anderen, nicht-C. albicans Sp. kommen am häufigsten C. glabrata, C. krusei, C. parapsilosis und C. tropicalis vor. Die wichtigsten humanpathogenen Aspergillus Sp. sind A. fumigatus (< 80 % aller Aspergillus-Infektionen), A. terreus, A. niger und A. flavus. Weltweit werden in zunehmendem Maße aber auch andere Pilze wie Zygomyceten (Mucor, Rhizopus, Rhizomucor Sp.), Fusarium Sp. und Scedosporium Sp., Cryptococcus neoformans und Pneumocystis jirovecii isoliert.
Diagnostik der Pilzinfektionen
Die klinischen Symptome von Pilzinfektionen sind unspezifisch und unterscheiden sich nicht von denen einer schweren bakteriellen Infektion. Die wichtigsten Symptome sind Fieber über 38,5 °C oder Hypothermie unter 36 °C, das Nicht-Ansprechen auf die antibiotische Therapie, eine respiratorische Insuffizienz, Sepsis und Multiorganversagen. Der Nachweis von invasiven Pilzinfektionen ist komplex und stützt sich immer auf mehrere Säulen, einschließlich Bildgebung, konventioneller Pilzkulturen, weiterer mikrobiologischer Tests wie Antikörper/Antigen-Reaktionen und Molekularbiologie sowie Histopathologie.2–4 In der Praxis ist es aber oft schwierig, eine endgültige Diagnose einer Pilzinfektion abzuwarten. Entscheidend für die Prognose ist eine frühzeitige antimykotische Therapie. Bei Verdacht auf pulmonale Pilzinfektion sollte eine Computertomographie des Thorax durchgeführt werden. Das sogenannte Halo-Phänomen ist bei neutropenen Patienten ein starker, aber nicht spezifischer früher Hinweis auf eine invasive Aspergillus-Infektion der Lunge. Bei Verdacht auf eine hepatolienale invasive Candida-Infektion oder Pilzinfektionen in ZNS, Augen und Nasennebenhöhlen sollte die Magnetresonanztomographie eingesetzt werden. Zur Abklärung pulmonaler Infiltrate wird die Bronchoskopie mit bronchoalveolärer Lavage (BAL) empfohlen. Der Nachweis von Candida Sp. im Sputum und in der BAL sollte so lange als Kontamination oder als Besiedlung gewertet werden, bis eine invasive Pilzinfektion histologisch nachgewiesen ist. Anderseits sollte der Nachweis von Aspergillus oder anderen Schimmelpilzen im Sputum von Patienten mit prolongierter Neutropenie und mit klinischen Zeichen einer invasiven Infektion als möglicher Indikator einer invasiven Pilzpneumonie gewertet werden. Bei Hochrisikopatienten werden eine routinemäßige Untersuchung (2x/Woche oder häufiger) mittels des Aspergillus-Galactomannan-Tests sowie ein Screening auf 1,3-β-D-Glucan zum Nachweis einer invasiven Pilzinfektion empfohlen. Bei Verdacht auf ZNS-Pilzinfektion sollte Liquor simultan mittels Pilzkultur und Antigentest auf C. neoformans untersucht werden.
Candida-Infektionen
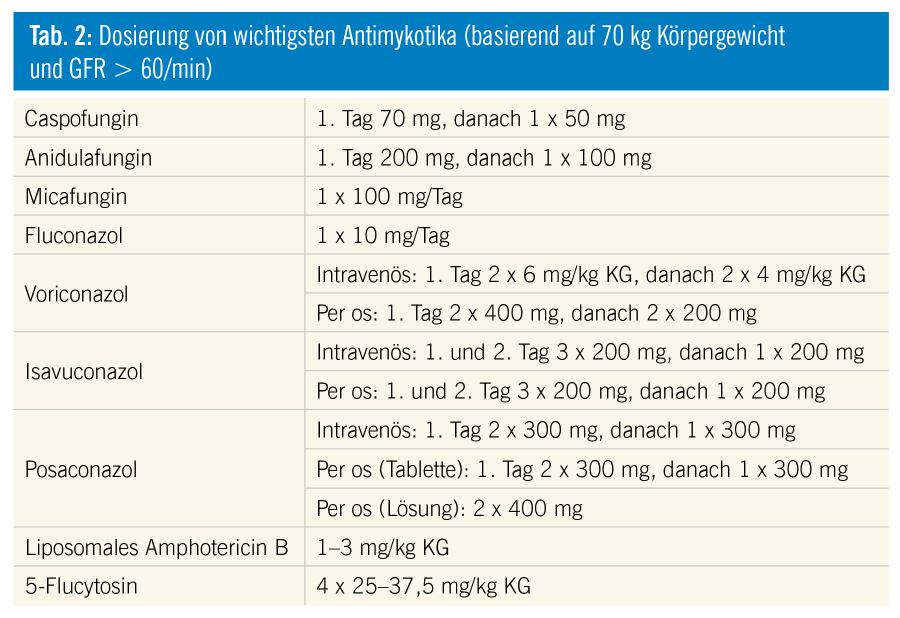
Die Therapie einer invasiven Candida-Infektion sollte bei den neutropenischen Patienten vor Speziesidentifikation mit einem Echinocandin erfolgen.5, 6 Bei einer Echinocandin-Kontraindikation/Unverträglichkeit wird ein lipidformuliertes (vorzugsweise liposomales) Amphotericin B als Erstlinientherapie empfohlen. Im direkten Vergleich zwischen Echinocandinen zeigten sich aber keine Unterschiede hinsichtlich Wirksamkeit und Sicherheit. Die Erstlinientherapie mit Fluconazol oder Voriconazol wird nur noch bei den nicht-neutropenischen Patienten empfohlen, die keine Azol-Prophylaxe erhalten haben. Nach der Speziesidentifikation und antimikrobieller Testung sollte, außer bei C. parapsilosis, wo Fluconazol noch als Mittel der ersten Wahl gilt, die Therapie mit einem Echinocandin fortgesetzt werden. Falls sich das Candida-Isolat als Fluconazol-empfindlich erweist, kann im Sinne einer Deeskalation auf Fluconazol umgestellt werden, allerding nur bei stabilen Patienten nach mindestens fünf Tagen Echinocandin-Therapie. Bei den Patienten mit C. krusei-Infektion ist Voriconazol bei der Deeskalation ebenfalls eine Option. Die antimykotische Therapie sollte bis mindestens 14 Tage ab der ersten negativen Blutkultur, vollständiger Resolution aller infektionsassoziierten Befunde und nach Ende der Neutropenie fortgesetzt werden. Ein zentralvenöser Katheter sollte auf jeden Fall entfernt oder getauscht werden. Bei allen Formen einer invasiven Candida-Infektion sollte vor Therapieende eine Fundoskopie zum Ausschluss einer Chorioretinitis erfolgen. Bei neutropenischen Patienten sollte am Ende der Neutropenie ebenfalls eine Sonographie des Abdomens zum Ausschluss einer hepatolienalen Candida-Infektion erfolgen. Zur Behandlung der hepatolienalen Candida-Infektionen werden bei den neutropenischen Patienten liposomales Amphotericin B/Amphotericin-Lipidkomplex, Echinocandine oder Voriconazol empfohlen, bei nicht-neutropenischen Patienten auch Fluconazol (Behandlung und Prophylaxe). Die Therapie der Candida-ZNS-Infektionen und Candida-Endophthalmitis besteht aus einer Kombination von Amphotericin B Desoxycholat und 5-Flucytosin. Alternativ bei Candida-Endophthalmitis kann Fluconazol, Voriconazol oder Caspofungin eingesetzt werden, wobei hier eine mangelnde Gewebe-Penetration der Echinocandine zu Therapieversagen führen kann. Hierzu ist eine längere Therapie von mindestens vier bis sechs Wochen Dauer erforderlich.
Aspergillus-Infektionen
In der letzten Leitlinie der „European Conference for Infections in Leukemia (ECIL-6)“ wird Voriconazol oder Isavuconazol als Therapie der ersten Wahl empfohlen.5, 7 Die Anwendung von liposomalem Amphotericin B wird empfohlen, wenn Voriconazol kontraindiziert ist oder bereits Nebenwirkungen aufgetreten sind. Voriconazol wird ausschließlich in Verbindung mit „Therapeutic Drug Monitoring“ empfohlen. Posaconazol und Echinocandine sollten als Zweitlinientherapie eingesetzt werden. Chirurgische Sanierung wird insbesondere bei großen solitären Herden empfohlen. Bei ZNS-Aspergillus-Infektion sollte Voriconazol wegen seiner guten Penetration ins ZNS bevorzugt werden. Für die Dauer der Therapie der invasiven Aspergillus-Infektionen gibt es keine einheitlichen Richtwerte, eine Minimaldauer beträgt jedoch sechs bis zwölf Wochen und hängt sehr stark von der klinischen Situation des jeweiligen Patienten ab.
Seltene Pilzinfektionen
Die Therapie von Zygomyceten (Mucor, Rhizopus, Rhizomucor Sp.) wird durch die Resistenz dieser Erreger gegen die meisten Antimykotika erschwert. Wirksam sind liposomales Amphotericin B und Posaconazol. Gegen Fusarium und Scedosporium Sp. ist Amphotericin B nur schwach wirksam und die beste Wirksamkeit zeigen Voriconazol und Posaconazol. Bei der C. neoformans-Infektion wird initial liposomales Amphotericin B in der Kombination mit 5-Flucytosin oder Fluconazol empfohlen. Für den Therapieerfolg sind die Rekonstitution des Immunsystems und chirurgische Sanierung enorm wichtig. Zur Therapie der P. jirovecii-Pneumonie wird Trimethoprim/Sulfamethoxazol hochdosiert i.v. empfohlen. Zusätzlich sollte bei PaO2 < 70 mmHg bei Raumluftatmung die begleitende Kortikosteroid-Therapie erwogen werden. Als Alternative gelten Pentamidin i.v., Trimethoprim + Dapson, Atovaquon und Clindamycin + Primaquin.
Resümee
Die Letalität von invasiven Pilzinfektionen bei den hämato-onkologischen Patienten ist hoch und kann nur durch adäquate Diagnose und Therapie gesenkt
werden. Beides stellt aber weiterhin eine große Herausforderung dar.