Aggressive B-Zell-Lymphome − Neue Entwicklungen und Therapiestrategien
Das diffus großzellige B-Zell-Lymphom (DLBCL) ist mit 40 % das häufigste maligne Lymphom der westlichen Welt, dessen Inzidenz mit steigendem Alter signifikant ansteigt. Die hohe histologische, klinische und molekulare Variabilität führt zu unterschiedlichen Überlebensraten auf die Standard-Immunochemotherapie R-CHOP. Zur Risikostratifizierung wird der NCCN internationale prognostische Index (NCCN-IPI) verwendet, der die Patienten aufgrund klinischer Charakteristika wie Alter, LDH, Extranodalbefall, Ann-Arbor-Stadium sowie Performance-Status in 4 Risikogruppen unterteilt, die mit 5-Jahres-Überlebensraten von 54–96 % vergesellschaftet sind. Zur Ann-Arbor-Stadieneinteilung hat sich mittlerweile die funktionelle Bildgebung mittels PET-CT als neuer Standard etabliert.
Erstlinientherapie
In der Erstlinientherapie hat die Zugabe des Anti-CD20-Antikörpers Rituximab zu CHOP einen Durchbruch in der Therapie des DLBCL gebracht, der zu einem Überlebensbenefit von 15 % führte. Für Patienten mit einem niedrigen oder niedrig-intermediären Risiko gemäß IPI sind somit 6–8 Zyklen R-CHOP Standard. Im Hochrisiko-Setting (hoch intermediäres oder hohes IPI-Risiko) liegt die Überlebenswahrscheinlichkeit mit R-CHOP unter 50 % und der Standard ist aufgrund fehlender Studienlage weniger gut definiert, sodass hier R-CHOP, aber auch intensivere Schemata wie R-CHOEP, R-ACVBP oder sogar konsolidierend die autologe Stammzelltransplantation (ASCT) in erster kompletter Remission (CR) empfohlen werden.
Cell-of-Origin-Klassifikation: „Beyond R-CHOP“
Zur exakten Prognoseabschätzung, aber auch als Grundlage für weitere therapeutische Entscheidungen sollte vor Einleitung der Therapie eine „Cell of Origin“ (COO)-Bestimmung durchgeführt werden. Mittels Genexpressionsanalysen (GEP) konnten 2 mit unterschiedlicher Prognose behaftete DLBCL-Subtypen unterschieden werden: der ungünstigere „activated B-cell-like“ (ABC; 40 %) sowie der günstigere „germinal center B-cell-like“ (GCB; 46 %) DLBCL-Subtyp.
Weitgehend durchgesetzt hat sich die Bestimmung mittels unterschiedlicher IHC-basierter Algorithmen (Hans, Choi, Tally usw.), die GCB- (42 %) und Non-GCB-Subtypen (58 %) unterscheiden. Obwohl es für die beiden Subtypen keine getrennten Therapieempfehlungen gibt, konnte doch für die Addition von Lenalidomid – einer immunmodulierenden Substanz – zu R-CHOP („R2-CHOP“) gezeigt werden, dass die inferiore Prognose des Non-GCB-Subtyps durch die Zugabe von Lenalidomid egalisiert werden kann.
Eine weitere wirksame Substanz ist der B-Cell-Receptor (BCR)-Inhibitor Ibrutinib, der das chronisch aktive „BCR Signalling“ – ein intrinsischer Transduktionsweg des ABC-Subtyps – inhibiert. Erwartungsgemäß beschränkt sich die Wirkung von Ibrutinib als Einzelsubstanz im relapsierten Zustand auf den ABC-DLBCL-Subtyp, wo das Ansprechen bei ca. 40 % liegt (vs. 5 % beim GCB-Subtyp). Große prospektiv-randomisierte, placebokontrollierte Studien sowohl für R2-CHOP als auch für Ibrutinib R-CHOP sind im Laufen und werden den Stellenwert dieser neuen zielgerichteten Substanzen definieren.
„Double-Hit“-, „Triple-Hit“- und „Double-Expressor“-Lymphome
„Double-hit Lymphoma“ (DHL) sind definiert als das gemeinsame Vorkommen einer MYC- und BCL2-Translokation. Diese dualen Translokationen können mittels FISH-Technik bei etwa 5–10 % aller Fälle bestimmt werden. Falls zusätzlich eine Translokation, die das BCL6-Gen inkludiert, vorkommt, spricht man von Triple-Hit-Lymphomen.
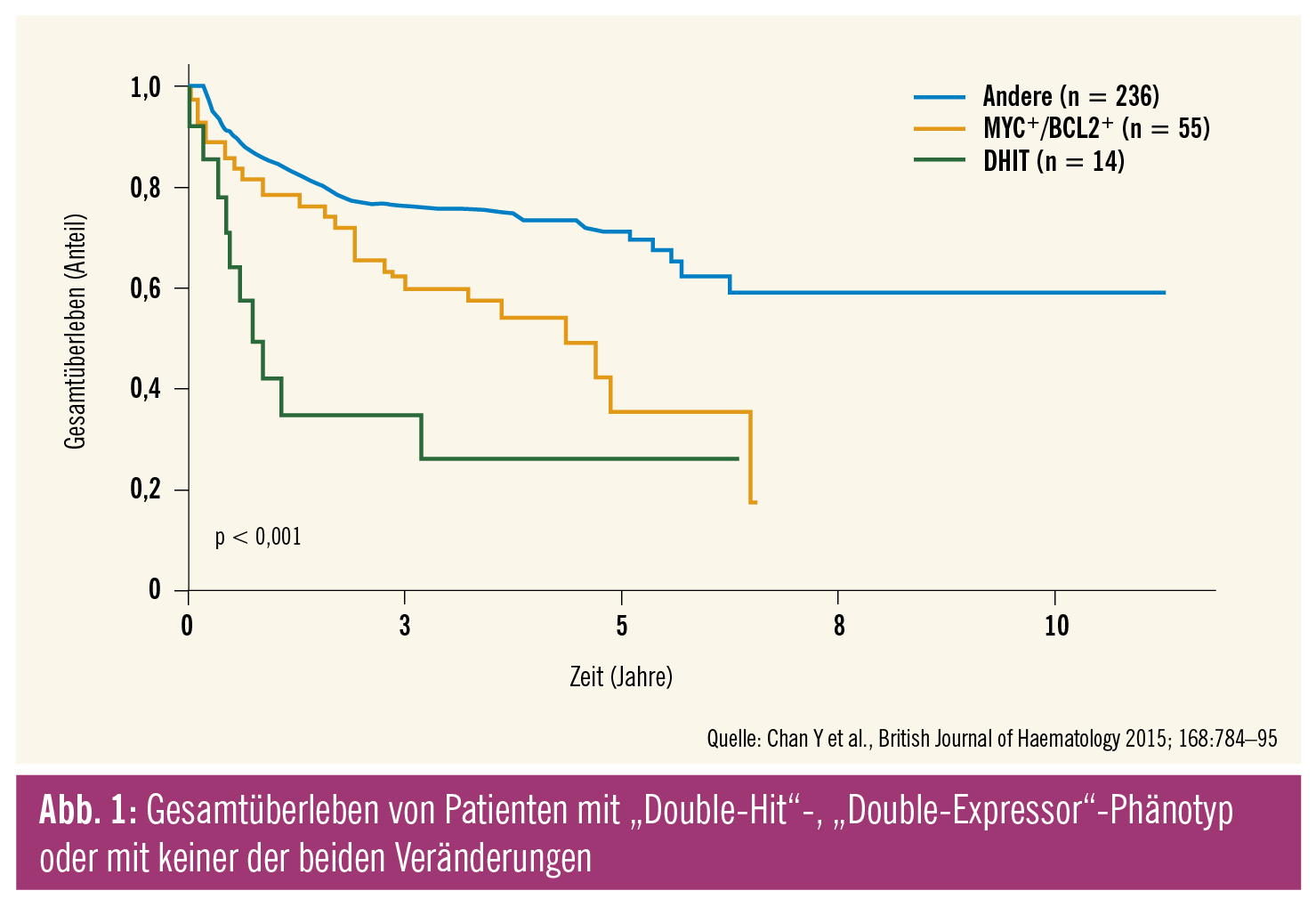
Die meisten DHL (91 %) sind dem GCB-Subtyp zuordenbar. Double- und Triple-Hit-Lymphome sind durch eine ungünstige Prognose charakterisiert, mit 2-Jahres-Überlebensraten mit R-CHOP von nur 25 %. Demgegenüber werden als „Double-protein-expressing Lymphoma“ (DEL) DLBC-Lymphome bezeichnet, die eine Überexpression von MYC und BCL2 aufweisen. Etwa 30–40 % aller DLBCL weisen einen DEL-Phänotyp auf, wobei 73 % aller DEL dem ABC-Subtyp angehören. Die Prognose auf konventionelle Immunochemotherapie ist ebenfalls ungünstig, jedoch besser als bei DHL (Abb. 1).
In einer Studie beträgt das 5-Jahres-Überleben bei R-CHOP-behandelten Patienten für DHL 27 %, für DEL 36 % und für Patienten, die weder einen DHL- noch einen DEL-Phänotyp aufwiesen, 71 %. Für DHL-Patienten stellt R-CHOP eine unzureichende Therapie dar und es besteht Konsens darüber, dass intensivere Schemata, wie (dose adjusted) DA-R-EPOCH, appliziert werden sollten.
Auch bei DEL sind die Ergebnisse für R-CHOP unbefriedigend, allerdings ist die Datenlage hinsichtlich optimierter Therapien uneinheitlich. Wir konnten jedoch in Kooperation mit anderen Zentren zeigen, dass mit einer Therapie nach dem DA-R-EPOCH-Schema eine 1-Jahres-PFS-Rate von 68 % erreicht werden kann.
Relapsiert refraktäres DLBCL
Eine Reinduktionstherapie mit einer mittelhoch dosierten platinhaltigen Polychemotherapie (z. B. R-DHAP oder R-ICE), gefolgt von einer autologen Stammzelltransplantation, ist weiterhin der gültige Therapiestandard bei relapsiert refraktären (rr-)DLBCL-Patienten, mit dem ca. 30–40 % der transplantierten Patienten geheilt werden können.
Für Patienten mit refraktärem Verlauf, Frührelaps (< 12 Monate nach Erreichen einer CR nach Erstlinientherapie) oder Rückfall nach einer ASCT ist die Prognose infaust und neue „Salvage“-Optionen sind zurzeit in klinischer Erprobung, wobei die Therapie mit chimären Antigen-Rezeptor-T-Zelltherapien (CAR-T-Zelltherapie) sicherlich die erfolgversprechendste ist.
Chimäre Antigen-Rezeptor-T-Zelltherapie
Patienten mit refraktärem Verlauf oder Relaps nach ASCT binnen 12 Monaten haben eine sehr schlechte Prognose. Eine Datenauswertung von insgesamt 626 Patienten (SCHOLAR-1-Studie) ergab, dass das Gesamtansprechen für diese Patientengruppe nach einer konventionellen Salvage-Therapie, aber auch nach Einsatz neuer zielgerichteter Substanzen bei etwa 26 % liegt, mit nur 7 % CR und einem medianen Gesamtüberleben von nur 6 Monaten.
Die in diesem Kontext aussichtsreiche Therapieoption ist der Einsatz einer CAR-T-Zelltherapie. Ein CAR-Konstrukt setzt sich zusammen aus einer extrazellulären Domäne, bestehend aus einem extrazellulären Antikörper-Leichtkettenfragment, das die Antigenspezifität gewährleistet (in diesem Fall CD19), gekoppelt an eine intrazelluläre CD3-ζ-Transaktivierungsdomäne, sowie einer co-stimulierenden Sequenz (Abb. 2A). Dieses CAR-Konstrukt wird in die autologen T-Zellen des Patienten nach Leukapherese zumeist mit lentiviralen Vektoren eingebracht und dem Patienten nach einer lymphodepletierenden Chemotherapie reinfundiert (Abb. 2B).
Zwei große Phase-II-Therapiestudien bei rr-DLBCL-Patienten wurden 2017 publiziert: In der ZUMA-1-Studie wurden 101 Patienten mit aggressiven Lymphomen (81 mit DLBCL, die übrigen mit PMBCL oder transformierten follikulären Lymphomen) mit CAR-T-Zellen behandelt. Die objektive Ansprechrate lag bei 82 %, mit einer CR-Rate von 54 %, wobei die Zeit bis zum Ansprechen nur einen Monat betrug. Nach einer medianen Nachbeobachtungszeit von etwa 15 Monaten blieben 40 % aller Patienten in CR. Vergleicht man diese hervorragenden Ergebnisse mit einem vergleichbaren Patientenkollektiv der SCHOLAR-Studie (konventionelle Chemotherapie), ergibt sich mit der CAR-T-Zelltherapie zugunsten der ZUMA-1-Patienten eine 10-fach höhere CR-Rate und eine 77%ige Risikoreduktion, an dem Lymphom zu versterben.
Wiewohl hocheffektiv, ist doch bei der CAR-T-Zelltherapie das Nebenwirkungsspektrum beträchtlich, wobei das Cytokine Release Syndrome (CRS) mit 93 % (13 % Grad 3 und höher) am häufigsten auftrat. Das Management des CRS ist komplex und inkludiert Steroide sowie den Anti-Interleukin-6-Antikörper Tocilizumab.
Resümee
Das diffus großzellige B-Zell-Lymphom beinhaltet eine Reihe von molekularen und biologischen Subtypen, die mit Immunochemotherapie völlig unterschiedliche klinische Verläufe aufweisen. Mit R-CHOP können ca. 70 % aller Patienten geheilt werden.
In Hochrisiko-Subsets wie ABC-DLBC „Double-hit“- oder „Double-expressing“-Lymphomen oder bei Patienten mit ZNS-Befall werden jedoch nur nicht zufriedenstellende Ergebnisse erzielt, sodass zum Teil Alternativen wie DA-R-EPOCH empfohlen werden. Im refraktär relapsierten Setting bleibt die ASCT weiterhin der Therapiestandard, der jedoch in Zukunft von der CAR-T-Zelltherapie herausgefordert werden wird. Das ultimative zukünftige Ziel ist, die molekularen Subsets besser zu definieren, um einerseits die Heilungschancen zu maximieren und die Toxizität zu reduzieren, andererseits aber auch neue zielgerichtete Therapien zu evaluieren, um letztendlich dem Patienten eine individualisierte Therapiestrategie anbieten zu können.