„Hot Topics“ in der Molekularpathologie des Gastrointestinaltrakts
Im Rahmen eines Interviews für SPECTRUM Pathologie berichtet Univ.-Prof. Dr. Gerald Höfler, Diagnostic and Research Institute of Pathology, Medizinische Universität Graz, über die diesjährigen Highlights zu Tumoren des Gastrointestinaltrakts aus der Sicht eines Pathologen.
KRAS-Mutationsanalyse
Der KRAS-Mutationstest ist laut Prof. Höfler das Paradigma für prädiktives Testen in der Pathologie und hat dazu geführt, dass die Tumor-Mutationsanalyse in der Onkologie einen hohen Stellenwert erhalten hat. Im Jahr 2009 wurde die KRAS-Testung in molekularpathologischen Labors etabliert. Heute, zehn Jahre später, ist die KRAS-Analyse eine Standardprozedur, beispielweise im Vorfeld einer Behandlung mit EGFR-Antikörpern beim metastasierten Kolorektalkarzinom (Colorectal Cancer – CRC).
KRASG12C-Mutation: Ein spannendes Topic aus diesem Jahr basiert auf der KRAS-Mutationsanalyse beim CRC. Die Entwicklung einer small molecule drug (AMG 510), die spezifisch an ein KRASG12C-mutiertes Protein bindet und damit die Signaltransduktion inhibiert, ist laut Prof. Höfler von potenziell hoher klinischer Relevanz. Die Rate an CRC-Tumoren mit G12C-Mutation liegt bei ca. 9 %, und im Hinblick auf die allgemein hohe Inzidenzrate des CRC ist AMG510 eine wichtige Behandlungsoption. In die Open-label Phase-I-Studie waren 19 Patienten mit metastasiertem CRC inkludiert, die nach mindestens zwei Vortherapien eine AMG510-Monotherapie erhielten.1 13 von 18 Patienten erreichten eine Stabilisierung ihrer Erkrankung. Nach der momentan laufenden Phase-II-Studie ist für nächstes Jahr eine Phase-III-Studie mit dem neuen KRAS-Inhibitor geplant. Die Mutationsanalyse auf G12C ist laut Prof. Höfler in die molekularpathologischen Standardprozeduren gut integrierbar.
Hereditäres Kolorektalkarzinom: Lynch-Syndrom
Die Erkennung des hereditären CRC im Rahmen des Lynch-Syndroms ist aus pathologischer Sicht leider nach wie vor ein relativ schwieriges Unterfangen. Eine Arbeitsgruppe der Österreichischen Gesellschaften für Humangenetik und für Pathologie hat zu dieser Thematik Richtlinien ausgearbeitet; derzeit ist das Positionspapier in Begutachtung.
Patienten mit CRC sowie Endometriumkarzinom können vom Lynch-Syndrom betroffen sein – dies ist seit Langem bekannt, trotzdem wird Diagnose nach wie vor bei vielen betroffenen Patienten nicht gestellt. Die klinische Praxis hat laut Prof. Höfler gezeigt, dass die Informationen zur Familienanamnese oft fehlen oder unvollständig sind. International hat sich daher die Empfehlung etabliert, alle CRC-Patienten auf das Tumorsyndrom zu testen. Dieser Ansatz wird auch von den Österreichischen Gesellschaften für Humangenetik und für Pathologie unterstützt.
Die Diagnose betrifft ca. 2–3 % der CRC-Patienten mit „echtem“ Lynch-Syndrom, weitere rund 10 % haben eine methylierungsbedingte DNA-Enzymreparaturdefizienz. Bei allen CRC-Patienten sollte mittels Immunhistochemie eine Testung auf eine eventuelle DNA-Reparaturenzymdefizienz gemacht werden. Bei Ausfall eines der Enzyme wird die weitere Vorgehensweise vom jeweils ausgefallenen Enzym abhängig gemacht. Bei MLH1-Defekt wird beispielweise eine Promotor-Methylierungsanalyse durchgeführt, da nur bei der nicht-methylierten Form mit hoher Wahrscheinlichkeit ein Lynch-Syndrom vorliegt. Bei Ausfall von MSH2 oder MSH6 kann mit hoher Wahrscheinlichkeit von einem Lynch-Syndrom ausgegangen werden. Alle Patienten, die einen dieser Defekte aufweisen, sollten eine genetische Beratung mit anschließender Familienabklärung erhalten.
International hat sich gezeigt, dass die Vorgehensweise auch einen gesundheitsökonomischen Vorteil bringt, da die Entstehung eines invasiven Tumors durch rechtzeitiges Abtragen der Polypenvorstufen verhindert wird. Die Entstehung eines Karzinoms aus Darmpolypen (Adenome) dauert bei Patienten mit Enzymdefekt nur ein bis drei Jahre; daher sollten bei Lynch-Syndrom Patienten jährlich eine Koloskopie und weitere Vorsorgeuntersuchungen durchgeführt werden. Trotz anderen, international anerkannten Empfehlungen wird in der rezent revidierten Version der deutschen S3-Guideline eine Testung nur im Falle einer familiären Auffälligkeit empfohlen.
DNA-Mismatch-Reparaturenzyme beeinflussen das Tumor-Grading: Die durch DNA Mismatch Repair (MMR) verursachten Karzinome sind in der Regel, histopathologisch gesehen, schlecht differenziert. Diese Tumoren entsprechen einer Graduierung G3, wobei jedoch zu berücksichtigen ist, dass diese Patienten eine bessere Prognose haben als jene mit nicht durch DNA-MMR verursachten Grad-3-Tumoren. Patienten mit DNA-MMR sollen nach S3-Guideline daher als „low-grade“ klassifiziert werden. Dies sollte weiter diskutiert werden und eventuell das histopathologisch korrekte Grading (G3) belassen, aber durch einen entsprechenden Zusatz betreffend die bessere Prognose ergänzt werden.
Mikrosatelliteninstabilität als Indikator für das Immuntherapie-Ansprechen: Patienten mit DNA-MMR-Defekt sind Mikrosatelliten-instabil (MSI-high) und können von einer Immuntherapie profitieren. Diese Patienten weisen auch zu einem Großteil eine hohe Tumor Mutational Burden (TMB) auf. Die Korrelation wurde nach Evaluierung von 301 CRC-Patienten mit MSI-high-Status aus dem Cancer Genome Atlas belegt: 99,7 % der Patienten mit MSI-high-Status sind auch TMB-high. Die wesentlich günstigere MSI-Bestimmung ist also beim CRC ausreichend. Allerdings ist in diesem Zusammenhang zu berücksichtigen, dass die Ansprechraten beim CRC trotzdem niedrig sind.
NTRK-Fusions-positiveKarzinome
Bei Tumoren, die eine NTRK(Neurotrophic Receptor Tyrosine Kinase)-Fusion aufweisen, gibt es seit Kurzem eine hocheffiziente Therapie mit einem selektiven TRK-Inhibitor (Larotrectinib). Die Ansprechraten aus der Zulassungsstudie liegen bei über 80 %, die Behandlung führt außerdem in vielen Fällen zu Langzeitremissionen.2 Allerdings weisen nur sehr wenige Tumorarten diese Translokation auf, die Gesamtinzidenz liegt bei 0,3 %; bei einigen sehr seltenen Karzinomen (z. B. sekretorisches Mammakarzinom) beträgt die Inzidenz fast 100 %. Für das CRC liegt die Inzidenz nur bei knapp 1 %. Bei jenen Tumoren mit höherer NTRK-Inzidenz empfehlen die ESMO-Guidelines die Bestimmung mittels Immunhistochemie und anschließendem RNA-Next Generation Sequencing(NGS)-Assay. Bei anderen Tumoren wird die direkte NGS-Sequenzanalyse empfohlen, wobei die Durchführung für alle Patienten mit malignen Tumoren jedoch aufgrund der hohen Kosten problematisch ist. Eine Alternative, die laut Prof. Höfler derzeit in Graz zur Anwendung kommt, ist die immunhistochemische Evaluierung und nur bei positiven oder unklaren Fällen eine anschließende NGS-Analyse.
Liquid Biopsy
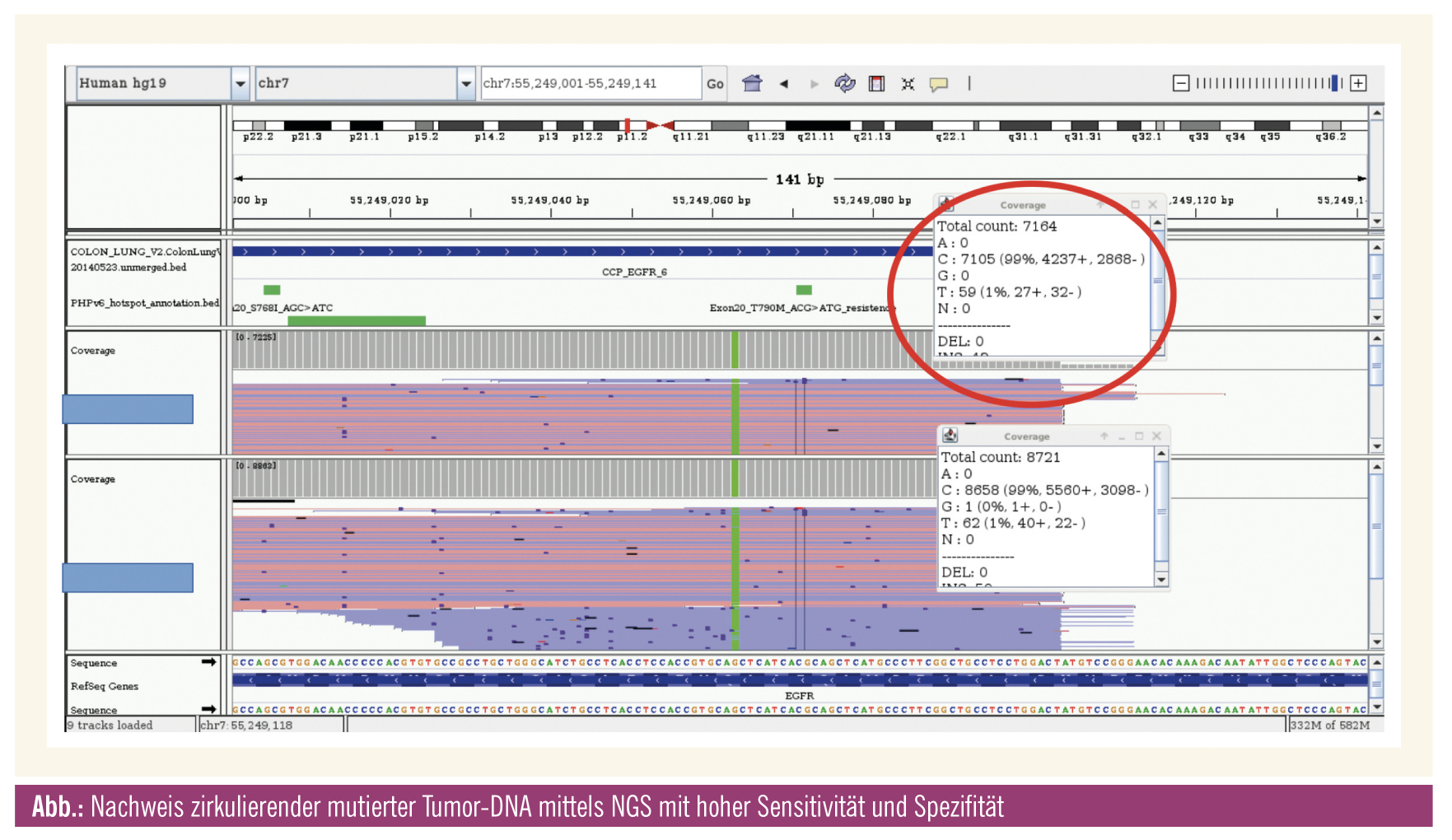
Beim CRC hat sich klar gezeigt, dass zirkulierende Tumor-DNA die minimale Resterkrankung (Minimal Residual Disease – MRD) erkennen kann; damit wird eine Tumor-Recurrance, beispielsweise bei CRC-Patienten im Stadium 2, vorhersagbar, und zwar zu einem früheren Zeitpunkt, als dies mit bildgebenden Verfahren möglich ist. Derzeit liegen allerdings noch keine Studien vor, ob der prognostische Faktor einen klinischen Vorteil bringt, weshalb sich die Liquid Biopsy auf diesem Gebiet noch nicht durchgesetzt hat.
Weitere molekulare Marker
Die BRAF-Mutation kommt bei ca. 10 % der metastasierten CRC vor. Aufgrund der schlechten Prognose dieser Patienten besteht die Möglichkeit, eine Immuntherapie mit Checkpoint-Inhibitoren einzusetzen. Aus diesem Grund ist die Bestimmung des BRAF-Status durchaus sinnvoll. Die Tumoren einer kleinen Subgruppe von CRC-Patienten weisen einen MET-Exon-14-Verlust auf. Die MET-Amplifikation ist bei gastrointestinalen Tumoren ebenfalls selten. Trotz der Verfügbarkeit wirksamer zielgerichteter Therapien stellt sich erneut die Frage, ob alle Patienten auf diesen Gendefekt gescreent werden sollten. Eine Patientengruppe, bei der die MET-Amplifikation häufiger vorkommt, sind KRAS-negative, metastasierte CRC-Patienten, die schon mit einem EGFR-Antikörper behandelt wurden – hier liegt die Inzidenz bei 22 %. Eine pathologische Abklärung sollte bei dieser Gruppe von Patienten durchgeführt werden.
Mikrobiom
Noch spekulativ und sehr interessant ist der Einfluss des Dickdarm-Mikrobioms auf die Entstehung von Mutationen im Epithel und damit auf die Entwicklung von Karzinomen. In Tiermodellstudien hat sich gezeigt, dass es eine Assoziation zwischen bestimmten Erregern, wie z. B. Fusobacterium nucleatum, und der Entstehung von CRC gibt. Für die Tumorentstehung ist aber höchstwahrscheinlich nicht ein einzelner Erreger verantwortlich, sondern das Mikrobiom in seiner Gesamtheit, inklusive der von Bakterien abgesonderten Stoffwechselprodukte. Im Tiermodell hat sich zudem gezeigt, dass mittels Stuhltransplantation die Prädisposition für die Karzinomentstehung übertragbar ist. Laut Prof. Höfler handelt es sich bei der Assoziation Mikrobiom und Krebsentstehung um ein sehr spannendes Gebiet, dass man unbedingt wissenschaftlich weiterverfolgen müsse.