Unterer Gastrointestinaltrakt: WHO-Klassifikation 2019
Die World Health Organization (WHO) hat in diesem Jahr, neun Jahre nach der Veröffentlichung der 4. Auflage, die 5. Auflage mit dem Titel „Digestive System Tumours“ publiziert. Die Auflage wurde um 218 Seiten erweitert. Besonders nennenswert ist die separate Abhandlung der mesenchymalen und hämatolympyhoiden Neoplasien in den Kapiteln 11 und 12 sowie der genetischen Tumorsyndrome des Gastrointestinaltrakts in Kapitel 14. Die Kapitel 5–7 umfassen die Neoplasien der Appendix, des Kolorektums und des Analkanals und wurden im Vergleich zur 4. Ausgabe um 14 Seiten ergänzt. Pragmatisch beinhalten die Kapitel 5–7 folgende drei Highlights: die neue Klassifikation der serratierten Läsionen des Kolorektums und der Appendix, die erweiterte Berichterstattung des kolorektalen Karzinoms sowie die optimierte Einteilung und Gradierung der muzinösen Neoplasien der Appendix.
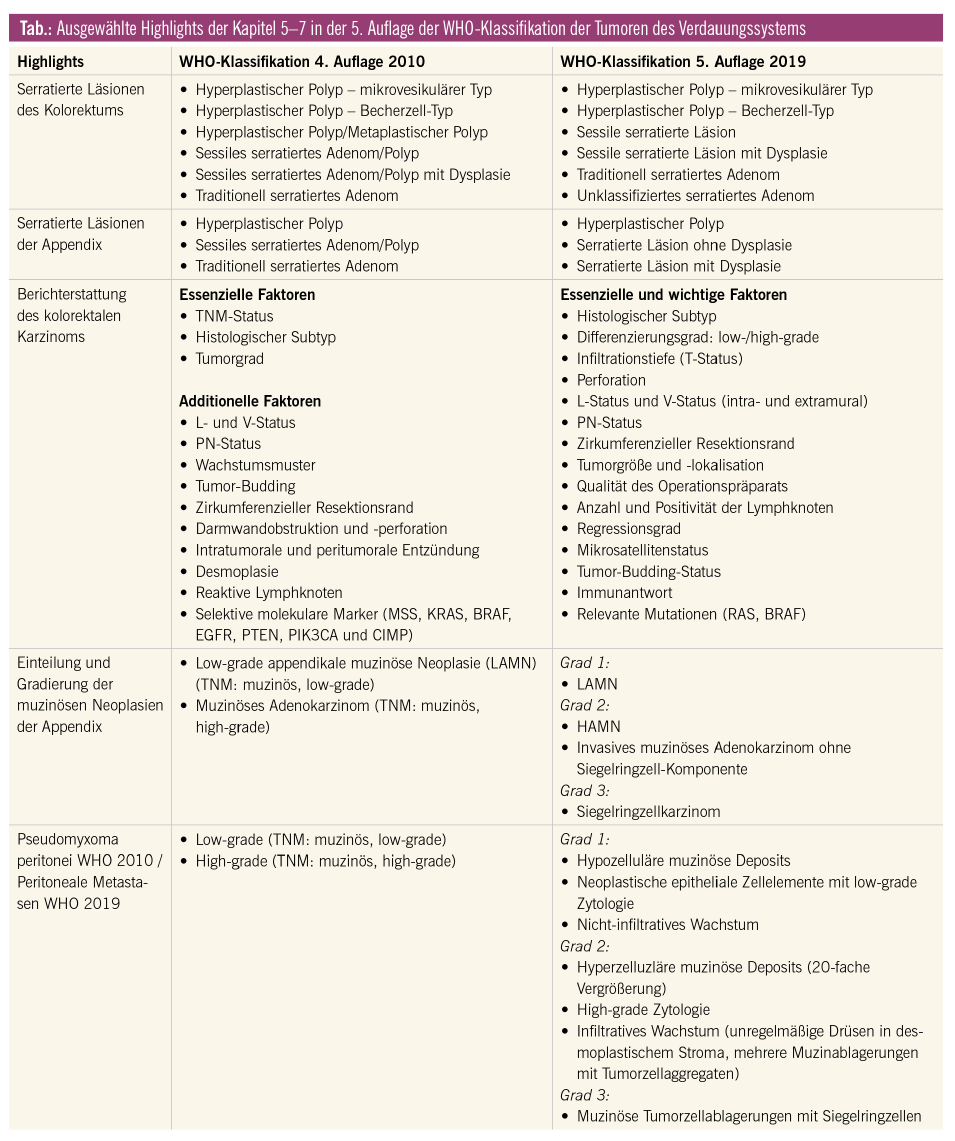
Serratierte Läsionen des Kolorektums und der Appendix
Die Fortschritte im Verständnis der pathogenetischen und molekularpathologischen Aspekte der Entstehungswege des kolorektalen Karzinoms haben dazu geführt, dass die Klassifikation der Vorläuferläsionen, insbesondere der serratierten Läsionen, stetig adaptiert und optimiert wurde. Eine ideale morphologische Klassifikation sollte, wann immer möglich, die biologischen Mechanismen reflektieren. Dementsprechend weist auch die 5. Auflage der WHO-Klassifikation einige Neuerungen auf. Daraus ergibt sich für die Pathologie die sehr wichtige Aufgabe, bei der Anwendung im klinischen Alltag möglichst allfällige Missverständnisse zu vermeiden.
Etwa 30 % aller kolorektalen Karzinome basieren auf dem serratierten Entstehungsweg: Der serratierte Entstehungsweg wird in einen BRAF- und einen KRAS-serratierten Entstehungsweg unterteilt und beinhaltet folgende molekulare Charakteristika: Mikrosatellitenstatus, KRAS-, BRAF- und CIMP (CpG Island Methylator Phenotype)-Status, Wnt-Entstehungsweg, TP53-Mutation und MLH1-Methylierung. Im KRAS-serratierten Entstehungsweg führt eine KRAS-Mutation zur Bildung eines hyperplastischen Polypen (HP) (Becherzell-Typ), aus welchem wiederum über den CIMP-low-Status ein KRAS-mutiertes, traditionell serratiertes Adenom (TSA) entstehen kann. Das KRAS-mutierte TSA weist definitionsgemäß immer eine zytologisch leichtgradige Dysplasie auf, die sich durch eine Wnt-Entstehungsweg-Aktivierung bzw. TP53-Mutation in eine schwere Dysplasie umwandeln kann. Im BRAF-serratierten Entstehungsweg führt eine BRAF-Mutation allein zum HP (mikrovesikulärer Typ) und in Kombination mit dem CIMP-Status zu einem BRAF-mutierten TSA, dessen leichtgradige Dysplasie sich durch Aktivierung des Wnt-Entstehungsweges, assoziiert mit einer TP53-Mutation, in eine hochgradige Dysplasie umwandeln kann. Der mikrovesikuläre HP kann sich über den CIMP-high-Status in eine sessile serratierte Läsion (SSL) umwandeln, deren Progression durch eine Aktivierung des Wnt-Entstehungsweges charakterisiert wird. Die zusätzliche MLH1-Methylierung führt zur Entität der MLH1-instabilen SSL mit Dysplasie, die TP53-Mutation hingegen zur MLH1-stabilen SSL mit Dysplasie.
In der aktuellen Klassifikation werden somit folgende Entitäten aufgeführt: HP (Becherzell-Typ, mikrovesikulärer Typ), SSL ohne/mit Dysplasie, TSA und das unklassifizierte serratierte Adenom (z. B. das serratierte tubulovillöse Adenom). Praktisch sollten dabei folgende Punkte beachtet werden:
- Die Begriffe „sessiles serratiertes Adenom“ (SSA) und „sessiler serratierter Polyp“ (SSP) werden neu als SSL zusammengefasst.
- Die Dysplasie bei der SLL wird im Gegensatz zum TSA nicht gradiert.
- Der hyperplastische Polyp wird pathogenetisch in zwei Subtypen unterteilt.
Im klinischen Alltag sollten jedoch die bisher geltenden Gewohnheiten in der Interaktion zwischen Pathologie und Gastroenterologie nicht unterschätzt werden. In der Berichterstattung kann je nach Situation eine Übergangsphase in Betracht gezogen werden, in der die Entität der 5. Auflage zusammen mit der korrespondierenden Entität der 4. Auflage in Klammern aufgeführt wird (Beispiel: SSL WHO 2019 / SSA ohne zytologische Dysplasie WHO 2010). Die Klassifikation der serratierten Läsionen der Appendix lehnt sich an die Klassifikation der serratierten Läsionen des Kolorektums an, ist mit dieser jedoch nicht vollumfänglich identisch. Die Begriffe SSA und SSP werden zwar als SSL mit/ohne Dysplasie zusammengefasst, die Dysplasie wird jedoch in low-grade und high-grade unterteilt. Der Begriff TSA hingegen wird nicht mehr verwendet, jedoch dessen morphologische Merkmale in der Entität SSL mit Dysplasie berücksichtigt. Der HP wird ebenfalls nicht in weitere Subtypen unterteilt.
Zusammenfassend ergeben sich folgende drei Entitäten: HP, SSL ohne Dysplasie und SSL mit Dysplasie.
Erweiterte Berichterstattung des kolorektalen Karzinoms
Im Zeitalter der personalisierten Medizin sind die interdisziplinären Tumorkonferenzen (Tumorboards) von großer Bedeutung. Deswegen nimmt die Berichterstattung durch die Pathologie eine wichtige Rolle für das weitere Patientenmanagement ein. Ein optimaler Pathologiebericht sollte möglichst alle relevanten prognostischen und prädiktiven Faktoren beinhalten.
In der 5. Auflage der WHO-Klassifikation 2019 werden einige der Punkte geklärt, die in den letzten Jahren immer wieder Fragen aufgeworfen haben: Der Tumorgrad wird weiterhin durch die glanduläre Formation definiert und das kolorektale Karzinom in low-grade und high-grade unterteilt, wobei die am wenigsten differenzierte Stelle den Ausschlag gibt. Der Tumorgrad wird nicht durch das Wachstumsmuster (infiltrativ vs. expansiv) oder das Tumor-Budding definiert, welche separat aufgeführt werden. Tumor-Budding kann gemäß den Empfehlungen der ITBCC 2016 bestimmt werden. Das muzinöse und das siegelringzellige Adenokarzinom sind die wichtigsten histologischen Subtypen und werden dann rapportiert, wenn > 50 % extrazelluläres Muzin bzw. > 50 % Siegelringzellen detektiert werden können.
Als therapieassoziierte Faktoren werden der zirkumferenzielle Resektionsrand und der Tumorregressionsgrad erwähnt. Der zirkumferenzielle Resektionsrand spielt vor allem beim Rektumkarzinom eine essenzielle prognostische Rolle, während die Reproduzierbarkeit des Tumorregressionsgrades (TRG) eher suboptimal erscheint. Zusätzlich gibt es für den TRG unterschiedliche Gradierungssysteme, wie z. B. Mandard, AJCC 2010, Rödel oder MSKCC (Memorial Sloan Kettering Cancer Center). Der Mikrosatellitenstatus sowie der RAS- und der BRAF-Status gelten als etablierte prädiktive Marker, während die RNA-basierte Genexpression, der Immunoscore, PIK3CA und c-Met als partiell etabliert beschrieben werden.
Optimierte Einteilung und Gradierung der muzinösen Neoplasien der Appendix
Die 5. Auflage der WHO-Klassifikation 2019 weist eine deutliche Verbesserung der Klassifikation und der Gradierung der muzinösen Neoplasien der Appendix und des Pseudomyxoma peritonei auf. Während in der 4. Auflage die Klassifikation in zwei Tabellen (Tabelle 7.01 und 7.02) unterteilt wurde, wird die Thematik in der 5. Auflage in einer Tabelle (Tabelle 5.02) übersichtlich visualisiert. Für die muzinösen Neoplasien werden drei Grade definiert: low-grade appendiceal mucinous neoplasm (LAMN), high-grade appendiceal mucinous neoplasm (HAMN) und das Siegelringzellkarzinom. Für die peritonealen Metastasen werden ebenfalls drei Grade aufgeführt, die überwiegend auf morphologischen Kriterien basieren.
Weitere Aspekte – Tumoren des Verdauungssystems
Die oben aufgeführten Highlights sind selbstverständlich als subjektive Auswahl zu verstehen und sollen in keinerlei Hinsicht eine wertende Bedeutung haben. Deswegen seien hier auch weitere Themen der WHO-Klassifikation 2019 erwähnt, welche in der täglichen Praxis ebenfalls zur Anwendung kommen:
- die Gradierung des Becherzell-Adenokarzinoms der Appendix (Seite 149, Tabelle 5.03)
- die Einteilung der neuroendokrinen Neoplasien (Seite 16–22 mit jeweiliger Abhandlung in den entsprechenden Organkapiteln)
- die IBD-assoziierte Dysplasie des Kolorektums (Seite 174–176)
- die molekularen Klassifikationen des kolorektalen Karzinoms, Cancer Genomic Atlas (CGA) und Consensus Molecular Subtypes (CMS) (Seite 184–185, Figure 6.35)
- die Klassifikation der analen squamösen Dysplasie (Seite 202–204, Tabelle 7.01), des Plattenepithelkarzinoms des Analkanals (Seite 205–207, Tabelle 7.02) und des analen Adenokarzinoms (Seite 208–211, Tabelle 7.17)
Resümee
Die 5. Auflage der WHO-Klassifikation 2019 der Tumoren des Verdauungssystems hat die wichtige Aufgabe, sowohl die Gastrointestinalpathologie als auch die Disziplinen der Viszeralchirurgie/Viszeralmedizin und der gastrointestinalen Onkologie in der täglichen Zusammenarbeit im Sinne einer optimalen Patientenbetreuung zu unterstützen. Im Bereich der Tumoren des unteren Gastrointestinaltrakts sind deshalb die adaptierten Tumorklassifikationen zu erwähnen, die einen wichtigen Pfeiler in der personalisierten Medizin darstellen.
Referenzen:
-Bosman FT et al., WHO classification of tumours of the digestive system. IARC, Lyon 2010
-International Agency for Research on Cancer: WHO classification of tumors editorial board – digestive system tumors. Lyon 2019