Regressionsgrading beim Mammakarzinom
Die neoadjuvante Chemo- oder Hormontherapie findet zunehmenden Einsatz in der Behandlung des Mammakarzinoms. Speziell bei triple-negativen und HER2/neu-positiven Karzinomen, die zu einem Großteil sehr gut ansprechen, führt die neoadjuvante Therapie zu einem verbesserten krankheitsfreien Überleben und Gesamtüberleben. Bei großen Karzinomen wird durch die neoadjuvante Therapie eine brusterhaltende Operation erst ermöglicht. Luminal-A-Karzinome sprechen besser auf eine endokrine Therapie als auf eine Chemotherapie an. Zur exakten Beurteilung des Ansprechens des Karzinoms auf die neoadjuvante Therapie muss das Operationspräparat speziell untersucht und ein Regressionsgrading erstellt werden. Dieses stellt neben der ypTNM-Klassifikation nach UICC, dem histopathologischen Grading und der Bestimmung der Biomarker einen essenziellen Bestandteil des Pathologiebefundes dar.
Qual der Wahl? Verschiedene Systeme für das Regressionsgrading
Im Laufe der Jahre haben sich für das Regressionsgrading verschiedene Systeme entwickelt. Diese beurteilen das Ausmaß der Veränderungen, insbesondere der Rückbildung des invasiven Tumors, wobei von einem Teil der Systeme auch Lymphknoten mit eingeschlossen werden. Nur ein Teil dieser Klassifikationssysteme wurde anhand von Überlebensdaten validiert. Insgesamt unterscheiden sich die Systeme auch in der Definition der kompletten pathologischen Remission, d. h. dem vollständigen Verschwinden des Karzinoms nach der präoperativen Therapie. Ein einfaches deskriptives System gibt es innerhalb des TNM-Systems der UICC. Die ersten vor mehr als 20 Jahren entwickelten Systeme schlossen den Lymphknotenstatus nicht mit ein. Ein vor etwa 10 Jahren am MD Anderson Cancer Center entwickeltes Klassifikationssystem bildet den Resttumor, der als RCB („residual cancer burden“) bezeichnet wird, mittels eines Scores ab. In Österreich wurde im Zuge der Initiierung der ABCSG-Studie 34 im Jahre 2011 der RCB stark propagiert und seine Einführung mithilfe von Seminaren unterstützt.
RCB: Modell mit hoher klinischer Relevanz
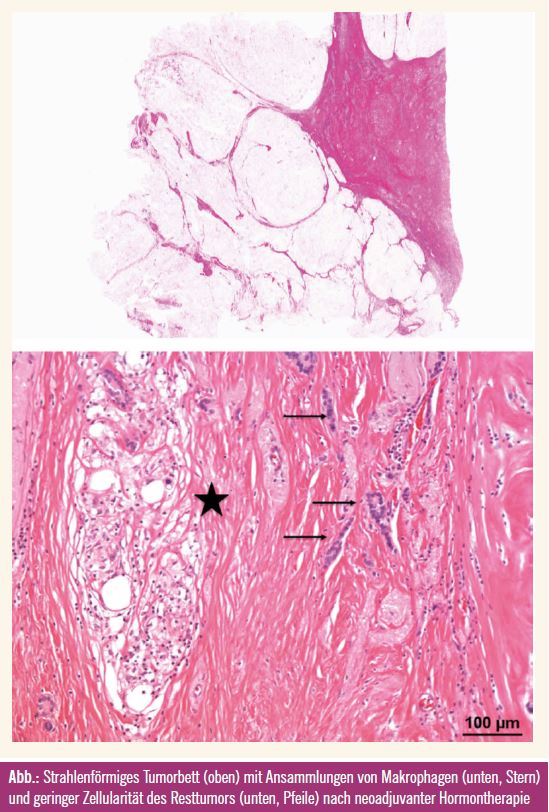
Der RCB errechnet sich aus der Größe des ursprünglichen Tumorbetts, der Zellularität des Resttumors (Zellreichtum in Prozent pro Volumen) und der Anzahl sowie der maximalen Größe der Lymphknotenmetastasen. Die Zellularität des Tumors wird anhand des Operationspräparates bestimmt, die Stanzbiopsie muss nicht als Vergleich zur Verfügung stehen, wie dies beim Miller-Payne-System erforderlich ist. Auch das Vorhandensein einer DCIS-(Duktales-Karzinom-in-situ-)Komponente fließt in die Berechnung ein, die durch einen webbasierten Rechner auf der Homepage des MD Anderson Cancer Center durchgeführt wird. Das Ergebnis ergibt einen arithmetischen Wert, der je nach Höhe in drei Klassen eingeteilt wird. Bei Fehlen von Resttumor entsprechend einer kompletten pathologischen Remission ergibt sich der Wert 0. Für die partielle Remission gibt es zwei Kategorien (RCB-I und RCB-II), die Kategorie RCB-III bringt eine minimale oder fehlende Remission oder eine Tumorprogression zum Ausdruck. Der RCB zeigt eine ausgezeichnete Korrelation mit dem Gesamtüberleben und dem krankheitsfreien Überleben, wobei zwischen den Gruppen RCB-0 und RCB-I kein signifikanter Unterschied besteht. Die Gruppe RCB-III ist durch eine ungünstige Prognose charakterisiert. Für den RCB konnte mittlerweile auch eine ausgezeichnete Übereinstimmung zwischen einzelnen Pathologen nachgewiesen werden, dies unterstützt die propagierte flächendeckende Verwendung in unterschiedlichen österreichischen Zentren. Zwischen einer kompletten oder beinahe kompletten pathologischen Remission (RCB-0 und RCB-I) und dem Gesamtüberleben besteht eine ausgezeichnete Übereinstimmung. Auch eine residuelle DCIS-Komponente sollte im Befund gesondert angeführt werden. Sie beeinflusst weniger das Gesamtüberleben als das Auftreten von Lokalrezidiven. Wenn nach der Therapie nur noch DCIS übrigbleibt, liegt dennoch eine komplette pathologische Remission vor. Isolierte Tumorzellen bzw. Mikrometastasen in Lymphknoten entsprechen aber nicht einer kompletten pathologischen Remission.
Für die Aufarbeitung von Operationspräparaten nach neoadjuvanter Chemotherapie gibt es mittlerweile verschiedene Empfehlungen zu einem einheitlichen Vorgehen. Eine internationale Arbeitsgruppe hat im vergangenen Jahr Empfehlungen für ein standardisiertes Vorgehen in der pathologischen Aufarbeitung der Präparate nach neoadjuvanter Therapie publiziert. Ein Mapping der eingebetteten Proben mit exakter Dokumentation wird dabei empfohlen. In einigen österreichischen Brustzentren ist ein systematisches und serielles Einbetten des gesamten Präparates in einem derartigen Fall die bevorzugte Methode. Sie erlaubt außerdem eine exakte Beurteilung der Resektionsflächen auf Tumorfreiheit. Bei Fehlen eines makroskopischen Tumors ist die vollständige Einbettung des Tumorbettes unerlässlich (Abb.). Dennoch hat die histologische Aufarbeitung hinsichtlich der Entdeckung von mikroskopischem Resttumor ihre Grenzen. Die Verwendung von Großflächenschnitten ermöglicht dabei eine übersichtliche Beurteilung der Präparate, wird aber nur von wenigen Pathologieinstituten eingesetzt.
Bestimmung von Biomarkern nach Therapie
Die Bestimmung der Hormonrezeptoren und des HER2/neu stellt die Basis für die molekulare Klassifikation des Mammakarzinoms dar und steht am Anfang jeder Therapie. Diese Untersuchungen werden an der Stanzbiopsie durchgeführt. Deren Wiederholung am Operationspräparat ist empfehlenswert, wobei entweder der residuelle Primärtumor oder eine Lymphknotenmetastase herangezogen werden sollen.
Insbesondere die Bestimmungen des Östrogenrezeptorstatus und des Ki-67-Färbeindex sind von prognostischer Aussagekraft. Die Einbindung des Ki67-Färbeindex in den RCB wird als RPCB bezeichnet („residual proliferative cancer burden“), wobei dieser eine stärkere Aussagekraft hinsichtlich Langzeitüberlebens aufweist als der RCB. Eine Ergänzung durch das posttherapeutische Grading und den posttherapeutischen Östrogenrezeptor-Status scheint weitere prognostische Information zu bringen. Insbesondere im Rahmen klinischer Studien und bei unbekanntem Biomarkerstatus ist die Bestimmung der 4 Biomarker (Östrogen- und Progesteronrezeptoren, HER2/neu und Ki-67) zwingend erforderlich. Eine Wiederholung der Bestimmung der 4 Biomarker wird außerdem nach negativen oder zweifelhaften Ergebnissen an der Stanzbiopsie, unzureichenden Gewebemengen mittels Stanze, Durchführung der Untersuchung an der Stanze in einer anderen Institution und bei fehlendem Ansprechen auf die Therapie sowie einem heterogenen Tumor oder multiplen Tumoren mit unterschiedlicher Morphologie speziell im Resektat empfohlen. Dabei muss aber festgehalten werden, dass für eine Therapieplanung bioptisch immer für eine histo- und molekularpathologische Diagnostik ausreichendes Tumorgewebe gewonnen werden sollte. Der histopathologische Befund nach neoadjuvanter Therapie sollte neben dem prognostisch aussagekräftigen histopathologischen Grading und der ypTNM-Klassifikation ein Regressionsgrading des Tumors, bevorzugt nach dem RCB-Score, enthalten. Außerdem empfiehlt sich die Wiederholung des Ki67-Färbeindex und des Östrogen- und Progesteronrezeptorstatus (Tab. 1).

Komplette pathologische Remission oder Brusterhaltung als Ziel
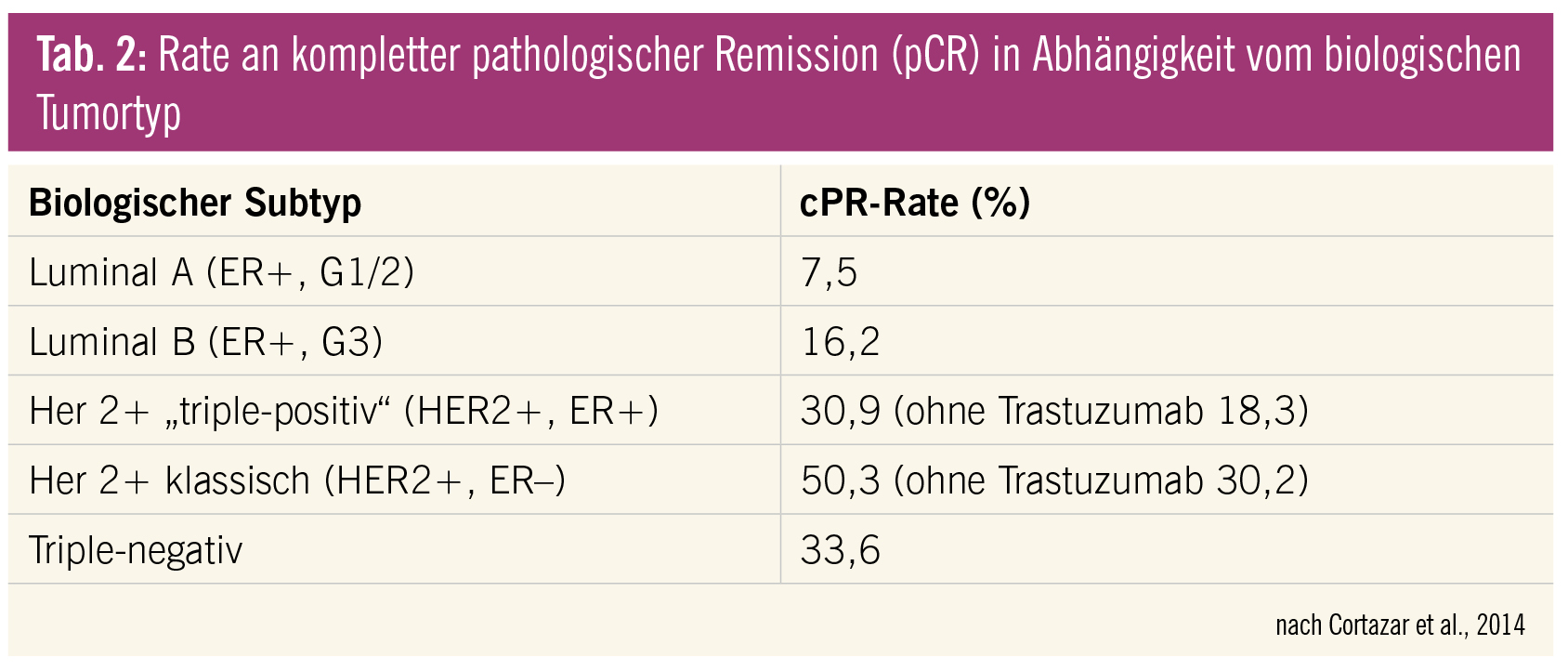
Eine komplette pathologische Remission (pCR) wird in der Regel nur durch eine neoadjuvante Chemotherapie bzw. Anti-HER2/neu-Therapie erzielt. Die höchste pCR-Rate findet sich in der Gruppe der HER2+-Karzinome ohne ER-Expression („HER2 classic“), gefolgt von triple-negativen (HER2–/ER–) und triple-positiven (HER2+/ER+) Karzinomen. Für die Luminal-A- und -B-Karzinome liegt die pCR-Rate deutlich niedriger (Tab. 2). Unter neoadjuvanter Hormontherapie ist eine pCR zwar ungewöhnlich, durch die Verkleinerung der Tumormasse wird aber die Rate an brusterhaltenden Operationen deutlich erhöht.
Literatur:
– Bossu yt V et al., Recommendations for standardized pathological characterization of residual disease for neoadjuvant clinical trials of breast cancer by the BIG-NABCG collaboration. Ann Oncol 2015; 26:1280–1291
– Chiba A et al., Trends in Neoadjuvant Endocrine Therapy Use and Impact on Rates of Breast Conservation in Hormone Receptor-Positive Breast Cancer: A National Cancer Data Base Study. Ann Surg Oncol 2016; DOI: 10.1245/s10434-016-5585-5
– Cortazar P et al., Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet 2014; 384:164–172
– Denkert C et al., Prediction of Response to Neoadjuvant Chemotherapy: New Biomarker Approaches and Concepts. Breast Care 2011; 6(4):265–272
– Peintinger F et al., Reproducibility of Residual Cancer Burden For Prognostic Assessment of Breast Cancer After Neoadjuvant Chemotherapy. Mod Pathol 2015; 28(7):913–920
– Penault-Llorca F et al., Achieving higher pathological complete response rates in HER-2-positive patients with induction chemotherapy without trastuzumab in operable breast cancer. The Oncologist 2007; 12(4):390-396
– Sheri AS et al., Residual proliferative cancer burden to predict long-term outcome following neoadjuvant chemotherapy. Ann Oncol 2015; 26:75–80
– Symmans WF et al., Measurement of residual breast cancer burden to predict survival after neoadjuvant chemotherapy. J Clin Oncol 2007; 25(28):4414–4422