Liquid Biopsy: Tumorspezifische Informationen aus dem Blut
Individuell unterschiedliche Tumorcharakteristika können über den Erfolg oder Misserfolg einer Therapie entscheiden. Bisher basierte die Charakterisierung eines Tumors in erster Linie auf der Histologie. Mittlerweile werden zunehmend Informationen aus zirkulierender, zellfreier Tumor-DNA (Cell-free Circulating Tumor DNA – ctDNA) gewonnen, die sehr gut mit der Histologie übereinstimmen.
„Die Gewinnung serieller Biopsien von viszeralen Metastasen ist oft schwierig. Die serielle Analyse der ctDNA eröffnet die einzigartige Möglichkeit, den Verlauf der Tumorerkrankung zu monitieren“, sagte Alberto Bardelli, Candiolo Cancer Institute, Abteilung für Onkologie, Universität Turin. Er gab im Rahmen der dritten gemeinsamen Jahrestagung der Schweizer und der österreichischen Gesellschaften für Pathologie in Wien* einen Überblick über die aktuellen und potenziellen Anwendungsgebiete der Liquid Biopsy.
Anwendungsgebiete der ctDNA-Analyse
Die tumorspezifische ctDNA ist ein DNA-Fragment mit einer Größe von 120–200 Basenpaaren (bp) und einer Halbwertszeit von ca. 2 Stunden. Oft findet sich im Blut ein nur geringer Teil von ctDNA unter einer großen Menge an Wildtyp-DNA.1
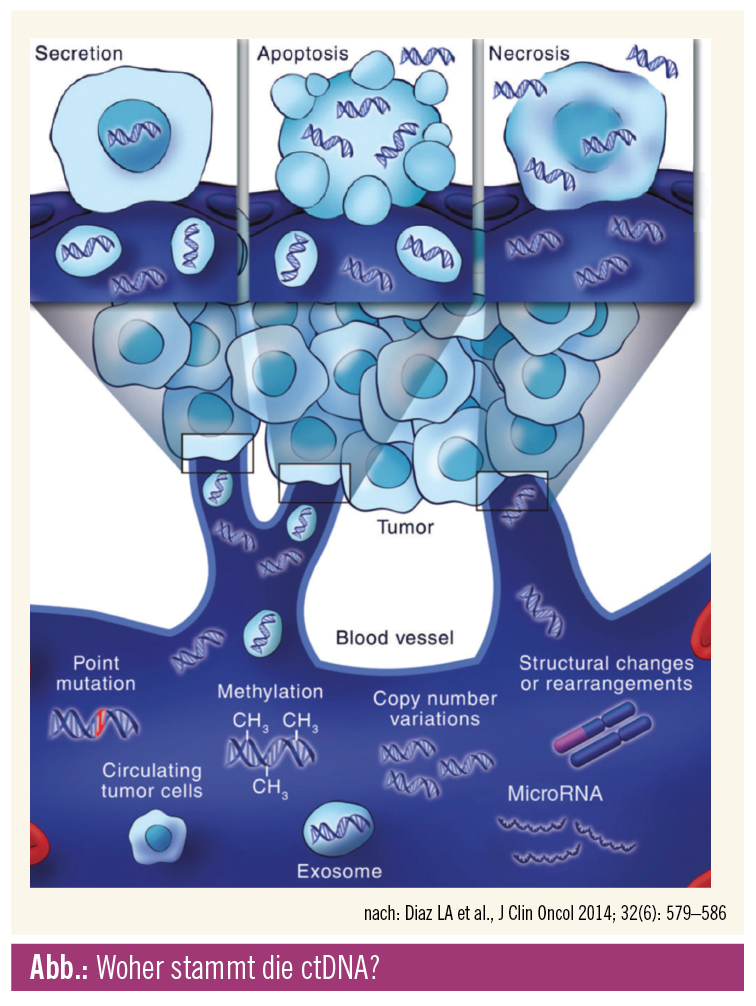
Intensiv diskutiert wird der noch nicht restlos geklärte Ursprung der ctDNA. ctDNA dürfte hauptsächlich aus nekrotischen Zellen stammen, wird möglicherweise aber auch sezerniert oder wird aus apoptotischen Zellen frei (Abb.).1
Die ctDNA-Analyse könnte in Zukunft sowohl die Diagnostik von Tumoren als auch das Therapiemonitoring verbessern, ist Bardelli überzeugt
Diagnostik: Die Genotypisierung der ctDNA im Blut kann zum Nachweis und zur Profilierung des Tumors genutzt werden. Bildgebende Verfahren liefern komplementär dazu Informationen zur Lokalisation und zur Heterogenität.
Beurteilung der chirurgischen Intervention: Abwesenheit von ctDNA nach einem chirurgischen Eingriff bedeutet, Tumorfreiheit erzielt zu haben. Die Aussagekraft der postoperativen Bildgebung ist im Gegensatz dazu oft durch den Wundheilungsprozess eingeschränkt.
Nachweis kleiner Tumorresiduen: Umgekehrt ist auch bei sehr kleinen Tumorresiduen immer noch ctDNA nachweisbar, während diese der bildgebenden Diagnostik entgehen können.
Therapiemonitoring: Die Analyse der ctDNA könnte in Zukunft eine kontinuierliche und engmaschige Kontrolle der Wirksamkeit einer Therapie in Echtzeit ermöglichen. Anhand der Bildgebung kann ergänzend das Ansprechen bestimmter Läsionen beurteilt werden.
Follow-up: Durch die Kontrolle des gesamten Behandlungsverlaufs anhand der ctDNA kann das Ansprechen bzw. eine mögliche Resistenzentwicklung evaluiert werden. Intervalle für den Einsatz bildgebender Verfahren können so möglicherweise verlängert werden, was einen kostensparenden Effekt hätte.
Monitoring einer Resistenzentwicklung: Anhand der ctDNA können auch resistenzassoziierte genetische Alterationen erkannt werden. Ergänzende Informationen über die spezifische Läsion kann die Bildgebung liefern.
Liquid Biopsy am Beispiel des Kolorektalkarzinoms
Bei der Entstehung eines Kolonkarzinoms finden sich häufig bereits in hyperproliferiertem Gewebe einzelne mutierte Zellen (Truncal Mutation, Early Genetic Event). „In Zukunft könnte die Liquid Biopsy sehr nützlich sein, um die Erkrankung in einem sehr frühen Stadium zu erkennen“, so Bardelli.
In Zukunft kann die ctDNA-Analyse auch Hinweise auf das am besten geeignete Therapietarget beim metastasierten Kolonkarzinom (mCRC) liefern und auch Aufschluss über die Ursache für eine Resistenzentwicklung geben, wie Bardelli anhand von Studien zur HER2-Amplifikation und zu ALK- und NTRK1-Translokationen illustrierte.
„Die seit einigen Jahren bekannte HER2-Amplifikation wurde beim Kolonkarzinom nicht berücksichtigt“, berichtete Bardelli. Die HERACLES-(HER2 Amplification for Colo RectaL-Cancer Enhanced Stratification-)Studie zeigt, dass eine dual gegen HER2 gerichtete Therapie eine wirksame neue Therapieoption für das HER2-positive mCRC sein kann.2 Bardelli verwies darauf, dass der Therapieverlauf bei den meisten Patienten anhand von Liquid Biopsy monitiert wurde. „Durch eine solche Verlaufskontrolle gelingt es, Resistenzen frühzeitig zu erkennen und Resistenzmechanismen zu erfassen. Basierend darauf kann eine zusätzliche Therapie etabliert werden.“
Möglicherweise kann in Zukunft auch der Nachweis von unter Therapie neu auftretenden ALK- und NTRK1-Translokationen im Blut die Ursache für ein sekundäres Therapieversagen aufklären. Bei einem Patienten mit einer sekundären Resistenz gegen eine initial gut wirksame NTRK1-Blockade lieferte die Liquid Biopsy den entscheidenden Hinweis auf die Ursache für den Relaps unter Therapie.3
Komplementärer Nutzen von Liquid Biopsy und Bildgebung
Bardelli betonte den großen Nutzen der Zusammenschau von Befunden der Liquid Biopsy und der bildgebenden Diagnostik: „Es können nie alle in der Bildgebung sichtbaren Metastasen biopsiert werden. Ein spezifisches NGS-(Next-Generation-Sequencing-)Panel in Kombination mit der Bildgebung kann hier Aufschluss geben.“ Bei einer Patientin sprach die MEK-Mutation auf eine EGFR-Blockade an, während die Erkrankung insgesamt fortschritt. Der Progress war gemäß Liquid Biopsy auf eine NRAS-Mutation zurückzuführen, die im Biopsat nicht nachweisbar war. „Diese Mutation war durch keine andere Untersuchung als die ctDNA-Analyse nachweisbar. Es ist sehr wichtig, dass in Zukunft Radiologen und Pathologen einzelne Läsionen genau mappen“, betonte Bardelli.
Liquid Biopsy zur Klärung von Fragestellungen klinischer Studien
Bardelli verwies darauf, dass es bei rund 70 % der Patienten mit KRAS-Mutation unter Therapie mit einem EGFR-Inhibitor nach dem Absetzen der Therapie zu einem dramatischen Absinken der Mutationslast kommt. Anstieg und Abfall kann mehrfach aufeinanderfolgen.4 Eine nochmalige Anti-EGFR-Therapie könnte also erfolgreich sein. Ob und wie die Liquid Biopsy dazu beitragen können, den richtigen Zeitpunkt für einen Stopp und den Wiederbeginn der Therapie zu finden, soll die CHRONOS-Studie mit Hilfe der Liquid Biopsy klären. „Geplant ist, wieder mit der Behandlung zu starten, sobald die KRAS-Mutationslast auf die Hälfte des Maximalwerts gesunken ist“, erläuterte Bardelli.
Liquid Biopsy zurweiteren Therapieplanung
Liquid Biopsy könnte auch dazu beitragen, Patienten mit einer Resistenz gegen eine Therapie erfolgversprechende Alternativen anzubieten. Etwa 20 % der Patienten unter einer EGFR-Blockade entwickeln eine Resistenz durch Mutationen an der Bindungsstelle, die eine Bindung des EGFR-Inhibitors verhindern. Diese Mutationen können durch ctDNA-Analysen identifiziert werden. Ein neuer oligoklonaler Antikörper, der an mehrere Regionen der EGFR-ECD bindet, macht die Resistenzbildung des Tumors durch Mutation an nur einer Bindungsstelle unmöglich. Diese Strategie erwies sich sowohl im präklinischen Modell als auch bei Patienten als effektiv.5
Erforschung der Tumorevolution: Schießen auf ein bewegliches Ziel
„Die Histologie bleibt eine Säule der onkologischen Pathologie“, betonte Bardelli. Zukünftig könnte die ctDNA-Bestimmung sowohl im Blut als auch im Liquor (zur verfeinerten Diagnostik von Hirnmetastasen), im Harn, im Speichel oder auch im Pleuraerguss das diagnostische Armamentarium erweitern und einen wichtigen Beitrag zur Erforschung der Evolution von Tumoren leisten. „Wir werden bald von der Jagd nach Genen zur Jagd nach der Evolution wechseln – im Gewebe und in der ctDNA. Wir schießen auf ein bewegliches Ziel“, schloss Bardelli.