[EPA 2012] Zur Wirksamkeit von Antidepressiva und Placebo
Das Problem eines Bias bei der Veröffentlichung von Forschungsergebnissen existiert nicht nur bei Antidepressiva (AD) oder Psychopharmaka, sondern ebenso in vielen anderen Bereichen. Aber in den Diskussionen der vergangenen Jahre wurde gerade die Wirksamkeit von Antidepressiva wiederholt in Frage gestellt“, erklärte Prof. Dr. Koen Demyttenaere, Universität Leuven, Belgien.
So kommt es beispielsweise zu einer Verzerrung der Datenlage, wenn Studien selektiv und eher solche mit positiven Ergebnissen veröffentlicht werden. Laut einer Untersuchung von Turner et al.1 wurden von 74 Antidepressiva-Studien, die bei der FDA registriert waren, 31 % nicht veröffentlicht. Von den publizierten Studien waren 94 % positiv, von den nichtpublizierten waren es nur 51 %. Einen Publikationsbias gäbe es jedoch nicht bei nur bei Medikamentenstudien, sondern auch bei Psychotherapiestudien2 und neurobiologischen Untersuchungen.
„Daneben existiert aber noch ein anderes Phänomen. Manche Studien werden in der wissenschaftlichen Community oder in einer breiteren Öffentlichkeit mit Begeisterung aufgenommen und diskutiert, während andere nicht zur Kenntnis genommen werden.“ Demyttenaere verwies in diesem Zusammenhang auf die Metaanalyse von Kirsch et al.3, die vor allem in den Publikumsmedien mit der Kernaussage, dass Antidepressiva kaum wirksamer seien als Placebo, große Wellen schlug.
Ansprechen bei Akutbehandlung: Durch – geführt wurde diese Metaanalyse mit 35 Zulassungsstudien, die von 1987 bis 1999 bei der FDA eingereicht worden waren. Die Ergebnisse zeigten zwischen der antidepressiven Behandlung und Placebo eine durchschnittliche Differenz von 1,8 Punkten im HAM-D (Hamilton rating scale for depression). Ein – gemäß der NICE-Guidelines – klinisch relevanter Unterschied von 3 Punkten im HAM-D fand sich nur bei den zu Behandlungsbeginn schwer depressiven Patienten (HAM-D ≥ 28).
„Warum wählt man für eine Publikation von 2008 Studien aus den Jahren 1987 bis 1999?“ Außerdem habe sich Kirsch auf eine kleine Auswahl von AD – Nefazodon, Fluoxetin, Venlafaxin, Paroxetin – beschränkt und eines dieser AD, Nefazodon, wurde bereits vor Jahren wegen Todesfällen vom Markt genommen, kri – tisierte Demyttenaere. „Wenn man die 8 Nefazodon-Studien ausschließt, zeigen 60 % der Studien einen klinisch relevanten Unterschied von 3 Punkten im HAMD bei allen Depressionsschweregraden.“ Anders als die Kirsch-Untersuchung habe die Metaanalyse von Melander et al.4, die die von 1984 bis 2003 in Schweden eingereichten AD-Studien untersuchte, keine Wellen geschlagen. In dieser Analyse wurde bei den Responseraten mit 49 % Responder unter anti – depressiver Therapie versus 33 % unter Placebo eine durchschnittliche Differenz von 16 % gefunden. Dies entspricht einer NNT (Number Needed to Treat) von 6 bis 7, die auch von NICE als klinisch relevant angesehen wird. Diese Analyse kommt zu dem Schluss, dass zwei Drittel der antidepressiven Wirkung auf einem Placeboeffekt und ein Drittel auf einem zusätzlichen pharmakologischen Effekt beruht.
Vergleichbare Ergebnisse zeigte die Metaanalyse von Papakostas und Fava5, die insgesamt 182 Studien mit einer Dauer von 6 bis 8 Wochen einschloss: Hier lag die Responserate unter AD bei 54 % gegenüber 37 % unter Placebo. Als den am besten geeigneten Endpunkt für die Beurteilung der Akutwirksamkeit erach- tet Demyttenaere die Ansprechrate (50%iger Rückgang der Symptomatik). „Remissionsraten sind zwar prinzipiell klinisch relevant, aber aus meiner Sicht für Akutstudien aufgrund der Beobachtungszeiten von wenigen Wochen nicht sehr geeignet. Zudem werden Remissionsraten (HAM-D < 7, MADRS < 9) im Unterschied zu Responseraten auch von der Depressionsschwere zu Behandlungsbeginn beeinflusst. Ebenfalls nicht optimal seien Veränderungen der Punktezahl auf einer Bewertungsskala wie etwa der HAM-D.
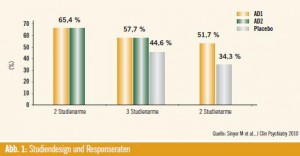
Studiendesign und Placeboeffekt: Wie der Experte weiter ausführte, habe das Studiendesign einen Einfluss auf den Placeboeffekt.
So ist die Differenz zwischen AD und Placebo bei Einsatz eines inaktiven Placebo größer als unter einem aktiven Placebo, das einige der Nebenwirkungen von AD nachahmt. Außerdem lassen sich je nach Design bei den Response – raten markante Unterschiede beobachten. Eine Untersuchung zeigte, dass die Ansprechraten auf AD in placebokontrollierten, zweiarmigen Studien bei 52 % liegen, in dreiarmigen Studien, in der zwei AD und Placebo untersucht werden, bei 58 % und in direkten Head-to-Head-Vergleichen bei 65 %6 (Abb. 1). Dieses Phänomen sei über eine Erwartungshaltung zu erklären, denn bei zweiarmigen Studien wissen Patienten und Ärzte, dass eine 50%ige Chance auf eine aktive Medikation besteht, bei dreiarmigen Studien ist die Wahrscheinlichkeit 66 %. „Der Unterschied zwischen den verschiedenen Studiendesigns ist ebenso groß wie zwischen Verum und Placebo“, unterstrich Demyttenaere.
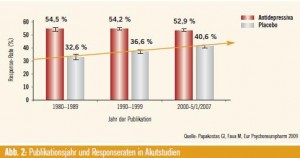
Ein weiteres Problem – nicht nur bei AD, sondern bei vielen psychotropen Medikamenten – sei, dass der Placeboeffekt im Laufe der Jahre bzw. Jahrzehnte zugenommen habe, während bei den Ansprechraten der AD kaum Veränderungen beobachtet wurden5 (Abb. 2).
Effektive Rückfallprophylaxe: Grundsätzlich bestehe kein Konsensus, welche Differenz klinisch relevant ist. Laut NICEGuidelines ist ein Unterschied von 3 Punkten im HAM-D oder eine Effektstärke ≥ 0,50 bzw. ein NNT-Wert < 10 klinisch relevant. „Aber da sich diese Diskussionen meist um Akutstudien drehen, wird dabei ein entscheidender Faktor übersehen, nämlich die Langzeitwirksamkeit von AD.“ Wie Furukawa et al.7 zeigen konnten, lässt sich das Rezidivrisiko nach einem Jahr unter AD-Behandlung im Vergleich zu Placebo um 81 % reduzieren. Nach weiteren zwei Beobachtungsjahren war der Unterschied vergleichbar stark ausgeprägt, die Risikoreduktion lag bei 77 %. Allerdings nimmt mit der Zahl der Episoden, die der Patient durchgemacht hat, auch das Rezidivrisiko zu. In einer Studie von Kaymaz et al.8 betrug die Risikoreduk – tion unter einer aktiven Medikation bei Erstmanifestation 80 %. Bei weiteren Episoden nahm der Effekt kontinuierlich ab. „Jede Episode scheint eine Narbe im Gehirn zu hinterlassen, die die Rezidivprophylaxe immer schwieriger macht“, so Demyttenaere.
Placeboeffekt und Zeitfaktor: Freilich wird der Outcome bei Depressionen nicht nur durch den pharmakologischen Effekt beeinflusst. Wenn sich der Zustand eines depressiven Patienten verbessere, so sei das auf ein Zusammenspiel von drei Faktoren – natürlicher Krankheitsverlauf, Placeboeffekt und Wirkung der aktiven Medikation – zurückzuführen. Aus biologischer Sicht gäbe es zwischen dem pharmakologischen und dem Placeboeffekt Überlappungen, da metabolische Veränderungen in bestimmten Hirnarealen sowohl nach einer erfolgreichen Behandlung mit AD als auch mit Placebo nachweisbar sind9. Placebo sei ein positiver Faktor in der Arzt-Patienten-Beziehung, meinte Demyttenaere. „Die vom Arzt verschriebene Arznei ist gleichzeitig Substanz wie auch Symbol. Je mehr der Arzt von der Wirksamkeit überzeugt ist, desto besser der Outcome.“ Ähnliches gelte auch für die Patienten.
Ebenso spielt die Zeit, die der Psychiater dem Patienten widmet, eine wichtige Rolle. Wie eine Metaanalyse mit 6-wöchigen Studien zeigte, führte bei einer Behandlung mit AD eine wöchentliche Follow-up-Untersuchung zu einer deutlichen Verbesserung im HAM-D, die umso geringer war, je mehr Untersuchungen ausgelassen wurden10. Ähnliches wurde unter Placebo beobachtet, wobei der Unterschied zwischen Placebo und Verum etwa so groß war wie wenn zwei Untersuchungen ausgelassen wurden. Ein ähnliches Muster wurde auch bei der Einstellung der Patienten zu ihrer Medikation beobachtet: Auch hier entsprach die Differenz bei den Responseraten zwischen Placebo und AD dem Unterschied zwischen einer eher positiven oder einer eher negativen Einstellung11.
Quelle: 19th European Congress of Psychiatry, State-of-the-Art Lecture Efficacy of antidepressants in depression-challenging the concepts, 13. 3. 2011, Wien
1 Turner EH et al., N Engl J Med 2008; 17;358(3):252-60
2 Cuijpers P et al, Br J Psychiatry 2010; 196(3):173-8
3 Kirsch I et al., PLoS Med 2008; 5(2):e45
4 Melander H et al., Eur Neuropsychopharmacol 2008; 18(9):623-7
5 Papakostas GI und Fava M, Eur Neuropsychopharmacol 2009; 19(1):34-40
6 Sinyor M et al., J Clin Psychiatry 2010 Mar; 71(3):270-9
7 Furukawa TA et al., Can J Psychiatry 2007; 52(9):545-52
8 Kaymaz N et al., J Clin Psychiatry 2008; 69(9):1423-36
9 Mayberg HS et al., Am J Psychiatry 2002; 159(5):728-37
10 Posternak MA, Zimmermann M, Br J Psychiatry 2007; 190:287-92
11 Demyttenaere K, Lader M et al., 2011 in press