Das metastasierte Blasenkarzinom im Wandel der Zeit: Rückblick auf ein Jahrzehnt
Changes
Forschung
Obwohl das Blasenkarzinom den zweithäufigsten urologischen Tumor darstellt (2014: 1.090 Männer und 337 Frauen in Österreich erstdiagnostiziert, Statistik Austria), wurde es in der Wissenschaft im Vergleich zum Prostatakarzinom auch im letzten Jahrzehnt immer noch sehr „stiefmütterlich“ behandelt. Durch die Zulassung des ersten Checkpoint-Inhibitors 2017 kam es jedoch zu einer radikalen Therapieerweiterung im metastasierten Status, wo bis dato die platinhaltige Chemotherapie seit 1980 das einzige Standbein war. Durch die Einführung der Immuntherapie wuchs konsekutiv auch das wissenschaftliche Interesse am Blasenkarzinom, vor allem im translationalen Bereich mit der dringenden Suche nach effektiven prädiktiven und prognostischen Biomarkern zur Identifikation jener Patienten, welche am meisten von der Immuntherapie profitieren.
Rauchen
Der Nikotinabusus ist und bleibt der wichtigste Risikofaktor für das Blasenkarzinom und ist für etwa 50 % aller Karzinome verantwortlich. Hier hat sich auch im letzten Jahrzehnt nichts verändert. In keinem Land der Welt rauchen mehr Menschen, vor allem Jugendliche, als in Österreich. In allen Statistiken liegt Österreich mit seinem Anteil an rauchenden Teenagern unangefochten auf Platz eins. Besonders besorgniserregend ist die Tatsache, dass das Einstiegsalter immer jünger wird und dass in Österreich bereits mehr Mädchen als Buben rauchen.
Im letzten Jahrzehnt kam es dennoch erfreulicherweise weiterhin zu einer kontinuierlichen Abnahme der Inzidenz, mit einer stärkeren Ausprägung bei den Frauen (Quelle: Statistik Austria). Diese Tatsache könnte sich jedoch im Laufe der kommenden zwei bis drei Dekaden deutlich ändern, wo mit einem deutlichen Anstieg der Fallzahlen an Neuerkrankungen bei Frauen gerechnet wird. Der Grund hierfür liegt im veränderten Rauchverhalten der Frauen, da vor allem die Rate an jungen Raucherinnen stetig steigt. Somit haben wir es uns auch als Urologen im letzten Jahrzehnt als großes Ziel gesetzt, im Raucher-Mekka Österreich mit diversen Info-/Antiraucher-/Aufklärungskampagnen, hauptsächlich durch den Berufsverband der Österreichischen Urologen (bvU) und die Österreichische Gesellschaft für Urologie und Andrologie (ÖGU), aber auch durch die Universitätsklinik für Urologie am AKH Wien gegenzusteuern und Raucher beim Aufhören zu unterstützen. Positiv zu verzeichnen ist das Volksbegehren „Don’t smoke“ der Ärztekammer Wien und der Österreichischen Krebshilfe mit der Forderung nach einem stärkeren NichtraucherInnenschutz in Österreich, bei dem mehr als 800.000 Unterschriften gesammelt werden konnten. Ein kleiner Lichtblick ist zudem das lang ersehnte, am 1. November 2019 in Kraft getretene generelle Rauchverbot in der Gastronomie.
Genderaspekte
Dass Männer 3 bis 4 Mal häufiger als Frauen betroffen sind, jedoch Frauen zum Zeitpunkt der Erstdiagnose zumeist ein höheres Tumorstadium und ein dadurch bedingtes schlechteres Outcome als Männer aufweisen, ist seit Jahrzehnten bekannt. Diese Ratio von etwa 3 : 1 blieb auch in Österreich im letzten Jahrzehnt nahezu konstant. Doch durch die steigende Rate an jungen Raucherinnen rechnet man weltweit mit einer Verdoppelung der Rate weiblicher Raucher im Zeitraum 2005 bis 2025, während die Anzahl der männlichen Raucher im gleichen Zeitraum abnehmen wird. Eine wichtige Erkenntnis zur genauen Ursache des höheren Tumorstadiums bei Erstdiagnose und möglichen schlechteren Prognose lieferte unter anderem als Beispiel eine österreichische Studie im Jahre 2013 (Henning et al.), mit der gezeigt werden konnte, dass das Zeitintervall zwischen der Erstmanifestation von klinischen Symptomen und der endgültigen Diagnosestellung bei Frauen signifikant länger ist. So kommt es zu einer Diagnoseverzögerung bei Frauen, da Symptome häufig als „Harnwegsinfekt“ fehlinterpretiert werden. Daraus folgt, dass Frauen weniger häufig direkt einen Facharzt für Urologie kontaktieren (55 % vs. 78 %), aber häufiger symptomatisch ohne weitere Abklärung therapiert werden (47 % vs. 19 %). Diese wichtige Erkenntnis bedeutet für unseren klinischen Alltag, dass auch Frauen mit Hämaturie und/oder therapierefraktären Miktions-/Urge-Beschwerden eine gründliche urologische Abklärung benötigen, um eine Zeitverzögerung im Falle des Vorliegens eines Blasenkarzinoms zu vermeiden!
Therapeutische Ansätze
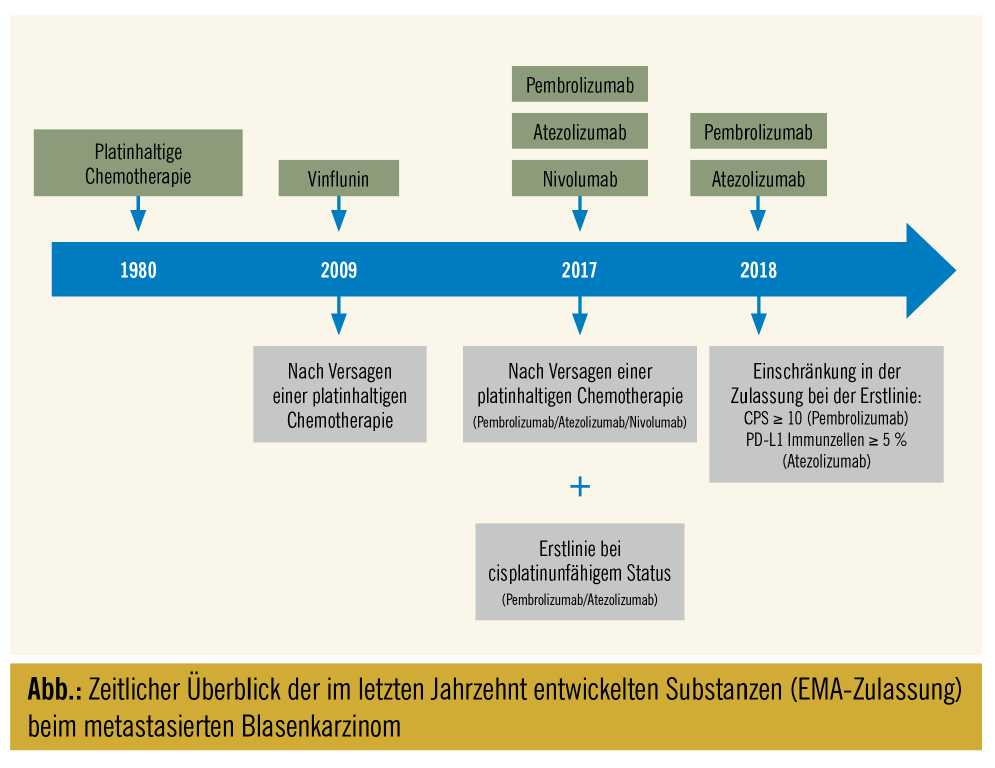
Die Therapie des metastasierten Blasenkarzinoms hat sich drastisch verändert. Seit der Einführung der platinhaltigen Chemotherapie in den 1980er-Jahren gab es eine lange Durststrecke in der systemischen Therapie, obwohl es allgemein bekannt ist, dass das mediane Gesamtüberleben auch bei Chemotherapie-Ansprechern nur zwischen 12 und 15 Monaten liegt. Das bedeutet für uns Urologen, dass wir eine lange Zeit nur wenige, zum Teil Off-Label-Substanzen hatten, welche beim platinrefraktären Patienten in der Zweitlinie zum Einsatz kamen. Im September 2009 folgte von der EMA die Zulassung von Vinflunin in der Zweitlinie. Seither herrschte wieder Stillstand in der medikamentösen Therapieentwicklung – bis zum Durchbruch der Immuntherapie (Nivolumab, Pembrolizumab und Atezolizumab) im Jahre 2017. Die genauen Indikationen der jeweiligen Substanzen werden unter „News“ präsentiert. Beim lokal fortgeschrittenen invasiven Blasenkarzinom ist die cisplatinhaltige Chemotherapie in „neoadjuvanter Intention“ vor radikaler Zystektomie zwar auch bereits seit den 1980er-Jahren bekannt, doch gewann sie vor allem im letzten Jahrzehnt zunehmend an Interesse. Die pathologische komplette Remissionsrate liegt bei 30–40 %, und dadurch kann ein 5-Jahre-Gesamtüberlebensvorteil von 5–8 % erzielt werden. Dennoch findet die neoadjuvante Chemotherapie in der klinischen Praxis leider nur eine geringe Anwendung (ca. 20 %). Ein Grund dafür ist möglicherweise das chemotherapeutische Toxizitätsprofil und die Angst der Zeitverzögerung bis zur Zystektomie bei den sogenannten Non-Respondern, da es bis dato noch keine eindeutigen prädiktiven Biomarker gibt. Ein erster Hoffnungsschimmer scheint in der molekularen Subtypisierung der invasiven Blasenkarzinome zu liegen, mit der man zeigen konnte, dass vor allem „basale“ Tumoren von der neoadjuvanten Chemotherapie profitieren.
Studies
Bezüglich der Zulassung von Checkpoint-Inhibitoren beim metastasierten Blasenkarzinom ist vor allem die KEYNOTE-045-Studie (Bellmunt et al.) zu erwähnen, da sie bis dato die einzige Phase-III-Studie ist, bei welcher der primäre Endpunkt (Gesamtüberleben) signifikant erreicht wurde. 542 Patienten mit Versagen nach platinhaltiger Chemotherapie wurden 1 : 1 randomisiert und erhielten Pembrolizumab 200 mg i. v. alle 3 Wochen oder Chemotherapie (Vinflunin/Docetaxel/Paclitaxel). Das mediane Gesamtüberleben war in der Gruppe mit Pembrolizumab signifikant besser (10,3 Monate) im Vergleich zur Patientengruppe mit Chemotherapie (7,4 Monate). In der Subgruppe von Patienten mit hoher PD-L1-Expression (CPS ≥ 10) war das mediane Gesamtüberleben 8,0 Monate in der Pembrolizumab-Gruppe versus 5,2 Monate mittels Chemotherapie. Die Rate an Nebenwirkungen (≥ Grad 3) war in der Pembrolizumab-Gruppe signifikant geringer als in der Chemotherapie-Population (15 % vs. 49,4 %). Auch die publizierten 2-Jahres-Follow-up-Daten (Fradet Y et al.) zeigen weiterhin den positiven Trend im Gesamtüberleben zugunsten von Pembrolizumab (mediane 1-Jahres- und 2-Jahres-Gesamtüberlebensrate; Pembrolizumab vs. Chemotherapie: 44,2 % und 26,9 % vs. 29,8 % und 14,3 %).Die große Notwendigkeit neuer Therapien im metastasierten Setting wird ersichtlich, wenn man bedenkt, dass Nivolumab in der Zweitlinie als Phase-II-Studie (CheckMate 275) und Atezolizumab trotz des negativen primären Endpunktes (IMvigor211) dennoch von FDA und EMA zugelassen wurde.Ein großer Kritikpunkt an den Checkpoint-Inhibitor-Studien ist die Tatsache, dass die eingeschlossenen Patienten zum Teil stark selektioniert sind und somit das Real-World-Szenario unseres klinischen Alltags nicht widerspiegeln. Diesbezüglich wird zum Schluss noch die SAUL-Studie erwähnt, welche erstmalig die Effizienz und Sicherheit von Atezolizumab in der Zweitlinie an einem Real-World-Setting untersuchte. Hier konnte gezeigt werden, dass Atezolizumab auch bei Patienten, welche normalerweise nicht in klinischen Studien eingeschlossen würden (chronische Erkrankungen, Autoimmunerkrankungen, laufende Kortisontherapie, Hirnmetastasen usw.), sehr effizient war und gut toleriert wurde.
News
Die Abbildung zeigt den zeitlichen Überblick der im letzten Jahrzehnt entwickelten Substanzen (EMA-Zulassung) beim metastasierten Blasenkarzinom.
Future
Die Immuntherapie könnte in Zukunft nicht nur wie bisher zugelassen im metastasierten Setting – als Monotherapie in der Erstlinie beim PD-L1-positiven cisplatinunfähigen Patienten bzw. PD-L1-unabhängig in der Zweitlinie – ein fixes Standbein in der Therapieplanung sein, sondern auch bei folgenden Indikationen zum Einsatz kommen:
- Beim High-Risk-nichtmuskel-invasivem Blasenkarzinom nach BCG-Versagen (Phase-III-Studien: Pembrolizumab: KEYNOTE-676/NCT03711032; Durvalumab: POTOMAC/NCT03528694),
- im neoadjuvanten Setting vor radikaler Zystektomie (Phase-II-Studien: Atezolizumab > ABACUS; Pembrolizumab > PURE-01) und
- als mögliche Kombinationstherapie mit platinhaltiger Chemotherapie (Phase-III-Studien: Atezolizumab: IMvigor130/NCT02807636; Pembrolizumab: KEYNOTE-361/NCT02853305) in der Erstlinie.
Neue zielgerichtete Therapien (Targeted Therapy) wie FGFR-Inhibitoren (Erdafitinib, Rogaratinib) oder Nectin-4-Antikörper (Enfortumab) zeigen in laufenden Phase-I/II-Studien vielversprechende objektive Ansprechraten bis 41 % beim metastasierten Urothelkarzinom als Zweit- und Drittlinientherapie nach Chemotherapie/IO-Versagen. Aufgrund der sehr guten Überlebensdaten (medianes Gesamtüberleben: Erdafitinib 13,8 Monate; Enfortumab 13,6 Monate) trotz mehrerer Vortherapien sind dementsprechende Phase-III-Studien am Laufen (NCT03390504/NCT03474107) und geben neue Hoffnung auf potenzielle Sequenztherapien, welche bis dato beim metastasierten Blasenkarzinom vollkommen fehlen.
Dennoch ist es auch hier fundamental wichtig, Biomarker zu finden, um Patienten gezielt der optimalen Sequenztherapie unterziehen zu können (BISCAY-Studie, NCT02546661).
Literatur:
-Henning A et al., BJU Int 2013; 112(1):68–73
-https://www.statistik.at/web_de/statistiken/index.htmle
-Bellmunt J et al., NEJM 2017; 376(11):1015–1026
-Sharma P et al., Lancet Oncol 2017; 18(3):312–322
-Dobruch J et al., Eur Urol 2016 Feb;69(2):300–10
-Fradet Y et al., Ann Oncol. 2019; 30(6):970–976
-Powles T et al. Lancet., 2018; 391(10122):748–757
-Sternberg CN et al., Eur Urol 2019; 76(1):73–81
-Balar AV et al. ,Lancet Oncol. 2017 Nov;18(11):1483–1492
-Balar AV et al., Lancet. 2017 Jan 7;389(10064):67–76
-Bellmunt J et al., JCO 2009 Sep 20;27(27):4454–61
-Powles T et al., Nat Med 2019; 25(11):1706–1714
-Necchi A et al., Eur Urol 2020; 77(4):439–446
-Joerger M et al., JCO 2018; 36(suppl): abstr 4513-Siefker-Radtke AO et al. JCO 2018;36(suppl): abstr 4503
-Rosenberg JE et al., JCO 2018; 36(suppl): abstr 4504
-Ming Yin et al., Oncologist 2016; 21(6):708–715-Krabbe LM et al., Can J Urol 2015; 22(4):7865–75-
Thompson RH et al., BJU Int 2014; 113(5b):E17–21
-Grossmann HB et al., NEJM 2003; 349(9):859–66
-Von der Maase M et al., JCO 2005; 23(21):4602–8
-https://dontsmoke.at -Maderbacher S. http://donko.or.at/wp-content/uploads/2018/05/SU3-_DFP.pdf-Seiler R et al., Eur Urol 2017 Oct; 72(4):544–554