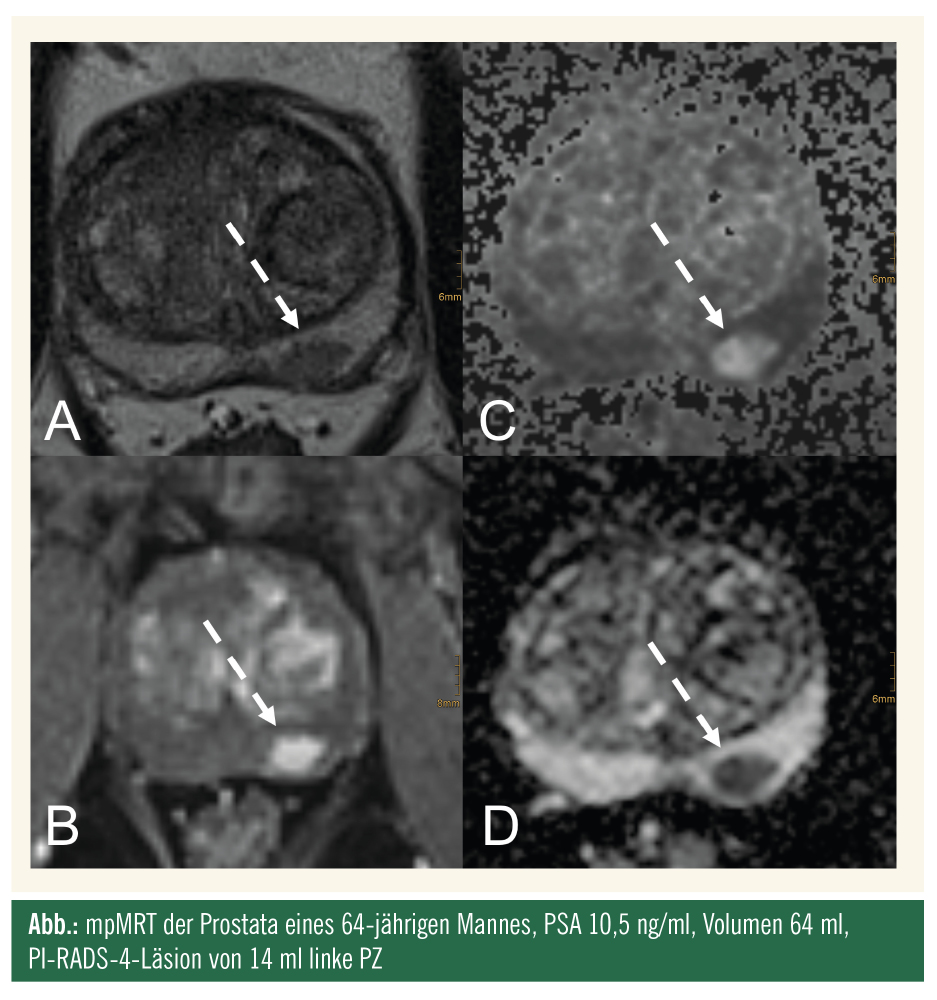
Prostatakarzinom: Screening – multiparametrische MRT oder PSA?
Rolle des PSA-Screenings: Vor über 30 Jahren wurde die Testung des prostataspezifischen Antigens (PSA) für das Prostatakrebs-Screening eingeführt.1 Dies hatte eine erhöhte Detektion von inzidentellen Prostatakrebserkrankungen und eine Reduktion von primär metastasierten Patienten zur Folge.2
Die mit dem Prostatakarzinom (PCa) assoziierte Mortalität ist in den meisten westlichen Ländern um ca. 40 % zurückgegangen.3, 4 In mehreren, auch randomisierten Studien wurde untersucht, ob das Screening auf Prostatakrebs mithilfe des PSA-Tests die Gesamt-und Prostatakrebs-Mortalität verbessert. Die methodisch verlässlichsten Daten stammen aus der European Randomized Study of Screening for Prostate Cancer (ERSPC) und weisen ein Follow-up von 13 Jahren auf.2 Basierend auf diesen Daten betrug die absolute Risikoreduktion, an einem PCa zu versterben, durch ein PSA-Screening 1,28 pro 1.000 randomisierten Männern. Die zum Screening (Number Needed to Screen, NNS) und zur Behandlung (Number Needed to Treat, NNT) benötigte Patientenanzahl nimmt mit voranschreitender Follow-up- Zeit ab. So liegt die NNT nach 13 Jahren bei 781 und NNS bei 27 Patienten.2
Hauptkritikpunkte an PSA-Screenings sind die potenziellen Überdiagnosen von klinisch indolenten PCas, die weiterhin asymptomatisch verlaufen wären, sowie das Auftreten falsch positiver Screening-Befunde.5 Bei 22–26 % der Screening-Teilnehmer wird trotz positivem PSA-Test kein Prostatakarzinom bestätigt.6
Dennoch wird die PSA-Bestimmung seitens der urologischen Gesellschaften in der EU im Hinblick auf die Reduktion der PCa-spezifischen Mortalität und der Reduktion des Auftretens von Metastasen als sinnvoll erachtet. Testungen sollten hierbei risikoadaptiert und individuell bei aufgeklärten Patienten angeboten werden. Der PSA-Wert dient somit als Baustein eines diagnostischen Gesamtkonzeptes.7
Die aktuelle Rolle der mpMRT der Prostata: Der traditionelle Diagnoseweg zur PCa-Erkennung beinhaltet zunächst eine PSA-Messung und eine digital rektale Untersuchung (DRU). Werden die Befunde als suspekt eingestuft, erfolgt eine transrektale/transperineale ultraschallgeführte Prostatabiopsie, ein eventuelles Staging (mittels CT/Knochenszintigrafie) und, wenn notwendig, eine entsprechende Therapie. Dabei zeigten Studien wie PROTECT, ERSPC und PIVOT, dass damit ein Teil der Patienten übertherapiert wird, da klinisch nicht signifikante PCas einer invasiven Behandlung zugeführt werden.2, 8–9
Der diagnostische Zugewinn einer mpMRT der Prostata konnte durch die PROMIS-Studie demonstriert werden. Die Probanden erhielten ein 1,5-Tesla-mpMRT, gefolgt von einer Template-Biopsie und einer systematischen TRUS-Biopsie.
Indexgezielte Biopsien wurden nicht durchgeführt. Klinisch signifikante Tumoren waren laut Definition PCas mit einem Gleason Score ≥ 4 + 3 oder einer Karzinomlänge ≥ 6 mm. Hierbei konnte für die MRT eine größere Sensitivität bei der Entdeckung klinisch relevanter PCas als bei der TRUS-Biopsie festgestellt werden (93 % vs. 48 %, p< 0,0001). Dabei war die mpMRT mit 41 % im Vergleich zur TRUS-Biopsie mit 96 % weniger spezifisch (p < 0,0001).10
In der PRECISION-Studie wurden 500 Männer mit Verdacht auf PCa in zwei Gruppen randomisiert. Eine Gruppe erhielt eine mpMRT, die andere eine systematische Stanzbiopsie der Prostata.11 Bei 38 % der Männer in der MRT-Kohorte wurde ein klinisch signifikantes PCa festgestellt. In der Standard-Biopsie- Gruppe waren es 26 % (p = 0,005). Das MRT-Ergebnis eines nichtsuspekten PI-RADS-Score ≤ 2 führte zu einer Reduktion von Biopsien in fast 28 % der Fälle. Allerdings wurden MRT-negative Patienten nicht biopsiert, weswegen das eventuelle Übersehen klinisch relevanter PCas nicht ausgeschlossen werden kann.11 Eine Metaanalyse von Kasivisvanathan et al. konnte die bisherigen Ergebnisse bestätigen. Mit der MRT-gesteuerten Prostatabiopsie können mehr klinisch signifikante Tumoren entdeckt und zeitgleich klinisch insignifikante seltener diagnostiziert werden.12 In der prospektiven Multicenter-Studie MRI-FIRST wurde die Frage untersucht, ob eine mpMRT die Diagnose klinisch signifikanter PCas steigert und ob eine systematische Prostatabiopsie zusätzlich zur gezielten Biopsie notwendig ist.13 Ein klinisch signifikantes PCa wurde bei 94 (37 %) von 251 Patienten nachgewiesen. 14 % dieser 94 Patienten wurden nur durch systematische Biopsie diagnostiziert, 20 % nur durch gezielte Biopsie und 66 % durch beide Techniken. Durch die Kombination beider Techniken wurden signifikant mehr GS-4+3-Karzinome und weniger Tumoren geringerer Gleason-Grade diagnostiziert. Laut einer 2019 veröffentlichten Meta-Analyse, die 56 Studien inkludierte, konnte in diesem Zusammenhang gezeigt werden, dass eine systematische Biopsie, ergänzend zu einer mpMRT-gezielten Probeentnahme, die Detektion von signifikanten PCas um 13 % steigert.12 Die mpMRT hat einen negativen Vorhersagewert (NPV) von 85–95 %, was dazu führt, dass mit dieser Technik allein 5–15 % klinisch signifikante PCas nicht diagnostiziert werden. Zusätzlich zur MRT können Patientenfaktoren und biochemische Marker verwendet werden, um eine Entscheidung für oder gegen eine Biopsie zu treffen. Eine Meta-Analyse von Pagniez et al., die 8 Studien mit insgesamt 1.015 Patienten inkludierte, zeigte, dass eine PSA-Density (PSA-D) < 0,15 ng/ml/ml kombiniert mit einer unauffälligen MRT der nützlichste Faktor ist, um Männer ohne klinisch signifikante PCas zu identifizieren. In Kombination mit PSA-D stieg der Gesamt-MRT-NPV von 84,4 % auf 90,4 %.14
MRT-basiertes Prostatakrebs-Screening: Die mpMRT hat sich zu einem zentralen Element in der Initialdiagnostik des Prostatakarzinoms entwickelt. Bislang gibt es wenige Daten zum PCa- Screening mittels mpMRT ohne eine vorherige Erhebung des PSA-Wertes. Nam et al. führte hierzu eine Pilotstudie durch, um die Anwendbarkeit eines mpMRT als Screening Tool zu evaluieren.15
Bei dieser Studie wurden 50 Männer unselektiert inkludiert, von denen 47 das Studienprotokoll beendeten. Bei allen Männern wurden ein mpMRT, Serum- PSA-Tests, DRU und systematische (+/– gezielte) Prostata-Biopsien durchgeführt. Klinisch signifikante PCas wurden bei 18 von 47 Männern (38,3 %) festgestellt. Der Anteil der PCas erscheint hoch, verglichen mit der Inzidenz von ca. 10 % der veröffentlichten Registerdaten.16 Zusammen mit der Rekrutierungsart (Zeitungsanzeige) weist dies auf einen ausgeprägten Selektionsbias der Studienteilnehmer hin. Die mpMRT (AUC 0,81; 95%-KI: 0,67–0,94) übertraf den PSA-Wert (AUC 0,67; 95%-KI: 0,52–0,84) bei der PCa-Vorhersage signifikant (p < 0,05). In der multivariablen Analyse, einschließlich Alter, DRU-Ergebnis und PSA, war die mpMRT der einzige signifikante Prädiktor für das Vorhandensein eines PCa. Dies galt insbesondere für die Vorhersage von klinisch signifikanten PCas. Aufgrund der vielversprechenden Ergebnisse innerhalb dieser Kohorte wurde 2016 in Kanada eine groß angelegte randomisierte Studie initiiert. Hierbei soll die Detektionsrate klinisch signifikanter PCas durch eine mpMRT vs. PSA-Screening evaluiert werden. Entsprechende Ergebnisse werden ab Juni 2020 erwartet.17 Die mpMRT als Routine-Screening bringt neben der noch ausstehenden Evidenz zum jetzigen Zeitpunkt einige Nachteile mit sich. Die Untersuchung ist zeitaufwendig und kostenintensiv und dementsprechend von limitierter Verfügbarkeit. Eine mpMRT kombiniert MRT-Techniken, welche physiologische Gewebeeigenschaften erfassen. Zu den funktionellen Parametern zählen die dynamische kontrastmittelverstärkte („dynamic contrast-enhanced“, DCE-MRT) und die diffusionsgewichtete („diffusion-weighted imaging“, DWI) Bildgebung. Die wassersensitive T2w-Sequenz erlaubt dabei eine morphologische Organbeurteilung. Die Dauer eines vollständigen multiparametrischen Protokolls liegt bei etwa 20 Minuten.18 Im Vergleich zum mpMRT-Protokoll wird bei der sogenannten biparametrischen MRT der Prostata auf die DCE verzichtet, was neben einer Messzeitverkürzung Invasivität und Kosten der Kontrastmittelgabe vermeidet. Die zusätzliche Reduktion der sagittalen und koronaren Akquisition der T2-Sequenzen führt zu einer weiteren Zeitersparnis.19 Diesbezüglich präsentierte Barentsz et al. 2019 auf dem Kongress der European Association of Urology (EAU) eine zeitlich verkürzte MRT-Technik. Diese von Barentsz als „Manografie“ bezeichnete Technik dauert lediglich acht Minuten. Die in diesem Zusammenhang veröffentlichte Studie verglich die diagnostische Performance eines monoplanaren schnellen bpMRT, eines triplanaren bpMRT und eines multiparametrischen MRT. Das Kollektiv umfasste insgesamt 626 biopsienaive Männer mit einem PSA ≥ 3. Die zuvor durchgeführte MRT-Befundung erfolgte verblindet durch zwei Radiologen. Anschließend wurde eine ultraschallgesteuerte Prostatabiopsie durchgeführt. Männer mit verdächtigen Läsionen (PI-RADS ≥ 3) erhielten darüber hinaus eine MRT-gestützte In-Bore-Biopsie. Für alle Protokolle wurde eine Sensitivität für High-Grade-PCas von 95 % angegeben. Die Spezifität lag bei 65 % für die schnelle bpMRT und 69 % jeweils für bpMRT und mpMRT. Mit der schnellen bpMRT wurden ca. 1 % mehr niedriggradige PCas überdiagnostiziert.
Eine Biopsie konnte in 47 % für die schnelle bpMRT und in 49 % für die triplanen bpMRT- und mpMRT-Protokolle vermieden werden.20 Kritisch anzumerken ist, dass die aktuelle PI-RADS-v2.1-Klassifikation der Kontrastmittelgabe (DCE-Sequenz) nur eine geringe Bedeutung beimisst, wodurch der potenzielle Wert der DCE-Technik in solchen Vergleichsstudien methodisch bedingt unterschätzt wird.
Resümee: Grundsätzlich ist die MRT der Prostata, wie jeder diagnostische Test, nicht perfekt. Aufwand und Kosten rechtfertigen die alleinige Anwendung nicht. Mögliche falsch-positive und falsch-negative Befunde erfordern die Integration der Methode in den gesamten urologischen Rahmen in Zusammenschau aller Befunde und klinischen Aspekte. Angesichts der Kritik am PSA-Screening sollte das Ziel zukünftiger Screening-Strategien ein Ausbleiben der Überdiagnose und eine exzellente Erkennung aggressiver Tumoren sein. Die Kombination von mpMRT und PSA-Messung erscheint hier nach derzeitiger Datenlage vielversprechend.