UV-Strahlung und Hautmikrobiom
Die Haut wird von einer Vielzahl unterschiedlicher Mikrobiomen besiedelt, welche an verschiedenen molekularen und zellulären Prozessen innerhalb der Haut und darüber hinaus beteiligt sind. Es ist bekannt, dass UV-Strahlung tiefgreifende Veränderungen in der Haut hervorruft und die Immunantwort moduliert. Die Rolle des Mikrobioms bei der UV-induzierten Immunsuppression wurde jedoch übersehen.
Durch die Anwendung des Standardmodells der Kontaktüberempfindlichkeit (contact hypersensitivity CHS) unter Verwendung keimfreier Mäuse zeigten sich eine verminderte UV-induzierte systemische Immunsuppression in Gegenwart von Mikroorganismen. Unter UV-Exposition fanden wir eine verstärkte epidermale Hyperplasie und eine neutrophile Infiltration sowie eine erhöhte Anzahl von Mastzellen und Monozyten sowie Makrophagen in der Haut in Abwesenheit des Mikrobioms. Die Transkriptomanalyse zeigte eine vorherrschende Expression von Zytokinen, die mit dem proinflammatorischen Milieu in Anwesenheit von Mikroorganismen in Verbindung stehen, im Vergleich zu einem immunsuppressiven Milieu (mit erhöhtem Interleukin-10) in Abwesenheit von Mikroorganismen. Insgesamt hebt das Mikrobiom die immunsuppressive Reaktion auf UV durch Modulation der Genexpression und der zellulären Mikroumgebung der Haut auf.
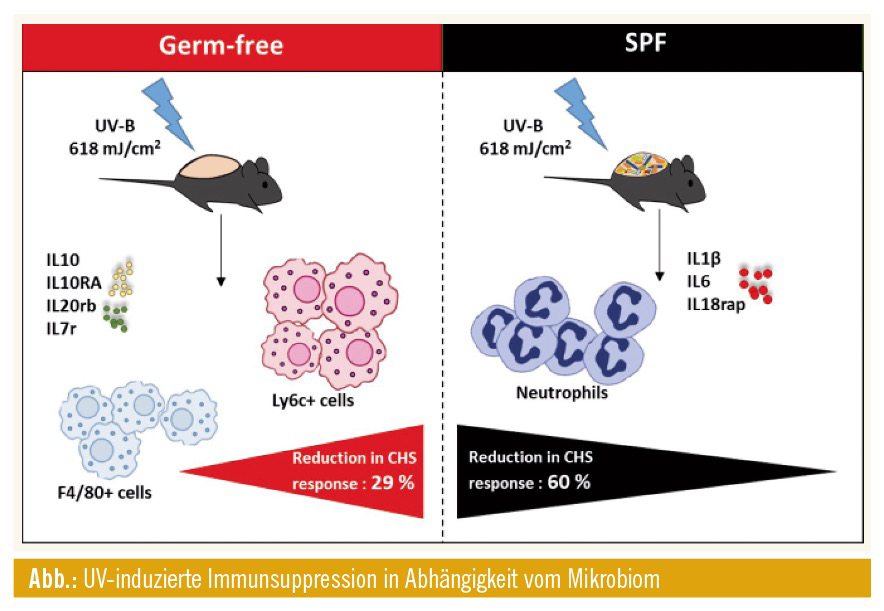
Hautmikrobiom schützt vor UV-induzierter Immunsuppression der adaptiven Immunantwort: UV-B hemmt bekanntlich die CHS-Reaktionen auf Haptene wie Dinitrofluorbenzol (DNFB). Die Rolle des Hautmikrobioms bei dieser Induktion der Immunantwort wurde jedoch noch nicht untersucht. Wir bestrahlten keimfreie Versuchstiere (KF) und Kontrolltiere (spezifisch pathogenfrei, SFP) auf der rasierten dorsalen Haut (Ohren mit schwarzem Isolierband abgedeckt) mit einer Dosis von 618 mJ/cm2 (entspricht zwei minimalen Entzündungsdosen). Drei Tage später wurden die Mäuse am Bauch mit 0,5 % DNFB und 5 Tage später mit 0,2 % DNFB an den Ohren sensibilisiert. Die Hautdicke wurde vor und nach der Sensibilisierung gemessen, und die CHS-Reaktion (bestimmt durch die Hautschwellung) wurde für die verschiedenen Versuchsgruppen berechnet.
KF-Mäuse zeigten im Vergleich zu SPF-Mäusen eine signifikant reduzierte CHS-Reaktion (28,6 % gegenüber 59,5 %). Diese Ergebnisse zeigen, dass das Fehlen von Hautmikroorganismen zum Zeitpunkt der UVB-Exposition die Immunsuppression verstärkt. Das Vorhandensein des Hautmikrobioms hemmte die UV-induzierte Unterdrückung der Induktion von CHS bei SFP-Mäusen, die vor der Sensibilisierung mit DNFB UV-B ausgesetzt waren.
Die lokale molekulare und zelluläre Regulation der Haut nach UV-Exposition unterscheidet sich zwischen GF und SPF: UV-Exposition führt zu einer Reihe von zellulären Veränderungen innerhalb der Haut und zu einer systemischen Immunsuppression, die durch die Freisetzung verschiedener immunsuppressiver Mediatoren (wie IL-10) und die Infiltration von Immunzellen wie Monozyten und Makrophagen in die Haut vermittelt wird. Um die zellulären und molekularen Ereignisse, die früh nach der UV-Exposition auftreten, besser zu verstehen, entnahmen wir 24 Stunden nach der Exposition Gewebeproben aus der UV-bestrahlten dorsalen Haut von KF- und SFP-Mäusen und Analysen führten mittels Microarray, Histologie und Immunhistochemie durch. Diese Analysen zeigten, dass das Vorhandensein des Mikrobioms die UV-induzierte Genexpression in der Haut signifikant beeinflusst. Insgesamt zeigten KF-Mäuse eine signifikant erhöhte Expression von immunsuppressiven Zytokinen wie IL-10, während SPF-Mäuse eine erhöhte Expression von proinflammatorischen Zytokinen wie IL-1β zeigten. Diese Ergebnisse deuteten darauf hin, dass UV-B bei der Regulierung der Genexpression je nach Hautmikrobiom unterschiedlich wirkt. Darüber hinaus zeigten immunhistochemische Färbungen, dass die UV-Exposition der Haut in Abwesenheit des Mikrobioms zu einer entzündungshemmenden Umgebung mit vermehrten Mastzellen, Monozyten sowie Makrophagen und einer IL-10-Expression führt, die an der Immunsuppression beteiligt ist. Auf der anderen Seite führt die UV-Exposition zu einer proinflammatorischen Umgebung mit erhöhter epidermaler Reaktion und neutrophiler Infiltration und IL-1β-Expression in Gegenwart des Mikrobioms.
Zusammenfassend deuten unsere Ergebnisse darauf hin, dass das Vorhandensein von Mikroorganismen die Reaktion der Haut auf UV-B-Exposition orchestriert.