Herz- und Niereninsuffizienz
Der bidirektionale Zusammenhang zwischen Herzinsuffizienz und eingeschränkter Nierenfunktion ist seit langem bekannt. Das akute Nierenversagen als Folge einer akuten Herzinsuffizienz wird mittlerweile als kardiorenales Syndrom (CRS) Typ I, die progrediente Niereninsuffizienz bei chronischer Herzinsuffizienz (CHF) als CRS Typ II klassifiziert. Etwa ein Drittel der stationären Aufnahmen wegen akuter Herzinsuffizienz sind durch eine akutes Nierenversagen verkompliziert, was eine 3-fache Verlängerung der Aufenthaltsdauer, eine höhere Wahrscheinlichkeit für eine Wiederaufnahme und eine ca. 20 % höhere Mortalitätsrate zur Folge hat. Bei chronischer Herzinsuffizienz beträgt die Prävalenz einer Nierenfunktionseinschränkung (GFR < 60 ml/min/1,73 m2) in Abhängigkeit vom Schweregrad der Erkrankung zwischen 35–57 %. Eine reduzierte glomeruläre Filtrationsrate (GFR) ist ein unabhängiger und verlässlicher Prädiktor der Prognose. Bereits eine geringfügige Einschränkung der GFR von 45–60 ml/kg/1,73 m2 hat eine signifikante Zunahme der Mortalität zur Folge. Die Entwicklung einer Nierenfunktionseinschränkung weist somit auf eine Progression des Herzinsuffizienz-Syndroms hin. Damit sind die therapeutischen Ziele vorgegeben: Prävention des CRS einerseits und Verzögerung der Progression des bereits manifesten CRS andererseits.
Besonderheiten der Pharmakotherapie
Diese Therapieziele können am besten mit einer leitliniengerechten Therapie der Herzinsuffizienz (= entsprechende Diät, neurohumorale Therapie, Diuretika und gegebenenfalls CRTImplantation) erreicht werden. Die Pharmakotherapie des CRS kann den klinisch tätigen Arzt allerdings vor eine Reihe von Problemen stellen:
1. Blockade des RAAS (Renin-Angiotensin- Aldosteron-System) ja oder nein und wenn ja, wie?
2. Diuretikadosis hoch oder niedrig und was tun bei Diuretikaresistenz?
3. Neue Therapeutika am Horizont?
RAAS-Blockade (ACE-I, ARB, Aldosteron-Antagonisten) bei CRS? Die kompensatorische Aktivierung des sympathoadrenergen Systems (SAS) und des RAAS gelten als die wichtigsten Mediatoren des CRS. Tatsächlich senken ACEI/ ARB und Betablocker nachweislich die Mortalität bei CHF. Allerdings waren in den meisten CHF-Studien Patienten mit eingeschränkter Nierenfunktion (Kreatinin ≥ 2,5 mg/dl) ausgeschlossen. Während die RAAS-Blockade einen langfristig protektiven Effekt sowohl auf die Niere als auch auf das Herz ausübt, kommt es kurzfristig zu einem Abfall der GFR. Die Dilatation an der abführenden Arteriole (Vas efferens) des Glomerulums durch ACE-I/ARB kann zu einem klinisch relevanten Anstieg von Serumkreatinin und Kalium führen, was durch die zusätzliche Gabe von Aldosteronantagonisten noch verstärkt wird und im Einzelfall bis zum dialysepflichtigen Nierenversagen bzw. Tod führen kann. Die unkontrollierte Verabreichung von Spironolakton nach Veröffentlichung der RALES-Studie hat besonders in Kombination mit ACE-I/ARB zu einem deutlichen Anstieg von Krankenhausaufnahmen und Todesfällen wegen Hyperkaliämie geführt. Andererseits ist bekannt, dass auch Patienten mit einem deutlich erhöhtem Serumkreatinin (2,0– 3,4 mg/dl) noch von einem ACE-I profitieren. Dabei ist es beruhigend zu wissen, dass laut einer Metaanalyse entsprechender Studien selbst ein Kreatininanstieg von bis zu 30 % unter ACE-I noch langfristig protektiv für die Niere ist.
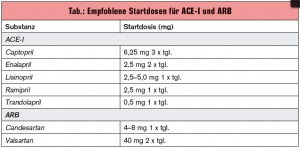
Aufgrund dieser Daten sollte Patienten mit chronischer Herzinsuffizienz eine Therapie mit RAAS-Antagonisten und Betablockern selbst bei eingeschränkter Nierenfunktion nicht vorenthalten werden. Es empfiehlt sich ein vorsichtiger Therapiebeginn mit niedriger Dosierung (tab.) und langsamer Dosistitration bis zu einem Kreatininanstieg von maximal 30 % (absolut < 3,0 mg/dl) bzw. einem Kaliumspiegel ≤ 5,6 mmol/l. Bei Kreatininwerten zwischen 3,0–3,5 mg/dl ist die Halbierung der Dosis, bei > 3,5 mg/dl ein Therapieabbruch erforderlich. Die erste Laborkontrolle ist eine Woche nach Therapiebeginn sinnvoll. Weitere Kontrollen sind, abhängig vom Ausgangswert, in 2- bis 3-wöchigem Abstand innerhalb der ersten 2 Monate ratsam. Eine Reduktion der Diuretikadosis erleichtert in der Regel die Dosissteigerung. Aldosteronantagonisten sollten Patienten mit Kreatinin ≤ 5,0 mmol/l vorbehalten bleiben.
Was tun bei Diuretikaresistenz? Diuretika spielen zweifellos eine große Rolle in der Therapie der Herzinsuffizienz. Intensität bzw. Dosierung der Therapie sind jedoch Gegenstand anhaltender Kontroversen. Höhere Dosen von Schleifendiuretika fuhren vielfach zu einem Kreatininanstieg und sind mit erhöhter Morbidität und Mortalität assoziiert, was auf eine neurohumorale Aktivierung sowie die ungünstigen Effekte auf Elektrolythomöostase und Herz- und Nierenfunktion zurückgeführt wird. Die Schwierigkeit der richtigen Dosiswahl ergibt sich somit aus der Tatsache, dass Kreatininanstieg und neurohumorale Aktivierung eine möglichst niedrige Dosis nahelegen, während Volumenüberladung und venöse Stauung jedoch eine höhere Dosis erfordern. Besonders beim CRS Typ I ist daher ein subtiles Volumenmanagement erforderlich, welches eine engmaschige Überwachung von Harnausscheidung, zentralvenösem Druck und gegebenenfalls Herzminutenvolumen notwendig macht.
Sowohl bei CRS Typ I als auch bei Typ II kann sich eine Resistenz gegenüber Diuretika entwickeln. Unzureichende Medikamentendosis, uberma.ige Natriumzufuhr, verzögerte intestinale Aufnahme und/oder Exkretion des Medikaments in den Harn oder vermehrte Natriumwiederaufnahme an Diuretikainsensitiven Nephronabschnitten kommen als Ursache in Frage. Auch NSAR können über eine Hemmung der Prostaglandinsynthese die Wirkung von Diuretika abschwächen.
Bei der Festlegung der optimalen Diuretikatherapie sind daher folgende Faktoren zu berücksichtigen:
• Die effektive Einzeldosis muss individuell bestimmt werden. Für Diuretika existiert keine lineare Dosis-Wirkungs-Beziehung. Die Medikamentenwirkung tritt erst ein, wenn eine Schwellenkonzentration im Harn erreicht wird. Fuhrt die gewahlte Einzeldosis nicht zu vermehrter Diurese, ist daher eine Erhöhung der Einzeldosis und nicht die mehrmals tagliche Verabreichung der Ausgangsdosis sinnvoll.
• Vermehrte Natriumzufuhr kann den Diuretikaeffekt zunichte machen; daher: Kochsalzrestriktion!
• Bei Schleifendiuretika ist ein Rebound- Phänomen zu beobachten, d. h. nach Abnahme der Konzentration des Diuretikums im Harn kommt es zu einer Antinatriurese und damit zu einer Wasserretention. Aus diesem Grund empfiehlt sich eine 2-mal tägliche Verabreichung (1. Dosis morgens nuchtern, 2 Dosis nachmittags).
• Bei schwerer Stauung ist initial eine parenterale Verabreichung sinnvoll, um so die intestinale Resorptionsstörung zu umgehen.
• Sofern sehr hohe intravenöse Einzeldosen (> 80 mg) erforderlich sind, um eine ausreichende Diurese zu erreichen, sollten diese langsam uber 30–60 Minuten verabreicht werden, um das Risiko einer Ototoxizitat zu minimieren.
• Die Bioverfügbarkeit von Furosemid ist besonders bei fortgeschrittener Stauung extrem variabel. Substanzen mit konstanter Bioverfügbarkeit wie Torasemid sind daher in dieser Situation zu bevorzugen.
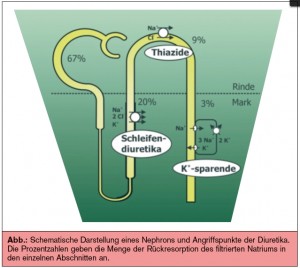
• Die Effektivität von Diuretika kann zusätzlich verstärkt werden, indem man die Natriumreabsorption an unterschiedlichen Abschnitten des Nephrons blockiert. Eine „sequenzielle Nephronblockade“ kann durch die Kombination eines Schleifendiuretikums mit einem Thiazid und eventuell einem zusätzlichen Aldosteronantagonisten erreicht werden.
• Cave: NSAR. Inwieweit bei Patienten mit akuter Herzinsuffizienz eine kontinuierliche Diuretikatherapie einer Bolustherapie überlegen ist, kann derzeit nicht endgültig beantwortet werden. In einer kürzlich von Felker et al. im NEJM publizierten Studie fand sich kein relevanter Unterschied zwischen beiden Strategien. Nachdem diese
Studie jedoch nicht unumstritten ist, bleibt hier allerdings noch Raum für Diskussion.
Bei therapierefraktärer Diuretikaresistenz stellt die Ultrafiltration eine kurzfristige, die chronische Peritonealdialyse eine langfristige Therapieoption dar.
Neue Therapeutika am Horizont? Vasopressinantagonisten (Vaptane) blockieren V2-Rezeptoren am distalen Tubulus und am Sammelrohr und bewirken somit eine vermehrte Wasserausscheidung ohne gleichzeitigen Elektrolytverlust. Damit unterscheiden sie sich von herkömmlichen Diuretika, was besonders bei Vorliegen einer Hyponatriämie von Vorteil ist. Allerdings konnten bisherigen Studien keinen nachhaltigen klinischen Vorteil für diese Subs tanzklasse zeigen. Die tatsächliche Bedeutung dieser Substanzklasse ist daher zum jetzigen Zeitpunkt noch unklar und ein routinemäßiger Einsatz nicht gerechtfertigt.
Adenosin wird in der Macula densa als Reaktion auf eine Diuretika-induzierte Blockade der Natrium- und Chloridwiederaufnahme vermehrt gebildet und bewirkt eine Konstriktion der zuführenden Arteriole (Vas afferens) am Glomerulum und damit eine Reduktion der GFR. Die gezielte Blockade von A1-Adenosin-Rezeptoren erscheint daher erfolgversprechend bei CRS. Die bislang vorliegenden Ergebnisse aus klinischen Studien erlauben jedoch noch keine endgültige Beurteilung.
FACT-BOX
• Eine Einschränkung der Nierenfunktion bei Herzinsuffizienz ist häufig und zeigt eine ungünstige Entwicklung der Erkrankung an.
• ein Kreatininanstieg von ≤ 30 % und/ oder ein Kaliumanstieg ≤ 5,6 mg/dl unter ACE-Hemmer oder Angiotensinrezeptorantagonisten ist tolerabel und sollte zu keinem Therapieabbruch führen. die Vorteile der Therapie überwiegen in diesem Fall die Nachteile.
• Das Auftreten einer Diuretikaresistenz ist mulitfaktoriell bedingt. in diesem Fall stehen verschiedene Möglichkeiten zur Verfügung, über deren Einsatz im Einzelfall individuell zu entscheiden ist.