Die neue Ära der Therapie der chronischen Hepatitis C
Therapie für bisher unbehandelte Patienten
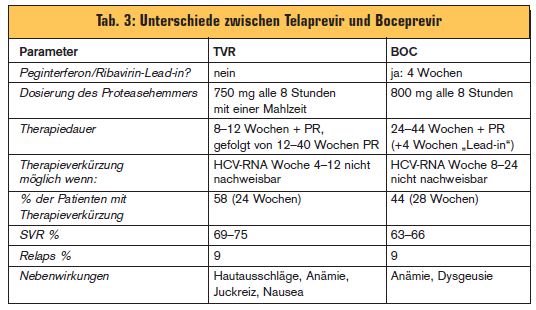
Für die Zulassung wurden zwei Phase-III-Studien mit Telaprevir (Incivo®) und eine mit Boceprevir (Victrelis®) durchgeführt (> Tab. 1). Eine Zusammenfassung der Phase-III-Studienergebnisse mit DAA bietet > Tab. 2. Die Unterschiede zwischen den Substanzen sind in > Tab. 3 gelistet.
Telaprevir: In der ADVANCE-Studie wurde Telaprevir in Kombination mit Peginterferon/Ribavirin (PegIFN/RBV) 8 oder 12 Wochen lang gegeben, gefolgt von weiteren 12-16 Wochen PegIFN/RBV, die Gesamttherapiedauer betrug somit 24 Wochen. Bei Patienten mit Extended Rapid Virologic Response (eRVR) (HCV-RNA nach Woche 4 und 12 Wochen nicht nachweisbar) wurde die Therapie nach 24 Wochen beendet, Patienten ohne eRVR wurde für weitere 24 Wochen PegIFN/RBV verabreicht (Gesamttherapiedauer 48 Wochen). In der anderen Phase-III-Studie (ILLUMINATE) brachte
eine Verlängerung der Therapiedauer auf 48 Wochen keinen zusätzlichen Benefit. Allerdings wurde in einer der Phase-II-Studien (PROVE 2) in einer Gruppe bereits nach 12 Wochen die Tripletherapie beendet, die Heilungsraten waren nicht unterschiedlich von der
24-Wochen-Gruppe.
Boceprevir: Für Boceprevir wurde nur eine Phase-III-Studie durchgeführt (SPRINT-2). Alle Patienten erhielten zunächst PegIFN/RBV für 4 Wochen (“Lead-in”): eine Gruppe erhielt Boceprevir + PegIFN/RBV für 44 Wochen (Gesamttherapiedauer: 48 Wochen), bei der zweiten Gruppe konnte bei Patienten mit eRVR (HCV-RNA von Woche 8 bis Woche 24 nicht nachweisbar) die Therapie nach 28 Wochen beendet werden. Wie zu erwarten hatten Patienten, die nach 4 Wochen bereits negativ waren (RVR), auch unter der Standardtherapie die gleich hohen Ansprechraten wie jene, die ab Woche 4 eine Tripletherapie bekamen.
Therapieversager auf Vortherapie mit PegIFN/RBV
Durch die derzeitige Standardtherapie mit PegIFN/RBV kann etwa die Hälfte der
Patienten mit Genotyp 1 geheilt werden. Es gibt mehrere Ursachen für ein Therapieversagen: entweder war die Therapie zu kurz, die Medikamenteneinnahme ungenügend oder der Patient ist Interferon-resistent (z. B. Träger des IL28B-SNP-T-Allels). Im Prinzip gibt es drei verschiedene Arten von Non-response auf eine Therapie mit Peginterferon/ Ribavirin (> Tab. 4).
In der Nonresponder-Studie mit Telaprevir (REALIZE) wurde das Ansprechen auf die Vortherapie erhoben und die Patienten entsprechend ausgewertet. Außerdem erhielt eine Gruppe ein 4-wöchiges “Lead-in” mit PegIFN/RBV. Alle Patienten erhielte TPV für 12 Wochen und wurden insgesamt 48 Wochen lang behandelt.
In der Studie mit Boceprevir (RESPOND-2) wurden die Patienten entweder als Relapser oder als Nonresponder gemäß dem Ansprechen auf die “Lead-in”-Periode ( 1 log-Abfall) klassifiziert. Die Therapiedauer war 36 (Patienten mit eRVR) oder 48 Wochen.
Neue Probleme bei der Tripletherapie
DAA-resistente Virusmutanten: Eine der gefürchteten Folgen von Medikamenten, die eine virale Replikation hemmen, ist das Auftreten von Virusresistenzen. Bei DAA ist die Diskussion über die Entstehung und klinische Bedeutung dieser Mutanten nicht abgeschlossen. Testungen von Virusklonen vor der Therapie zeigen, dass Virusmutanten bereits vor der Gabe von DAA bei einigen Fällen nachweisbar sind. Eine verminderte
Interferonsensitivität (z. B. IL28B TT) oder eine unregelmäßige Medikamenteneinnahme
begünstigen die Entstehung und Vermehrung solcher Mutanten. Langzeitdaten zeigen aber, dass nach einigen Monaten die Virusmutanten verschwinden (oder nicht mehr nachweisbar sind) und daher eine Gabe von DAA der 2. Generation nicht beeinflussen. Um das Auftreten von Mutanten frühzeitig zu verhindern, wird die Gabe von DAA frühzeitig beendet, wenn Restviren noch vorhanden sind (“futility rule”: TPV-Viruslast > 1.000 IU/ml nach 4 Wochen, BOC: Viruslast >100 IU/ml nach 12 Wochen).
Vorsichtshalber sollten nicht-zirrhotische Patienten mit schlechter Ausgangsprognose für ein Ansprechen (hohe Viruslast, IL28B-T-Allel-Träger, Non-Responder auf Vortherapie) derzeit nicht mit DAA behandelt werden, da in den nächsten Jahren potentere antivirale Substanzen auf den Markt kommen werden. Bei Patienten mit Zirrhose sind die “futility rules” unbedingt zu beachten.
Nebenwirkungen: Beide DAA haben zusätzlich zu den bekannten Nebenwirkungen von PEG/RBV unangenehme Nebeneffekte. Bei TPV steht die Hautproblematik im Vordergrund. Bis zu 50% der Patienten klagen über Juckreiz und Ausschläge. Besonders unangenehm ist der perianale Juckreiz, manchmal assoziiert mit blutigen Durchfällen. Bei etwa 3% muss die Therapie wegen der Hautproblematik abgebrochen werden. Vom Hersteller wird eine ausführliche Information über die Prophylaxe und Therapie der Hauterscheinungen zur Verfügung gestellt. Eine weitere Nebenwirkung ist die Verstärkung der Anämie.
BOC führt bei 40% der Patienten zu einer therapiebedürftigen (Erythropoetingabe oder Bluttransfusionen) Anämie. Derzeit laufen Studien, ob durch eine Reduktion der Ribavirin-Dosis ohne Verminderung des Therapieerfolges die Anämie beherrscht werde kann. Eine weitere unangenehme, aber nicht gefährliche Nebenwirkung ist eine Dysgeusie.
Medikamenteninteraktionen: Telaprevir wird über das Cytochrom P450 (CYP3A) abgebaut, wobei es sowohl als Inhibitor als auch als Induktor von CYP3A fungiert. Die klinisch wichtigsten Medikamenteninteraktionen ergeben sich daher mit Benzodiazepinen, Immunsuppressiva (Spiegel von Cyclosporin A werden etwa 10-fach erhöht, von Tacrolimus 70-fach), Anti-HIV-Medikamenten (Ritonavir, Efavirenz) und oralen Antikonzeptiva (verminderte Wirkung).
Wer soll derzeit DAA erhalten?
- Die zweifelsohne beste Indikation sind Relapser auf eine Vortherapie mit PegIFN/RBV. Sie habe eine bis zu 90%ige Chance auf Heilung.
- Bei der Erstbehandlung gibt es keine klaren Richtlinien. Patienten, die nach einer “Lead-in”-Therapie mit PegIFN/RBV über 4 Wochen (lt. Zulassung für BOC) HCV-RNA-negativ sind, brauchen keine DAA (eine “Lead-in”-Periode für TPV ist in der Zulassung nicht vorgesehen, sollte aber gefordert werden). Alle anderen Patienten sollten nach 4 Wochen zusätzlich ein DAA bekommen. Unklar ist, ob der IL28B-Genotyp zur Therapieentscheidung herangezogen werden soll.
- Patienten mit milder Fibrose können im Grunde auf die in Entwicklung befindlichen antiviralen Substanzen warten.
- Patienten mit Leberzirrhose und Non-response auf eine Vortherapie haben theoretisch den größten Benefit, aber das schlechteste Ansprechen (für TPV 14%, für BOC liegen keine Daten vor)
- Partielle Responder/Nonresponder ohne Zirrhose – je nach Dringlichkeit (siehe oben).
Wer soll nicht mit DAA behandelt werden?
- Patienten mit Genotyp 2-6
- Patienten nach Lebertransplantation (cave: Medikamenteninteraktionen!)
- Patienten mit dekompensierter Leberzirrhose
Detailinformationen zur Durchführung der Tripletherapie können in Kürze über die Webseite der Österreichischen Gesellschaft für Gastroenterologie und Hepatologie (ÖGGH) www.oeggh.at abgerufen werden.
Neuentwicklungen
Die Forschung auf dem Gebiet der Therapieverbesserung der chronischen Hepatitis C schreitet rasant fort. Die neuen Ergebnisse, die im Rahmen der US-Lebertagung in San Francisco (AASLD) vorgestellt wurden, lassen erwarten, dass die erste Generation der Proteasehemmer bald durch die in Untersuchungen befindlichen effektiveren und neben
wirkungsärmeren Medikamente ersetzt werden.
Neue Tripletherapien: Derzeit laufen die Phase-III-Studien mit den Proteasehemmern Simeprevir (Tibotec) und BI101355. Beide Medikamente müssen nur 1-mal täglich eingenommen werden und haben ein günstiges Nebenwirkungsprofil. In den Phase-II-Studien lag die SVR-Rate über 80%. Noch wirksamer scheint mit Ritonavir geboostertes Danoprevir zu sein, dieses muss aber zumindest 2-mal täglich eingenommen werden. Ein
anderes Therapieprinzip ist der 5-NSA-Inhibitor Daclatasvir, ebenfalls mit hohen SVR-Raten in der Phase-II-Studie.
Quadrupeltherapie: Die Kombination von zwei unterschiedlichen DAA mit Peginterferon und Ribavirin scheint bei Nonrespondern erfolgreich zu sein, mit SVR-raten bis zu 100% in Phase-2a-Untersuchungen.
Interferonfreie Therapien: Sehr vielversprechende Daten gibt es zu interferonfreien Kombinationstherapien. Die Kombination Daclatasvir/Asunaprevir (ein Proteasehemmer) mit Ribavirin führte bei Nonrespondern mit Genotyp 1b zu einer kompletten Ausheilung aller 10 untersuchten Patienten. Bei Genotyp-1a-Patienten war jedoch die Relapse-/Breakthrough-Rate sehr hoch. In Kombination mit Peginterferon hatten jedoch alle einen SVR.
Der große Durchbruch könnte der Polymerasehemmer GS-7977 sein. Bei 10 Genotyp-2/3-Patienten konnte in Kombination mit Ribavirin innerhalb von 12 Wochen eine Ausheilung der Hepatitis erreicht werden. Das Medikament muss nur 1-mal täglich gegeben werden und hat so gut wie keine Nebenwirkungen. Die Aussichten auf dieses
“Wundermedikament” hat die Firma Gilead bewogen, die Herstellerfirma um 11,6
Milliarden US-$ zu kaufen. Mittlerweile ist leider der erste Enthusiasmus abgeklungen, da alle Genotyp-1-Nonresponder nach Therapieende relapsiert sind.
Neue Interferone: Derzeit wird pegyliertes Interferon-α in der Therapie der Hepatitis untersucht. Im Gegensatz zu Interferon α hat es keine hämatologischen und systemischen Nebenwirkungen und ist mindestens so wirksam wie Peginterferon.