Gezielte Elimination – Immunadsorption bei systemischem Lupus erythematodes
Nach den durchschlagenden Erfolgen der gezielten Therapien (Biologika) zur Behandlung der chronischen Polyarthritis und der seronegativen Spondylarthropathien ist natürlich auch der systemischen Lupus erythematodes (SLE) Gegenstand intensiver Forschung.
Die B-Zelle als Ziel
SLE ist eine durch Autoantikörper gekennzeichnete Erkrankung: Anti-Histon-Antikörper lösen das LE-Zell-Phänomen aus, andere Autoantikörper binden an andere Teile der Chromatinstruktur, wie an doppelsträngige DNA (dsDNA), aber auch an RNA-bindende Proteine (Sm, Ro, La, RA33) und Zelloberflächen (Phospholipide, Erythrozyten, Thrombozyten). Ein Teil dieser Autoantikörper ist pathogen – entweder direkt oder durch Formierung von Immunkomplexen, die sich im Gewebe ablagern und lokal für die Entzündung in verschiedenen Organen (Niere, Gelenke, Haut, Gefäßsystem) verantwortlich sind. Die meisten Organmanifestationen bei SLE sind eine Folge von (Immunkomplex-vermittelten) entzündlichen oder vaskulitischen Prozessen als Konsequenz der Abräumung von Antikörper-beladenen Zellen oder aber eine Folge thrombotischer Ereignisse im Rahmen einer gesteigerten Gerinnungsneigung (meist eines Antiphospholipidsyndroms).
Die Unterdrückung der Produktion solcher Autoantikörper ist Ziel der immunsuppressiven Therapie beim SLE. Das macht die B-Zelle zum geeigneten Ziel für neue Behandlungsoptionen. Die jüngsten Studienerfolge haben zur Zulassung des Anti-Blys-Antikörpers Belimumab (deaktiviert B-Zellen) für die Behandlung des SLE geführt, aber auch erfolgreiche Fallserien mit Rituximab (eliminiert B-Zellen) sind zu beachten. Trotzdem werden mittels B-Zell-Therapie die bereits zirkulierenden Antikörper .
In akuten, besonders schweren Fällen von SLE ist die rasche Entfernung von bereits gebildeten Antikörper eine lohnende Alternative. Eine Möglichkeit, Immunglobuline (Ig), Immunkomplexe (IK) und (Auto-)Antikörper selektiv zu entfernen, ist die Immunadsorption (IAS). Die IAS wird bei zahlreichen Antikörpervermittelten Erkrankungen angewandt: Aus dem Bereich der entzündlich-rheumatischen Erkrankungen zählen dazu insbesondere der hochaktive, therapierefraktäre SLE und Fälle von schwerem Antiphospholipidsyndrom.
Entfernung zirkulierender Antikörper und Immunkomplexe
Schon frühe medizinische Ansätze zielten auf die Elimination von (vermuteten) Schadstoffen im Blut: Die Verfahren (und die Indikationen!) wurden jedoch vom Aderlass zur Plasmaseparation zur Immunadsorption immer selektiver und nebenwirkungsärmer.
Bei der Plasmapherese (oder Plasmaaustausch) wird das Plasma mit all seinen Bestandteilen entfernt und durch frisches Spenderplasma (FFP) ersetzt. Der Vorteil der Plasmapherese ist, dass sie an einer relativ großen Zahl von medizinischen Zentren angewandt werden kann; der Nachteil ist sicher ihre geringe Spezifität und der Bedarf für Spenderplasma und Ersatzlösungen, mit möglichen unerwünschten Folgen wie anaphylaktischen Reaktionen oder Infektionen, wie sie für Lupus- Patienten unter Plasmapherese beschrieben wurden (Aringer M. et al., Arthritis Rheum 1998).
Basierend auf den Erfahrungen mit dem Plasmaaustausch wird kontinuierlich nach Möglichkeiten gesucht, pathogene Substanzen (darunter eben auch Antikörper) spezifisch aus dem Blut zu entfernen, ohne dass eine begleitende Substitution von Plasma oder kolloidalen Lösungen notwendig ist. Dadurch können größere Plasmavolumina im extrakorporalen Kreislauf behandelt werden und damit bessere Absenkraten der Ig- und Autoantikörper-Spiegel erreicht werden.
Wie funktioniert die Immunadsorption (IAS)?
Bei der Immunadsorption wird über einen (peripheren) venöse Zugang Blut entnommen, das Plasma mittels Plasmaseparation von den korpuskulären Anteilen getrennt. Das Plasma läuft daraufhin langsam über eine Adsorptionssäule, wo Ig, IK und (Auto-)Antikörper gebunden werden. Das gereinigte Plasma wird wieder mit den korpuskulären Blutbestandteilen resuspendiert und über einen zweiten venösen Zugang reinfundiert (Abb. 1).
Das Herzstück der IAS sind die Adsorptionssäulen: Meist gibt es pro Patient zwei Säulen, die abwechselnd verwendet bzw. gereinigt werden. An eine Matrix (Sepharose) ist eine große Menge der spezifischen Liganden fix gebunden, die ihrerseits die im Plasma gelösten Ig, IK und Antikörper an sich binden können. Diese Liganden können über relativ unspezifische Bindungen wirken (physikalisch/chemisch); dieses Prinzip nutzen z.B. Phenylalaninsäulen (Immusorba®). In Theorie und Praxis werden Säulen mit hochaffinen Liganden bei Ak-vermittelten Erkrankungen wie dem Lupus bevorzugt: Dazu zählen TheraSorb® (Schaf-Ig als Ligand), Immunosorba® (Staphylokokken-Protein A) und Globaffin® (synthetisches Peptid Gam-146). Mit Hilfe dieser Adsorptionssäulen können IgG aller Klassen, IgM, IgA, IK und Antikörper gebunden werden. Wir konnten nachweisen, dass alle drei hochaffinen Säulen gleich gute Ergebnisse bei Lupus erzielen können (Biesenbach P. et al., Atheroscler Suppl 2009).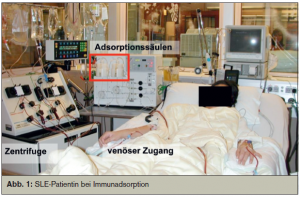
Studienevidenz zur IAS beim SLE
Zahlreiche Berichte liegen zu Behandlungen von SLE-Patienten mit Immunadsorptionstechniken vor, die meisten als Fallbericht oder kleine Fallserien. Bisher wurde keine größere prospektive, randomisierte Studie publiziert. Kleine Fallzahlen mit verschiedenen Säulen und Techniken, unterschiedlicher Anzahl und Dauer der IAS-Sitzungen und unterschiedlichen Plasmavolumina machen allerdings eine generelle Aussage schwierig.
Dennoch sind manche Aussagen gut zu belegen: Allen Berichten gemeinsam ist eine erfolgreiche Reduktion der Immunglobuline sowie von Antids-DNA-und von Anti-Cardiolipin-Antikörpern. Meist kommt es auch zum Rückgang der generellen Krankheitsaktivität (Aktivitätsscores wie SIS, SLEDAI, SLAM) und der Proteinurie.
Dabei ist kritisch zu sehen, dass negative Fälle mit fehlendem Erfolg möglicherweise nicht berichtet wurden (“report bias”).
Eigene Erfahrungen mit der Immunadsorption
An unserer Klinik wurden seit 1993 bisher über 50 SLE-Patienten behandelt. Das Protokoll sieht ein Plasmavolumen von 6.000-8.000 ml pro IAS-Zyklus vor. Zwei Behandlungen finden innerhalb von 3 Tagen (1 Zyklus) statt, um auch die Umverteilung von Ig aus dem Gewebe ins Blut abzufangen. Der Abstand zwischen den Zyklen richtet sich nach klinischer Notwendigkeit und Ig/dsDNA-Spiegeln. Auch tägliche IAS-Sitzungen wurden bei hochaktiven Patienten erfolgreich angewandt.
In Hinblick auf ungünstige Erfahrungen mit der Plasmapherese bei SLE (Aringer M. et al., Arthritis Rheum 1998) ist es eine Freude zu berichten, dass mit dem selektiveren Verfahren der IAS keine Häufung von bakteriellen oder viralen Infektionen zu verzeichnen war. Zur Illustration der guten Erfahrungen soll auf einen Fallbericht über einen Patienten verwiesen werden, der gleichzeitig aktive Tuberkulose und aktive Lupusnephritis (GN-IV) hatte und erfolgreich behandelt werden konnte (Schmaldienst S. et al., Am J Kidney Dis 2002).
Eine Gruppe von 16 SLE-Patienten mit hochaktivem, renalem SLE wurde in ein Behandlungsprotokoll mit IAS eingeschlossen, wenn i.v. Cyclophosphamid unwirksam oder kontraindiziert war. Nach 3 Monaten kam es in der Gesamtgruppe zu einem signifikanten Absinken der Proteinurie, der Krankheitsaktivität und der Anti-dsDNA-Antikörper-Spiegel vor den IAS-Zyklen. Innerhalb eines Jahres fiel die Proteinurie weiter, während sich die Aktivitätsmarker stabilisierten: Somit wurden 88% dieser besonders kranken (negativ selektierten) Patienten erfolgreich behandelt, nur 2 beendeten das Protokoll vorzeitig (Stummvoll G. H. et al., Ann Rheum Dis 2005; Abb. 2).
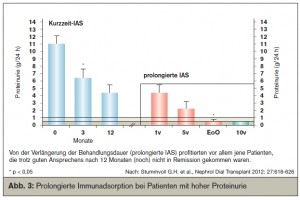
In einer Langzeitobservationsstudie (bis zu 10 Jahre) bei SLE-Patienten mit Nierenbeteiligung und z. T. sehr hoher Proteinurie konnten wir diese guten Resultate bestätigen. Die Langzeitapherese wurde gut toleriert und brachte keine Häufung von Infektionen. Besonderen Nutzen hatten jene Patienten, die auf die Kurzzeit-IAS-Therapie gut angesprochen hatten, aber (noch) nicht in Remission gekommen waren. Insgesamt erfüllten 10 von 11 Patienten am Ende des Beobachtungszeitraums die Kriterien einer Remission (Stummvoll G. H. et al., Nephrol Dial Transplant 2012; Abb. 3).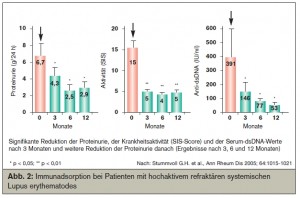
Zusammenfassung: Die Immunadsorption bringt schnellen Nutzen in Fällen von hochaktivem, therapierefraktärem SLE. In den meisten der bisher berichteten Fällen handelt es sich um Patienten, die auf Cyclophosphamid (und/oder Mycophenolatmofetil) nicht oder nicht gut genug angesprochen haben oder wo Kontraindikationen vorlagen. Prospektive, randomisierte Studien zur IAS bei SLE gibt es nicht.
Nachbemerkung: Auf Grund der Expertise mit extrakorporalen Verfahren wird die Apherese meist an nephrologischen Abteilungen mit Hämodialyseerfahrung angeboten. Die Behandlung der erwähnten Patienten erfolgte an der Universitätsklinik für Innere Medizin 3, Abteilung für Nephrologie, Medizinische Universität Wien. Die Apherese-Abteilung leitet a. o. Univ.-Prof. Dr. Kurt Derfler; die Patienten werden in enger Kooperation mit den zuweisenden Kliniken betreut.
Literatur:
– Mistry-Burchardi N. et al.: Apheresis in lupus nephritis. Ther Apheresis 2001; 5:161-170
– Wallace D.J.: Apheresis for lupus erythematosus. Lupus 1999; 8:174-180
– Stummvoll G.H.: Immunoadsorption (IAS) for systemic lupus erythematosus. Lupus 2011; 20:115-119