ESC-Guidelines 2012 – Was ist neu in der Diagnostik und Therapie der Herzinsuffizienz?

In den aktuell vorliegenden Guidelines wird die Herzinsuffizienz (HI) klinisch definiert als Syndrom mit typischen Symptomen (u. a. Atemnot, Knöchelschwellungen, Müdigkeit) und Zeichen (z. B. erhöhter Jugularvenendruck, Rasselgeräusche der Lunge, dritter Herzton), die aus Abnormitäten der Herzstruktur oder -funktion resultieren. Bei der systolischen HI erfordert die Diagnose zusätzlich das Kriterium einer verminderten linksventrikulären Auswurffraktion; bei der diastolischen HI ist diese normal oder nur leicht vermindert und es liegt eine strukturelle Herzerkrankung (Linksventrikel-Hypertrophie, diastolische Dysfunktion) vor.
Eine linksventrikuläre Auswurfleistung (LVEF) > 50 % ist als normal definiert. Relativ klar gilt für Patienten mit Herzinsuffizienz und einer LVEF < 35 % der Terminus „Heart Failure with Reduced Ejection Fraction“ (HF-REF). Schon viel schwieriger ist die Definition „Heart Failure with Preserved Ejection Fraction“ (HF-PEF), wobei hier eine „nicht ganz normale“ LVEF (von 40–45 %) akzeptiert wird und sehr viele haben eine diastolische Dysfunktion, sodass hier der Terminus „diastolische Herzinsuffizienz“ gebräuchlich ist. Den Guidelines zufolge ist diese Entität schwer zu diagnostizieren und resultiert meist aus einer Ausschlussdiagnostik.
Patienten mit einer LVEF von 35–50 % repräsentieren eine Grauzone im Sinne einer milden systolischen Dysfunktion.
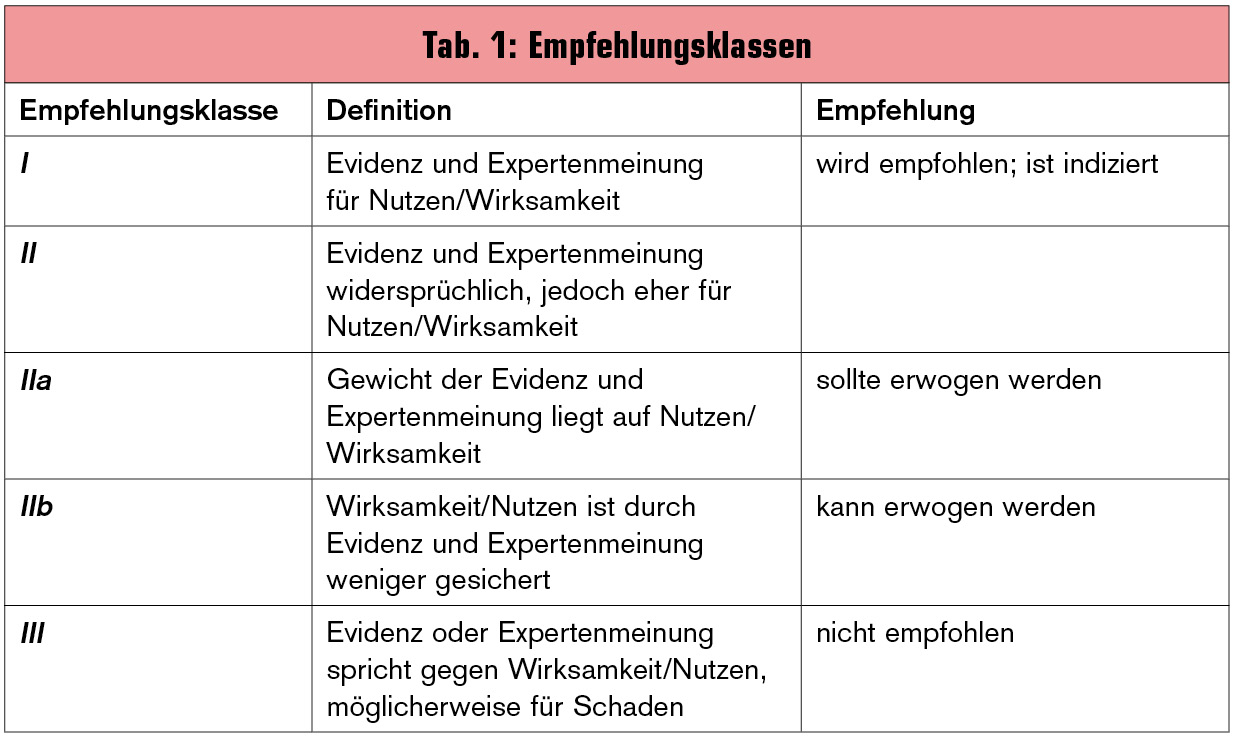
Die Klassifikation des Schweregrades der HI erfolgt in den Guidelines anhand der Kriterien der New York Heart Association (NYHA). Die Empfehlungen basieren auf der Evidenz zu den jeweiligen Fragestellungen (Tab. 1, Tab. 2).
Diagnose
Die Diagnose der Herzinsuffizienz kann sich aufgrund der oft unspezifischen Symptome und Zeichen – insbesondere in frühen Stadien – schwierig gestalten. Um eine adäquate Therapie einleiten zu können, gilt es die der HI zugrunde liegende Ursache zu identifizieren.
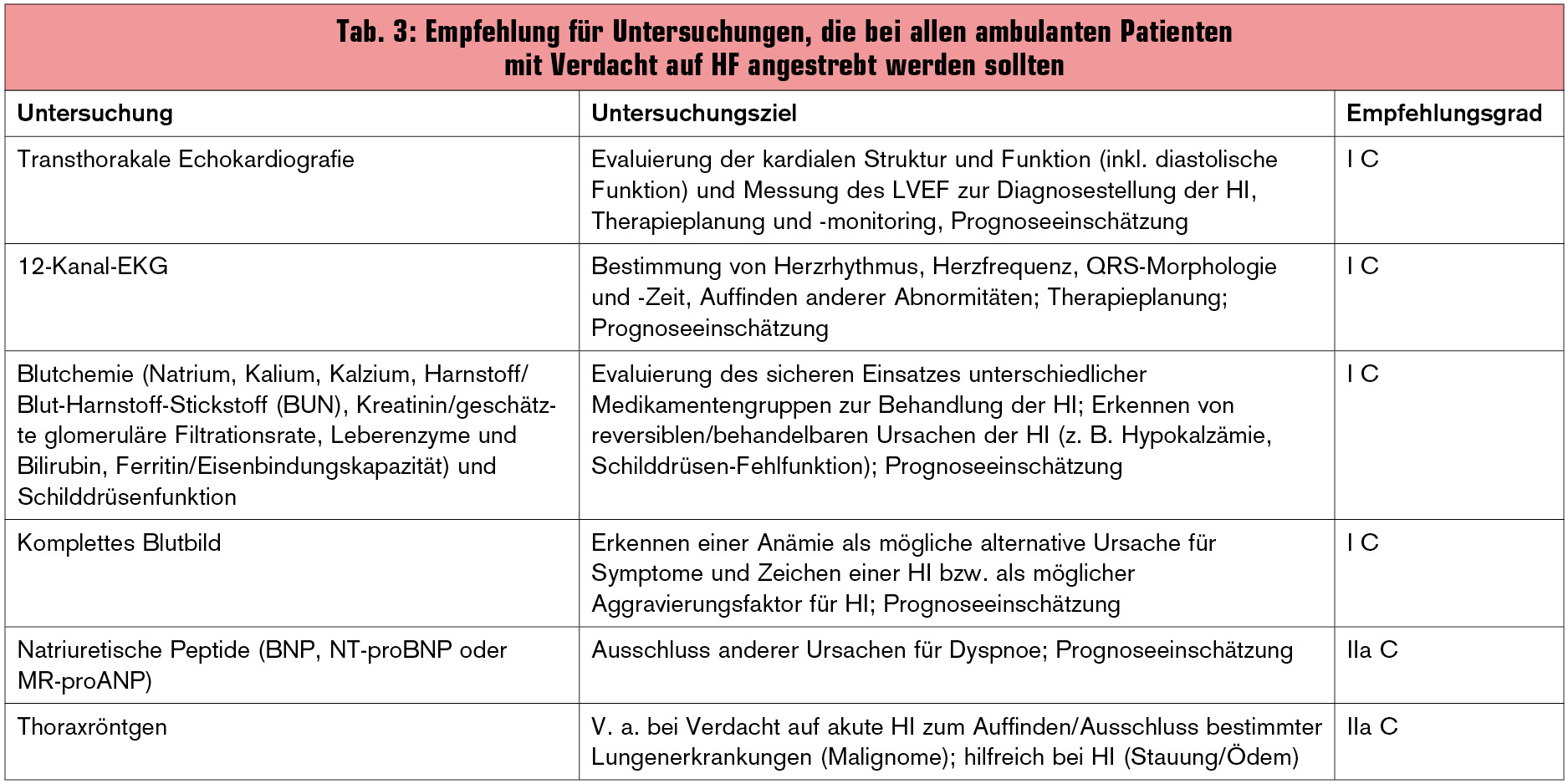
Als wichtigste Untersuchungen bei Patienten mit Verdacht auf HI nennen die Guidelines grundsätzlich das Echokardiogramm (Echo) und das Elektrokardiogramm (EKG). Die damit erhobenen Befunde können bei einem Großteil der Patienten bereits die Grundlage für die Therapieplanung bilden (z. B. systolische Dysfunktion, signifikante Klappenfehler, Arrhythmien). Biologische und hämatologische Routinetests werden ebenfalls als essenziell erachtet, v. a. um die Möglichkeit der Renin-Angiotensin-Blockade zu evaluieren (Tab. 3).
Diagnostischer Algorithmus
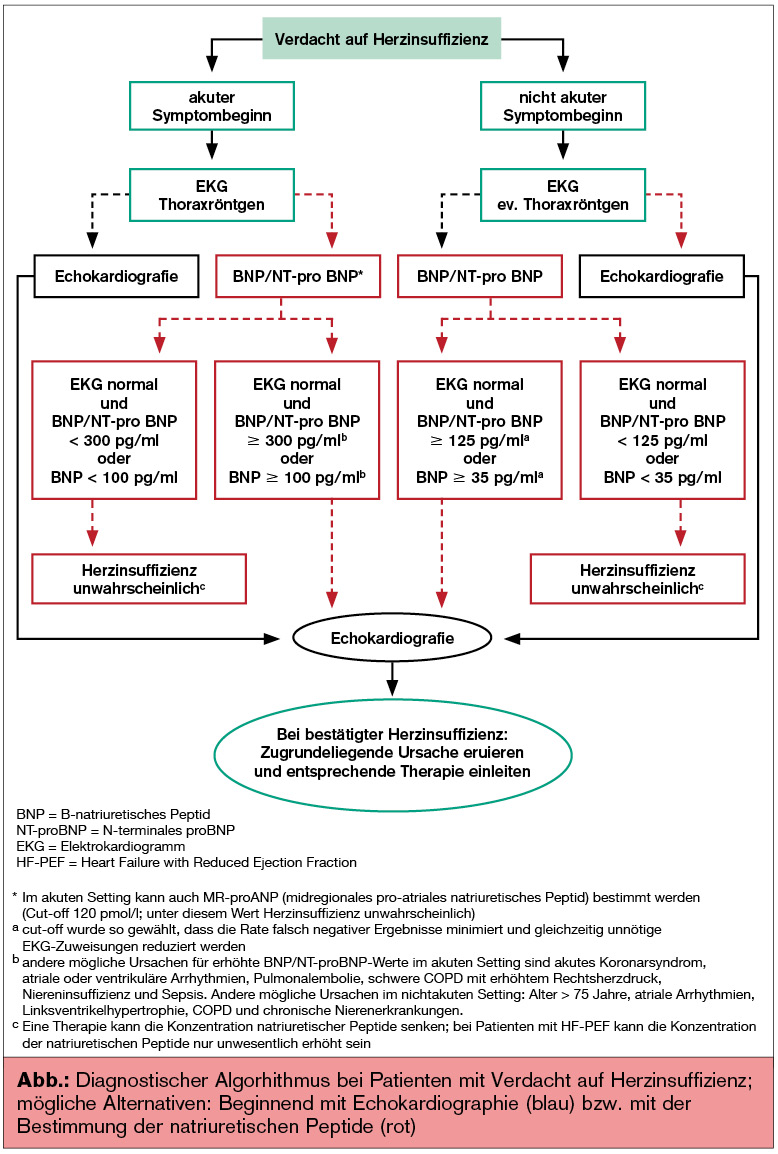
Im Algorithmus zur Abklärung einer suspekten HI steht das EKG an erster Stelle, der raschen Echokardiografie wird ein sehr hoher Stellenwert vor allem bei Patienten mit akutem Symptombeginn eingeräumt. Ist dies nicht möglich, kann der nächste Schritt alternativ auch die Bestimmung der natriuretischen Peptide (BNP/NT-proBNP) sein.
Hier wurden die Grenzwerte im Vergleich zu den letzten Guidelines deutlich verändert und vor allem vom Einsetzen der Symptomatik (akut oder chronisch) abhängig gemacht.
So gelten bei langsamen Symptombeginn und einem normalen EKG-Befund ein NT-proBNP-Wert < 125 pg/ml bzw. BNP < 35 pg/ml als Normalwerte, die das Vorliegen einer HI unwahrscheinlich machen. Sind bei akutem Symptombeginn NT-proBNP < 300 pg/ml oder BNP < 100 pg/ml dann ist eine HI unwahrscheinlich. Bei erhöhten Werten sollte die definitive Diagnosestellung mittels Echokardiografie erfolgen.
Das Thoraxröntgen verliert an Bedeutung und wird vorwiegend bei akutem Einsetzen der Symptome empfohlen, um andere (v. a. pulmonale) Ursachen auszuschließen (Abb.).
An Laboruntersuchungen wird zusätzlich zu den Standardparametern (Natrium, Kalium, Kreatinin bzw. geschätzte glomeruläre Filtrationsrate) und hämatologischen Parametern (Hämoglobin, Hämatokrit, Ferritin, Leukozyten, Blutplättchen) die Bestimmung von TSH (Thyreoidea-stimulierendes Hormon) empfohlen, weil Erkrankungen der Schilddrüse eine HI vortäuschen oder aggravieren können. Das Monitoring der Laborwerte wird auch während der Therapie (v. a. während der Einleitung und Auftitrierung von Renin-Angiotensin-Blockern) sowie im Langzeitverlauf unbedingt empfohlen.
Kann die Diagnose mit den beschriebenen Methoden nicht gestellt werden oder ergeben sich weitere Fragestellungen, können bei entsprechend selektierten Patienten weitere Untersuchungen wie Magnetresonanztomografie, Koronarangiografie, Belastungstests u. a. Klarheit bringen.
Therapie
Ziele in der Behandlung von Patienten mit gesicherter HI sind, Symptome und Zeichen der HI zu reduzieren, Hospitalisierungen zu vermeiden sowie das Überleben, die Lebensqualität und die Funktionalität zu verbessern.
Patienten mit systolischer HF allgemein
Die Guidelines sprechen sich weiterhin mit einer I-A-Empfehlung dafür aus, grundsätzlich alle Patienten mit symptomatischer systolischer HI (NYHA II–IV) möglichst bald nach der Diagnose mit einem Betablocker und einem ACE-Hemmer (bzw. bei Unverträglichkeit mit einem Angiotensinrezeptorblocker [ARB]) zu behandeln. Für beide Substanzklassen wurden in großen randomisierten Studien eine Reduktion von Mortalität und Hospitalisierungen sowie eine Verbesserung des Wohlbefindens belegt. Es besteht Konsens darüber, dass die Wirkungen der Substanzklassen einander ergänzen und dass die Behandlung daher mit einer Kombinationstherapie eingeleitet werden sollte.
Bestehen die Symptome unter dieser Therapie weiter bzw. beträgt die EF ≤ 35 % wird den aktuellen Guidelines zufolge für alle Patienten – bereits bei nur leichter Symptomatik (ab NYHA II) zusätzlich zu Betablocker und ACE-Hemmer ein Mineralkortikoidrezeptor-Antagonist (= Aldosteronrezeptor-Antagonist) MRA empfohlen; bisher hatte diese Empfehlung nur für Patienten mit schwerer Symptomatik (NYHA III, IV) und für Patienten mit HI nach Myokardinfarkt gegolten. Grundlage für die Ausweitung der Empfehlung ist die rezent publizierte EMPHASIS-HF-Studie1, wonach auch bereits Patienten mit milden Symptomen hinsichtlich des Risikos für Hospitalisierung bzw. vorzeitigen Tod von der zusätzlichen Gabe des MRA Eplerenon profitieren. Eingeschlossen waren mehr als 2.700 Patienten mit HI NYHA II. Im Vergleich zur Gruppe unter Standardtherapie plus Placebo zeigte sich in der Gruppe unter Standardtherapie plus Eplerenon eine signifikante Reduktion der kardiovaskulären Mortalität und HI-bedingten Hospitalisierungen um 37 % (p < 0,0001). Eine signifikante Risikoreduktion zeigte sich auch für die sekundären Endpunkte Gesamtmortalität (24 %, p = 0,008), kardiovaskuläre Mortalität (24 %, p = 0,012), Gesamthospitalisierung (23 %, p < 0,0001) und Hospitalisierung aufgrund einer Herzinsuffizienz (42 %, p < 0,0001). Die Empfehlung gilt auf A-I-Level.
Hingegen wird die zusätzliche Gabe eines ARB (oder Renininhibitors) zusätzlich zu ACE-Hemmer und MRA nicht empfohlen, weil dies das Risiko für renale Dysfunktion und Hyperkaliämie erhöhen würde (III C).
Selektierte Patienten mit systolischer HI
Ivabradin: Als neue Indikation wird in den aktuellen Guidelines für Patienten mit Sinusrhythmus, EF ≤ 35 % und einem Ruhepuls ≥ 70 Schläge/min (EMA-Zulassung ≥ 75 Schläge/min), bei denen die HI-Symptome (NYHA II–IV) unter einer Standardtherapie (Betablocker + ACEI/ARB + MRA/ARB) weiterbestehen, zusätzlich Ivabradin empfohlen (IIa B). Zu erwägen ist Ivabradin auch für Patienten mit Betablocker-Unverträglichkeit (IIb C). Grundlage für die Empfehlung ist die SHIFT-Studie2, die für Ivabradin zusätzlich zur Standardtherapie eine Risikoreduktion für kardiovaskulären Tod und HI-bedingte Hospitalisierungen zeigte. In diese Studie waren 6.558 Patienten mit HI (NYHA II–IV) im Sinusrhythmus mit einer Herzfrequenz von ≥ 70 bpm und EF ≤ 35 % eingeschlossen, die innerhalb der letzten 12 Monate einmal HI-bedingt hospitalisiert waren. Die Patienten wurden randomisiert mit Ivabradin (max. 7,5 mg 2 x/d) oder Placebo behandelt; zusätzlich erhielten sie je nach Bedarf Diuretika, Digoxin, ACE-Hemmer, Betablocker und MRA. Das Risiko für kardiovaskulären Tod und HI-bedingte Hospitalisierung wurde durch die Gabe von Ivabradin um 18 % reduziert (p < 0,0001).
Digoxin und andere Digitalis-Glykoside können bei Patienten mit Sinusrhythmus und EF ≤ 45 % und Betablocker-Unverträglichkeit erwogen werden (zusätzlich zu ACE-Hemmer oder MRA), um das Risiko einer HI-Hospitalisierung zu reduzieren. Ivabradin ist aber auch hier eine Alternative bei Ruhepuls ≥ 70 Schläge/min (IIb B). Der weitere Einsatz von Digoxin (oder anderer Digitalisglykoside) sollte in Betracht gezogen werden, wenn die HI-Symptome (NYHA II–IV) trotz Therapie mit Betablocker, ACE-Hemmer (oder ARB) und MRA (oder ARB) bestehen bleiben (IIb B).
Hydralazin-Isosorbiddinitrat: Der Wert dieser Kombinationstherapie bleibt aufgrund der selektierten Studienpopulation (Afroamerikaner) und der geringen Studiengröße unklar. Erwogen werden kann die Gabe alternativ zu ACE-Hemmer oder ARB bei Unverträglichkeit bei Patienten mit EF ≤ 45 % und Linksventrikel-Dilatation (oder EF ≤ 35 %), in Kombination mit Betablocker und ARB (IIb B). Auch bei Fortbestehen der Symptome (NYHA II–IV) unter ACE-Hemmer (oder ARB) und MRA (oder ARB) stellt Hydralazin-Isosorbiddinitrat eine Option dar (IIb B).
Omega-3-Fettsäuren zeigten in der GISSI-HF-Studie keine überzeugenden Effekte, können aber bei Patienten zusätzlich zur Standardtherapie zur weiteren Risikoreduktion in Erwägung gezogen werden.
Diuretika: Im Unterschied zu ACE-Hemmern, Betablockern und MRAs wurden die Auswirkungen von Diuretika auf Mortalität und Morbidität bei Patienten mit HI nicht untersucht. Ihre Wirksamkeit hinsichtlich Reduktion von Dyspnoe und Ödemen ist jedoch gut bekannt, weshalb sie für Patienten mit Anzeichen und Symptomen einer Stauung – unabhängig von der Auswurffraktion – weiterhin empfohlen werden.
Nicht empfohlen: Aufgrund fehlenden Wirknachweises werden Statine, Renininhibitoren und orale Antikoagulantien (außer bei Vorhofflimmern!) zur Behandlung der systolischen HI nicht empfohlen. Als potenziell schädlich werden Glitazone, Kalziumkanalblocker (außer Amlodipin und Felodipin!), NSAR und COX-II-Hemmer eingestuft.
Patienten mit diastolischer HI
Bislang konnten Studien noch für keine Therapie eine überzeugende Reduktion von Morbidität und Mortalität bei diastolischer HI zeigen. Vergleichbar der systolischen HI können Diuretika zur Linderung der retentionsbedingten Symptome eingesetzt werden. Als wichtig werden eine adäquate Behandlung der Hypertonie und die ventrikuläre Frequenzkontrolle bei Vorhofflimmern erachtet. Im Unterschied zur systolischen HI können Kalziumkanalblocker bei diastolischer HI eingesetzt werden.
Interventionelle Therapie
Interventionelle Therapien mittels implantierbarer Cardioverter-Defibrillatoren (ICD) und Resynchronisationsbehandlung (CRT) kommen für die Behandlung der systolischen HI zum Einsatz.
Aufgrund der unveränderten Datenlage gilt für ICDs sowohl für den sekundärpräventiven Einsatz bei Patienten mit ventrikulärer Arrhythmie als auch für die Primärprävention bei Patienten mit symptomatischer HI (NYHA II–II) trotz optimaler medikamentöser Therapie eine I-A-Empfehlung, um das Risiko für plötzlichen Herztod zu reduzieren.
Im Unterschied dazu gaben mehrere wichtige randomisierte kontrollierte Studien Anlass, die Empfehlungen hinsichtlich CRT gegenüber den letzten, im Jahr 2008 veröffentlichten Guidelines auszuweiten. So zeigen zwei große randomisierte kontrollierte Studien (MADIT-CRT3, RAFT4), dass sowohl Patienten mit leichten Symptomen (NYHA II) als auch – wie bereits aus früheren Studien (COMPANION, CARE-HF) bekannt – solche mit schweren Symptomen (NYHA III, IV) von einer Resynchronisationsbehandlung profitieren. Beide rezenten Studien zeigen, dass CRT bei Patienten mit HI im NYHA II bzw. mit EF ≤ 30 % und QRS-Zeit ≥ 130 ms das Risiko für den kombinierten Endpunkt aus Tod oder Hospitalisierung aufgrund von HI senken kann (relative Risikoreduktion RRR in MADIT-CRT 34 %, in RAFT 25 %). Darüber hinaus konnten Symptomatik, Lebensqualität und Linksventrikelfunktion verbessert werden. Eine Verringerung der Gesamtmortalität konnte lediglich in RAFT verzeichnet werden (Reduktion 25 %; p = 0,003).
Aus den Daten resultiert eine I-A-Empfehlung für Patienten mit Sinusrhythmus, NYHA III, dauerhaft verminderter Auswurffraktion (LVEF ≥ 35 %) und Linksschenkelblock (QRS ≥ 120 msec) bzw. ab NYHA II bei LVEF ≤ 30 % und QRS > 130 msec. Für Patienten ohne Linksschenkelblock-Morphologie und einer QRS-Breite ≥ 150 msec gilt die Empfehlung für alle Stadien mit Grad IIa auf Evidenzlevel A.
Nach wie vor unklar bleibt die Evidenz für bzw. gegen CRT bei Patienten mit Vorhofflimmern oder jenen mit Indikation für einen konventionellen Herzschrittmacher; die Guidelines empfehlen, unter bestimmten Voraussetzungen einen CRT zu erwägen (IIb C).
Akutes Herzversagen
Diagnostik und Initialbehandlung erfolgen im Allgemeinen parallel. Die wichtigsten Substanzen für die medikamentöse Therapie des akuten Herzversagens sind Sauerstoff, Diuretika und Vasodilatatoren. Resultiert das akute Herzversagen aus einer akuten Verschlechterung einer bekannten HI, gelten im Anschluss an die Stabilisierung dieselben Empfehlungen wie für das medikamentöse Management der chronischen HI. Vor der Entlassung und für das Langzeitmanagement werden u. a. das Erstellen eines Follow-up-Plans, die Aufnahme des Patienten in ein Disease-Management-Programm und die Dosisoptimierung krankheitsmodifizierender Medikamente empfohlen.
Koronare Revaskularisierung
Die Ergebnisse der STICH-Studie5 könnten dazu führen, dass die Indikation für Koronararterien-Bypass-Operationen (CABG) auf bestimmte Patientengruppen mit HI erweitert wird. Eingeschlossen waren HI-Patienten mit reduzierter Auswurffraktion (NYHA I–III) und leicht ausgeprägter, operabler KHK. Die Teilnehmer erhielten randomisiert entweder eine medikamentöse Therapie alleine oder wurden zusätzlich einer CABG unterzogen. Während die CABG zwar die Gesamtmortalität nicht reduzierte, waren doch positive Auswirkungen auf die kardiovaskuläre Mortalität (RRR 19 %) und den kombinierten Endpunkt aus Gesamtmortalität und kardiovaskulär bedingter Hospitalisierung (RRR 26 %) zu verzeichnen. Die Entscheidung zwischen CABG und perkutaner Koronarintervention sollte durch ein Heart Team getroffen werden.
Herzklappenersatz
Herzklappenerkrankungen können eine HI hervorrufen oder aggravieren. Besonderer Bedeutung kommt hier der „Low flow – low gradient“-Aortenklappenstenose zu, da hier zwischen echter, schwerer Aortenklappenstenose und Pseudoaortenklappenstenose zu unterscheiden ist. Hilfreich zur Diskriminierung einerseits und Beurteilung der kontraktilen Reserve andererseits ist hier die Durchführung einer „Low dose Dobutamin“-Echokardiografie. Eine symptomatische Aortenklappenstenose sollte rechtzeitig einer primär chirurgische Sanierung zugeführt werden. Bei Inoperabilität oder hohem perioperativen Risiko (z. B. schwere Lungenerkrankung) weisen die Guidelines explizit auf die Möglichkeit eines katheterunterstützten Ersatzes der Aortenklappe (TAVI) bei Patienten, deren Allgemeinzustand keinen Eingriff am offenen Herzen zulässt, hin.6
Bezüglich Mitralinsuffizienz wird empfohlen, auch primär die Möglichkeit einer Reparatur (Mitralklappen-Repair) anstatt eines Ersatzes in Betracht zu ziehen. Insbesondere für sekundäre Mitralinsuffizienzen wird empfohlen, die Möglichkeit einer perkutanen Klappenreparatur (z. B. MitraClip) für Patienten mit hohem Operationsrisiko zu erwägen.7
HI im Endstadium
Mechanischen Unterstützungssystemen wie z. B. Ventrikelunterstützungssystemen wird nach wie vor ein Stellenwert als „bridge to decision“ eingeräumt. Dieses Vorgehen gewinnt insofern an Bedeutung, als die Herztransplantation für gut selektierte Patienten nach wie vor den Goldstandard darstellt, jedoch der Bedarf an Spenderorganen die Verfügbarkeit oft übersteigt. Zunehmend werden Ventrikelunterstützungssysteme jedoch auch als Langzeittherapie sowie als Alternative zur Transplantation bei nichtoperablen Patienten gesehen („destination therapy“), da diese wesentlich bessere 2- bis 3-Jahres-Überlebensraten zeigen als die medikamentöse Therapie.8, 9 Sowohl links- als auch biventrikuläre Systeme werden für selektierte Patienten mit HI im Endstadium trotz optimaler Therapie, die für eine Transplantantion geeignet sind, empfohlen, um die Symptome zu verbessern und das Risiko für Hospitalisierung und Tod während der Wartezeit auf die Transplantation zu verringern (I B).