Gastrointestinale Alarmzeichen wahrnehmen!
Bauchschmerzen
Etwa 25% aller Kinder/Jugendlichen suchen bis zum 16. Lebensjahr zumindest einmal einen Arzt wegen oft schon lang andauernder Bauchschmerzen auf, deren Ursachen sehr variabel sind – mit einer Bandbreite von trivial bis lebensbedrohlich.
Laut epidemiologischer Daten sind bei 80% dieser Jugendlichen trotz umfangreicher Untersuchungen keine organischen Ursachen zu finden: Vielmehr handelt es sich meist um „funktionelle“ Bauchschmerzen, wobei allein die Kenntnis dieser Entität unnötige, belastende und kostenintensive Diagnostik vermeiden hilft.
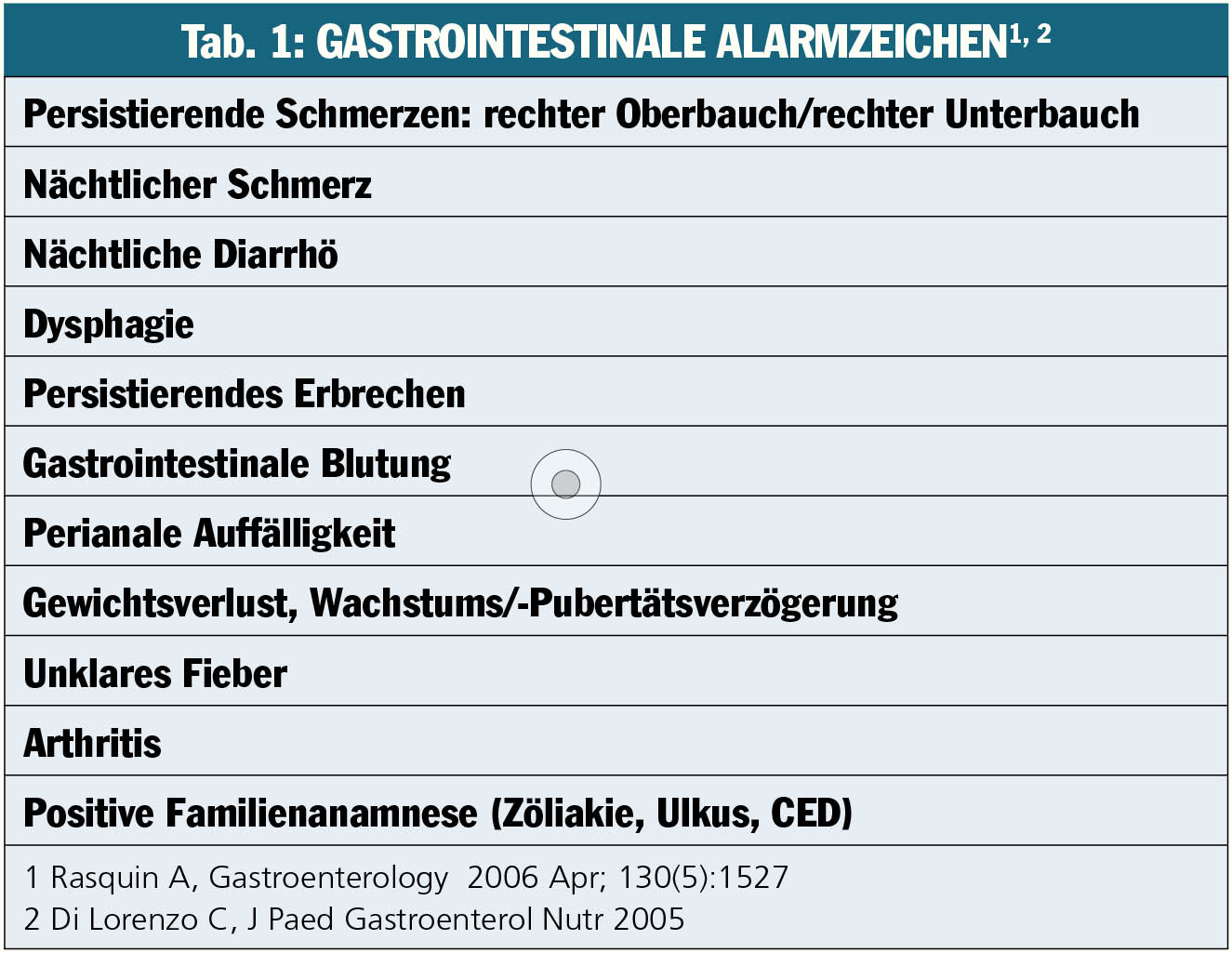
Bauchschmerzen akuter Intensität, die z.B. ein chirurgisches Vorgehen erfordern oder Leitsymptom einer lebensbedrohlichen Erkrankung (Malignom) sein können, sollten also von den viel häufigeren funktionellen Bauchschmerzen abgegrenzt werden: Funktionellen gastrointestinalen Erkrankungen (functional gastrointestinal disorders, FGID) liegen „variable Kombinationen chronisch-rezidivierender gastrointestinaler Symptome zugrunde, die nicht durch strukturelle oder biochemische Abnormitäten erklärbar sind“. FGID werden anhand der sogenannten „Rom-III-Kriterien“ diagnostiziert, die auf klinischem Expertenkonsens basieren und Klassifizierungen von für Kinder/Jugendliche relevanten klinischen Entitäten enthalten. Wesentlich ist, dass die gastrointestinalen Symptome seit mindestens zwei Monate bestehen und klar von Alarmzeichen abzugrenzen sind (Tab. 1).
So darf die Diagnose „funktionelle Bauchschmerzen im Kindes- und Jugendalters“ nur gestellt werden, wenn keine persistierenden oder nächtlichen Schmerzen bzw. keine blutige, nächtliche oder chronische Diarrhö etc. bestehen. Liegt auch nur eines dieser Alarmzeichen vor, so geht dies mit höherer Prävalenz einer organischen Erkrankung einher und rechtfertigt invasive Diagnostik.
Hingegen werden funktionelle Bauchschmerzen im Jugendalter anhand folgender Kriterien diagnostiziert:
a) Dokumentation episodischen/kontinuierlichen Auftretens (vergleichbar häufig) der Bauchschmerzen mittels Symptomkalender inkl. Schmerzquantifizierung
b) Fehlende Überschneidung mit einer anderen FGID (z.B. Reizdarmsyndrom)
c) Ausschluss eines Alarmzeichens
Weitere anamnestische Hinweise sind zyklisches Auftreten nach symptomfreiem Intervall, Symptombesserung an Wochenenden oder in den Ferien, Assoziation mit Einschlafstörungen, Müdigkeit, Schwindel, Übelkeit, familiäre Migräne oder Reizdarmsyndrom.
Zusammengefasst – es darf „keinen Hinweis für einen etwaigen entzündlichen, anatomischen, metabolischen oder neoplastischen Prozess geben, der die Symptome erklären könnte“. Daraus ergibt sich die Empfehlung einer zunächst eher noninvasiven Diagnostik (Tab. 2): Laut aktueller Datenlage haben weder abdominale noch Beckensonografie, Ösophagus-pH-Metrie oder gastrointestinale Endoskopie einen Stellenwert für den Nachweis einer organischen Erkrankung (Tab. 3) – so keine klinischen Alarmzeichen vorliegen!
Chronische Diarrhoe
Bei einer Diarrhö ist die Stuhlfrequenz höher und die Stuhlkonsistenz geringer als sonst üblich, man sollte daher das aktuelle Stuhlmuster der Patientin/des Patienten mit dem bisherigen vergleichen. Besteht ein diarrhoisches Stuhlmuster für mehr als zwei Wochen, handelt es sich um eine „chronische“ Diarrhoe, die eine Malnutrition bedingen kann und daher ein gastrointestinales Alarmzeichen ist.
Zwar können Erkrankungen des Dickdarms, des Pankreas, der Leber sowie endokriner Organe eine chronische Diarrhö verursachen, meist wird sie aber durch Erkrankungen des Dünndarms (v.a. Beeinträchtigung der Dünndarmschleimhaut) hervorgerufen, mit Resorptionsproblemen und konsekutiver Mangelernährung. Daher hat die Endoskopie des oberen Gastrointestinaltrakts inkl. duodenaler Biopsien zentrale diagnostische Bedeutung.
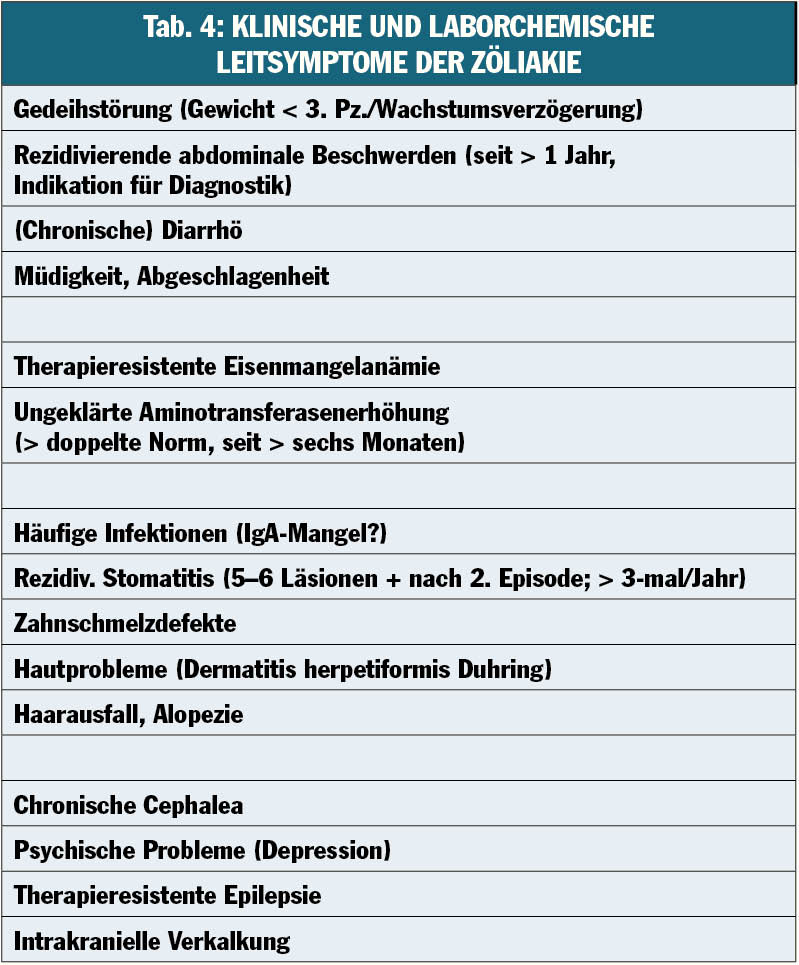
Die diesbezüglich häufigste Erkrankung (≥ 1% unserer Population) ist die Zöliakie. Klassische Symptome sind chronische Diarrhoe und Gedeihstörung, aber extraintestinale oder oligosymptomatische Manifestationen kommen v.a. auch bei Jugendlichen immer häufiger vor (Tab. 4). Zusätzlich sind positive spezifische serologische Testresultate (IgA, Transglutaminase) und pathologisch veränderte Duodenalschleimhaut (Marsh-Klassifikation) diagnostisch. Therapie der Zöliakie ist die lebenslang konsequent einzuhaltende glutenfreie Ernährung – mit exzellenter Prognose.
Blutige Diarrhoe
Die Symptomkonstellation Bauchschmerzen (chronisch-rezidivierend) und blutige Diarrhö lässt eine chronisch-entzündliche Darmerkrankung (CED) vermuten, wobei die ausgeprägte (chronisch-)blutige Diarrhoe für eine Colitis ulcerosa typisch ist. Dominieren aber Bauchschmerzen im Verein mit Gewichtsverlust oder Wachstumsverzögerung/-stillstand, ist eher an einen M. Crohn zu denken. In diesem Zusammenhang ist der Merksatz „Anorexia nervosa und erhöhte BSG = M. Crohn“ hilfreich.
Das diagnostische Vorgehen bei CED basiert auf präziser (Familien-)Anamnese (> 10% der erstgradig Verwandten haben eine CED) und einer klinischen Untersuchung mit Fokus u.a. auf der Erfassung von chronischer Gedeihstörung oder verzögerter Pubertätsentwicklung. Wesentlich ist auch das Wissen um extraintestinale Manifestationen (rezidivierende Fieberschübe, Neigung zu Aphthen, Gelenksprobleme).
Gedeihstörung
Eine Gedeihstörung liegt vor, wenn:
a) die Verlaufskurve für Körpergewicht bzw. Körperlänge unter die 3. auf das Alter bezogene Perzentile abfällt, oder
b) die Verlaufskurve der Körperlänge um > 2 Standarddeviationen unter jene der genetischen Zielgröße (= familiäre Zielgröße) abfällt, oder
c) die Verlaufskurve die Perzentilen kreuzt (z.B. Abfall von der 25. auf die 3. Perzentile = „Kreuzen“ der 10. Perzentile).
Der bestetablierte anthropometrische Parameter zur Erfassung einer chronischen Gedeihstörung ist die verminderte Körperlänge bezogen auf das Alter – unter Einbeziehung des genetischen Potenzials des Kindes, der Elterngröße.
Eine weitere Quantifizierung einer Gedeihstörung ist mittels Errechnung des Längensollgewichts (LSG) möglich, dem aktuellen Gewicht in % des für die Körperlänge normalen Gewichts:
LSG (in %) = Körpergewicht (kg) x 100/Gewichtsmedian (50. Pz.) für die Körpergröße (Normwert: 90–110%).
(Anm.: Vermindertes Gewicht oder verminderte Körperlänge sind auch für den CED-Krankheitsverlauf von hoher Relevanz, da sie die einzigen Zeichen aktiver Erkrankung sein können. Daher ist ihre Erfassung im pädiatrischen Krankheitsaktivitätsindex für M. Crohn, dem „PCDAI“, inkludiert).
Letztlich kann eine Gedeihstörung mittels Body Mass Index (BMI) erfasst werden (BMI < 15 bei 13- bis 14-Jährigen; BMI < 16,5 bei 14- bis 17-Jährigen = Unterernährung). Eine Verzögerung der Pubertät, also ein für das biologische Alter zu geringes Pubertätsstadium (nach Tanner) ist ebenfalls ein klinisches Alarmsymptom, das auf eine CED, v.a. auf M. Crohn, hinweisen kann.
Seit Jahren steigt die CED-Inzidenz in Industrienationen an und ca. 40% der neudiagnostizierten Patienten sind Kinder und Jugendliche. Am GPGE*-Weiterbildungszentrum für Pädiatrische Gastroenterologie der Grazer Universitätsklinik für Kinder- und Jugendheilkunde werden seit 2004 alle mit CED diagnostizierten Kinder/Jugendlichen in einem der weltweit größten pädiatrischen CED-Register („GPGE-CEDATA“) erfasst, wobei zurzeit 60% aller Neudiagnostizierten Jugendliche (13–18 Jahre) sind.
(Anm.: In Slowenien stieg in den letzten Jahren die CED-Inzidenz von 3 auf 5/100.000 Kinder/Jugendliche, in der Steiermark beträgt sie bereits 13/100.000 (siehe Styrian Incidence of Colitis and Crohn’s disease Study, „STICC“), davon 60% M. Crohn).
Die Diagnose einer CED basiert auf präziser Anamnese und klinischer Untersuchung mit Augenmerk auf (gastrointestinalen) Alarmsymptomen. Nötig sind außerdem Laboranalysen relevanter Inflammationsmarker, molekulargenetische und Immundiagnostik sowie mikrobiologische Untersuchungen zum Ausschluss intestinaler Infektionen oder (latenter) Tuberkulose. Krankheitslokalisation und CED-Klassifizierung ergeben sich aus der Endoskopie des oberen und unteren Gastrointestinaltrakts (s. „Porto-Kriterien“ der European Society of Paediatric Gastroenterology, Hepatology and Nutrition „ESPGHAN“) inkl. Dünndarm-NMR bei Verdacht auf M. Crohn.
Eine adäquate CED-Therapie sollte effizient, sicher und nebenwirkungsarm sein. Sie muss individuell angepasst werden, wobei es bei der Colitis ulcerosa neben medikamentöser Behandlung letztlich eine chirurgische Option gibt und bei M. Crohn initial auch einen ernährungsmedizinischen Ansatz (Abb.). Prinzipiell unterscheidet man die Phase der Remissionsinduktion mit dem Bestreben, die mukosale Inflammation zu verringern, von jener der Remissionserhaltung, wo es um Verbesserung des Ernährungsstatus, Steigerung der Lebensqualität und Verhinderung maligner Erkrankung geht.
Zusammenfassung
Bauchschmerzen sind bei Jugendlichen ein häufiges Symptom, weshalb die Unterscheidung funktioneller Bauchschmerzen (lt. Rom-III-Diagnosekriterien) von Bauchschmerzen als Alarmsymptom essentiell ist. Die Symptomkonstellation Bauchschmerzen und chronische Diarrhoe wäre ein Hinweis auf eine Zöliakie, mit exzellenter Prognose bei konsequenter glutenfreier Ernährung. Bei der Symptomkombination Bauchschmerzen und (chronische) blutige Diarrhoe ist an eine CED, v.a. eine Colitis ulcerosa, zu denken. Die Kombination der Alarmzeichen Bauchschmerzen, chronische Diarrhö, Gedeihstörung/Wachstums- oder Pubertätverzögerung lässt eher eine CED vom Typ M. Crohn vermuten. Eine CED wird mittels Endoskopie des Gastrointestinaltrakts inkl. Stufenbiopsien in Zusammenschau mit zahlreichen laborchemischen und molekulargenetischen Untersuchungen diagnostiziert und sollte an einem entsprechenden pädiatrischen Zentrum erfolgen.