Antihyperglykämische Präparate neben Insulin
Die Therapie bei Typ-1-Diabetes ist aufgrund der Betazelldestruktion und des darauffolgenden absoluten Insulinmangels selbstverständlich eine (je nach Patient mehr oder weniger komplexe) Insulintherapie.
Trotzdem können bei Menschen mit Typ-1-Diabetes (T1D) auch Charakteristika auftreten, die man sonst klassischerweise bei Menschen mit Typ-2-Diabetes findet. Am häufigsten ist hier sicherlich das Übergewicht bzw. die Adipositas und die daraus entstehende Insulinresistenz zu nennen.
Daher scheint es naheliegend, Medikamente, die bei Menschen mit Typ-2-Diabetes erfolgreich sind, bei entsprechender Indikation auch bei Menschen mit Typ-1-Diabetes einzusetzen.
Metformin
Die Hypothese der Wirkung von Metformin bei Menschen mit Typ-1-Diabetes ist eine Verbesserung der Insulinresistenz ohne gleichzeitige Hypoglykämiegefahr. Aufgrund des seit langem etablierten Einsatzes bei Menschen mit Typ-2-Diabetes in der Erstlinientherapie in (beinahe) allen Leitlinien war es naheliegend, Metformin in vielen verschiedenen Studien zu untersuchen. Die Ergebnisse hierzu sind unterschiedlich, und zumeist wurden die Erwartungen der Studienautoren wohl nicht komplett erfüllt, jedoch muss man immer die einzelnen untersuchten Populationen betrachten, also z. B. Ältere vs. Jüngere, Insulinresistente vs. Nichtinsulinresistente, gute glykämische Kontrolle vs. insuffizient behandelter Diabetes mellitus etc.
Ein Beispiel hierfür ist, dass Menschen mit Typ-1-Diabetes (n = 100; mittleres Alter 46 Jahre, mittlerer BMI 26,2 kg/m²) und einem HbA1c ≥ 8 % entweder für 12 Monate zu Metformin 2.000 mg (mit Titrationsschema) oder zu Placebo randomisiert wurden (selbstverständlich zusätzlich zu einer Insulintherapie).1 Bei wirklich schlechter glykämischer Kontrolle zu Beginn (Baseline-HbA1c 9,5 %) kam es im Vergleich zu Placebo zu keiner Verbesserung des HbA1c, jedoch zu einer Abnahme des Körpergewichts von 1,74 kg und einer Reduktion der täglichen Insulindosis von 5,7 E/Tag.1
Eine weitere Studie untersuchte Metformin bei 62 Patienten mit T1D unter CSII (kontinuierliche subkutane Insulininfusionstherapie) und mit einem HbA1c-Wert < 9 %. Die Patienten wurden zu Metformin 850 mg zweimal täglich oder zu Placebo randomisiert. Die Patienten und/oder Prüfer konnten die Insulindosis anhand des selbst gemessenen Blutzuckerspiegels anpassen. Der tägliche Insulinbedarf konnte in der Metformingruppe signifikant gesenkt werden, allerdings zeigten sich auch hier keine Unterschiede beim HbA1c.2 Zwei kleine randomisierte Studien untersuchten den Effekt von Metformin bei Menschen mit Typ-1-Diabetes und Übergewicht. In einer Studie wurden 15 übergewichtige oder adipöse Menschen mit T1D in einem randomisierten Cross-over-Design untersucht. Nach Insulinoptimierung wurden die Patienten randomisiert und erhielten Metformin titriert auf 850 mg dreimal täglich oder Placebo für 16 Wochen. Der Ausgangs-BMI betrug 31,3 ± 2,6 kg/m², und der HbA1c-Wert betrug 8,6 ± 1,4 %. Die Behandlung mit Metformin führte zu einer signifikanten Senkung des HbA1c im Vergleich zu Placebo (7,8 ± 1,1 % gegenüber 8,6 ± 1,2 %; p < 0,005). Auch die Insulindosis konnte deutlich gesenkt werden, jedoch gab es keinen Unterschied im Gewicht zwischen den beiden Gruppen.3 In der zweiten Studie wurden 24 Menschen mit Typ-1-Diabetes (mittlerer BMI 29,3 ± 3,0 kg/m²) über insgesamt 6 Monate randomisiert (Metformin vs. Placebo). Hier zeigte sich wiederum ein signifikanter Gewichtsverlust in der Metformingruppe (−3,9 ± 1,5 kg; p = 0,02), aber ebenfalls kein Unterschied beim HbA1c.4
Die Frage, ob die Erweiterung der Therapie um Metformin bei Menschen mit T1D zu einem kardiovaskulären Benefit führt, wurde erstmals in der REMOVAL-Studie untersucht.5 Insgesamt erhielten 428 Patienten mit T1D und erhöhtem kardiovaskulärem Risiko (mittleres Alter 55 Jahre, mittlere Diabetesdauer 33 Jahre) eine mittlere Dosis von 1.443 mg Metformin (Titration war auf 2.000 mg Metformin geplant) bzw. Placebo über drei Jahre. Die Metformin-Therapie hatte keinen Effekt auf den primären Endpunkt (Zunahme der mittleren Intima-Media-Dicke der Arteria carotis interna, cIMT), reduzierte jedoch den präspezifizierten tertiären Endpunkt signifikant (Zunahme der maximalen cIMT; p = 0,0093). Das HbA1c sank im Mittel signifikant um 0,13 % (95%-KI: –0,22 bis –0,037; p = 0,006), wobei dieser Effekt nur auf die Verbesserung der glykämischen Kontrolle in den ersten 3 Monaten zurückzuführen war. Metformin senkte das Körpergewicht um 1,17 kg (95%-KI: –1,66 bis –0,69; p < 0,0001). Es gab keine Unterschiede beim Insulinbedarf.
Die Leitlinien der Österreichischen Diabetes Gesellschaft geben keine klare Stellungnahme zur zusätzlichen Therapie bei Menschen mit Typ-1-Diabetes ab.6 Die deutsche S3-Leitlinie empfiehlt Metformin zur Blutzuckersenkung bei Menschen mit Typ-1-Diabetes nicht. Allerdings wird als Expertenkonsens Folgendes empfohlen: „Bei Menschen mit Typ-1-Diabetes, bei welchen kardiovaskuläre Risikofaktoren und Übergewicht/Adipositas vorliegen, kann die zusätzliche Gabe von Metformin wegen vorteilhafter Effekte auf das LDL-Cholesterin, das Körpergewicht sowie auf Surrogatparameter der Arteriosklerose erwogen werden. Der Zulassungsstatus von Metformin ist zu beachten.“7
DPP4-Inhibitoren
DPP4-Hemmer senken nachweislich den Glukagonspiegel und erhöhen den GLP-1-Spiegel nach einer Mahlzeit, ohne die gegenregulatorischen Effekte während einer Hypoglykämie zu beeinflussen. Einige kleine Studien zeigten minimale, aber signifikante HbA1c-Senkungen von 0,27–0,32 % nach 4 Wochen mit Sitagliptin, doch längere Studien konnten die signifikante Senkung nicht bestätigen. Auch eine Metaanalyse zeigte keine positiven Resultate für den Einsatz von DPP4-Inhibitoren bei Menschen mit Typ-1-Diabetes, daher ist diese Substanzgruppe vernachlässigbar.8, 9
GLP-1-Rezeptoragonisten
Viel spannender hingegen ist der Einsatz der Gruppe der GLP-1-Rezeptoragonisten – insbesondere, da ja Liraglutid 3,0 mg auch bei Nichtdiabetikern zur Behandlung von Übergewicht und Adipositas zugelassen ist und verwendet wird. Es wurde erwartet, dass vor allem postprandiale Spitzen mit einer Zusatztherapie eines GLP-1-Rezeptoragonisten besser in den Griff zu bekommen seien; außerdem ist das Thema Gewicht natürlich auch ein häufig problembelastetes Thema für Menschen mit Typ-1-Diabetes, für welche die Gewichtsabnahme oft eine besondere Herausforderung darstellt.
Zwei große Langzeitstudien, ADJUNCT ONE und TWO, zielten darauf ab, die Auswirkungen von Liraglutid 0,6, 1,2 und 1,8 mg täglich im Vergleich zu Placebo bei Erwachsenen mit T1D auf die glykämische Kontrolle, die Insulindosis und das Gewicht zu vergleichen.10, 11 ADJUNCT ONE war eine Treat-to-Target-Studie, die 1.398 Patienten über ein Jahr einschloss, ADJUNCT TWO inkludierte 835 Patienten über 26 Wochen und implementierte eine Insulindosis-Obergrenze für die Dauer der Studie. In beiden Studien wurde die Insulindosis bei Beginn der Behandlung mit Liraglutid um 25 % gesenkt, wobei weitere 10 % der Insulindosis im Rahmen der Auftitration gesenkt werden konnten. ADJUNCT ONE zeigte signifikante HbA1c-Reduktionen mit Liraglutid 1,2 und 1,8 mg im Vergleich zu Placebo (–0,49 %, –0,54 % bzw. –0,34 %) trotz des Treat-to-Target-Behandlungsansatzes. In der Liraglutidgruppe kam es zu einem signifikanten Gewichtsverlust (1,3–4,0 kg; p < 0,001) in allen Dosierungen verglichen mit Placebo. In ADJUNCT TWO kam es mit allen Liraglutid-Dosen zu einer HbA1c-Senkung (–0,24 %, –0,23 % und –0,35 % für 0,6, 1,2 bzw. 1,8 mg) im Vergleich zu Placebo (+0,01 %). Die Insulindosen sanken unter Liraglutid signifikant, in erster Linie aufgrund der Reduktion des prandialen Insulins. Das Gewicht nahm unter Liraglutid signifikant um 2,5–5,1 kg (p < 0,001) ab.
Diese Studien legen den Einsatz von GLP-1-RA bei Menschen mit Typ-1-Diabetes nahe, allerdings kam es leider zu Begleiterscheinungen. Als Nachteil zeigte sich unter Liraglutid dosisabhängig ein Anstieg der hyperglykämischen Ereignisse mit gleichzeitiger Hyperketonämie (> 27 mg/dl [1,5 mmol/l]): 11,2 % für Liraglutid 1,8 mg/Tag, 7,5 % für Liraglutid 1,2 mg/Tag, und 6,3 % für Liraglutid 0,6 mg/Tag. Dagegen traten keine Ketosen unter Placebo auf. Außerdem gab es in der Liraglutidgruppe auch Ketoazidosen. Aufgrund dieser Nebenwirkungen bleibt der klinische Nutzen von Liraglutid bei Menschen mit Typ-1-Diabetes leider limitiert, und der Einsatz ist derzeit nicht zugelassen. Trotzdem muss man sagen, dass bei gut aufgeklärten Menschen mit Typ-1-Diabetes und Übergewicht bzw. Adipositas im klinischen Alltag eine Off-Label-Therapie mit GLP-1-Rezeptoragonisten sehr erfolgreich sein kann.
SGLT(1)/2-Inhibitoren
Da SGLT2-Inhibitoren ihre antihyperglykämische Wirkung über die Niere entfalten, war von Anfang an die Idee des Einsatzes auch bei Menschen mit Typ-1-Diabetes gegeben, insbesondere, da sie keine Hypoglykämien induzieren und auch glukoseabhängig wirken. Daher gibt es auch ein breites Studienprogramm, das die einzelnen Substanzen untersuchte.
In den DEPICT-Studien 1 und 2 mit Dapagliflozin 5 und 10 mg vs. Placebo ergab sich über 52 Wochen eine signifikante Reduktion von HbA1c, Gesamtinsulindosis (11 % vs. 8 %) und Körpergewicht (3,5 % vs. 0,1 %).12, 13 Die Time in Range (TiR) stieg nach 24 Wochen um 2 Stunden unter der niedrigen und um 2,3 Stunden unter der hohen Dosierung, ohne die Zeit in der Hypoglykämie zu erhöhen. Hervorzuheben ist außerdem, dass dieser Anstieg in einer doppelblinden Studie erzielt werden konnte, während der die Patienten auch noch einem vom Protokoll vorgegebenen Insulinadaptionsalgorithmus folgen mussten.
Im EASE-Studienprogramm wurde Empagliflozin bei Menschen mit Typ-1-Diabetes untersucht.14 Auch hier zeigten sich signifikante HbA1c-Senkungen in allen drei untersuchten Dosierungen (2,5 mg, 10 mg und 25 mg) um die 0,54 % in der höchsten Dosierung ohne Anstieg der Hypoglykämierate. Genau wie bei den Dapagliflozin-Studien zeigten sich außerdem ein signifikanter Gewichtsverlust, eine Blutdrucksenkung und eine Reduktion der Insulindosis.
Der SGLT1/2-Inhibitor Sotagliflozin zeigte ähnliche Ergebnisse wie das EASE- oder DEPICT-Studienprogramm.15 Sotagliflozin ist insofern interessant, als es auch den SGLT1-Rezeptor blockiert, der sich vor allem im Darm befindet. Die Substanz hat bereits seit 2019 eine EMA-Zulassung für die zusätzliche Behandlung von Menschen mit Typ-1-Diabetes, ist aber derzeit in Österreich nicht am Markt.
Dapagliflozin ist derzeit der einzige sich am Markt befindliche SGLT2-Inhibitor, der auch für die Behandlung von Menschen mit Typ-1-Diabetes zugelassen ist.
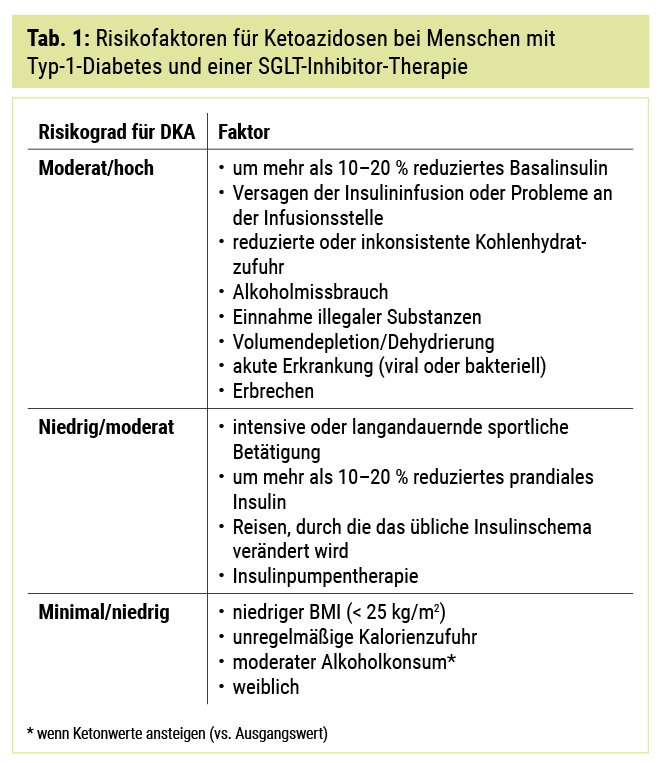
Ein großes Problem bei der Therapie mit SGLT2-Inhibitoren ist der Anstieg der Rate von euglykämischen Ketoazidosen. Verschiedene Mechanismen dürften das Risiko einer Ketoazidose unter SGLT-Inhibitor-Therapie erhöhen. Die Reduktion der Insulindosis (insbesondere der Basalinsulindosis) dürfte dazu führen, dass auch ohne Anstieg des Blutzuckerspiegels die Lipolyse und Ketogenese nicht weiter unterdrückt werden können. SGLT2-Inhibitoren sind mit einem Anstieg von Glukagon assoziiert, eventuell durch den renalen Glukoseverlust oder durch direkte Effekte auf die Alphazelle; jedenfalls triggert dieser auch die Lipolyse und Ketogenese. Eine weitere Hypothese ist, dass es unter SGLT2-Inhibitor-Therapie zu einer Reduktion der renalen Clearance von Ketonkörpern kommen kann. In Tabelle 1 finden sich Hinweise, wann mit einem erhöhten Risiko zu rechnen ist. Ein wichtiger Punkt ist die besonders gute Schulung des Patienten (z. B. Sick Day Off Pill) sowie auch die richtige Vorauswahl von Patienten. Wenn man dies aber berücksichtigt, so ist im klinischen Alltag ein SGLT2-Inhibitor besonders zur Senkung der postprandialen Spitzen hilfreich.
Ein internationaler Konsensus schlägt vor, welche Kriterien bei einem Patienten vor der Initiierung einer Therapie mit SGLT2-Inhibitoren erfüllt sein sollten (siehe Tab. 2).16 Zusammengefasst empfiehlt der Konsensus, dass der potenzielle Nutzen von SGLT-Hemmern für Menschen mit Typ-1-Diabetes klinisch bedeutsam sein müsste. Daher sind Strategien zur Abschwächung des Ketoazidoserisikos sowohl für die Akzeptanz als auch für die sichere Anwendung von größter Wichtigkeit.
Resümee
Alle untersuchten Substanzklassen haben als Zusatztherapie verschiedene Vor- und Nachteile bei der Behandlung von Menschen mit Typ-1-Diabetes. Prinzipiell sollte beim Einzelnen immer abgewogen werden, in welcher Situation (z. B. Gewichtsreduktion im Vordergrund oder postprandiale Spitzen) man zu welcher Substanzklasse greift. Derzeit wird in der Indikation Typ-1-Diabetes aber keine Therapie erstattet, und auch die Zulassung liegt nur für manche der angesprochenen Therapien vor.