Diabetische Nephropathie: “Screening ist die beste Strategie”
Seit den 1970er-Jahren beschäftigt sich Prof. Carl Erik Mogensen mit der Pathophysiologie und der Therapie der diabetischen Nephropathie. Schon früh machte Mogensen auf die Albuminurie als prognostisch relevanten Marker der Nephropathie und auf die Bedeutung der Blutzucker- und Blutdruckkontrolle für die Progression der Nierenschädigung aufmerksam (Mogensen, Lancet 1971; Mogensen, Diabetes 1976). Ebenso geht die Einteilung der diabetischen Nephropathie in 5 Stadien – nach Albuminausscheidung, Serumkreatinin und glomerulärer Filtrationsrate (GFR) – auf Mogensen et al. (Diabetes 1983) zurück. Im Gespräch mit DIABETES FORUM erläutert Prof. Mogensen die aktuellen Fortschritte und Herausforderungen in der Therapie der diabetischen Nephropathie.
Diabetes Forum: Herr Prof. Mogensen, nachdem die Prävalenz der diabetischen Nephropathie über Jahrzehnte zugenommen hat, scheint der Anteil der Diabetiker an den Dialysepatienten in letzter Zeit etwas zurückzugehen – Ergebnis verbesserter Therapien oder Folge anderer (z.B. demografischer) Faktoren?
Mogensen: Wir beobachten diesen Trend in verschiedenen Ländern. Die Demografie spielt dabei insofern eine Rolle als zunehmend ältere und schwer kranke Patienten einer Dialysetherapie zugeführt werden. In Dänemark gab es früher für die Dialyse ein Alterslimit von 60 Jahren – mittlerweile haben wir viele Patienten im Alter von 90 Jahren und darüber an der Hämodialyse. Damit hat sich die Zusammensetzung des Patientenguts an den Dialysestationen stark verändert. Daneben dürften in einigen Ländern auch sozioökonomische Faktoren von Bedeutung sein.
Die Möglichkeit, mithilfe von ACE-Hemmern und Angiotensinrezeptorblockern (ARB) das Renin-Angiotensin-Aldosteron-System (RAAS) zu blockieren, war in nephrologischer Hinsicht ein entscheidender Fortschritt. Allerdings lässt sich aus den Statistiken kein Zusammenhang zwischen dem Einsatz von ACE-Hemmern und dem Rückgang der terminalen Nierenerkrankung ableiten, weil sowohl RAAS-Hemmer als auch die Dialyse heute viel breiter verfügbar sind als früher.
Warum ist es so schwierig, die Progression der Nephropathie aufzuhalten?
Schwierig wird es dann, wenn bei Patienten mit Proteinurie die GFR abfällt, weil der intraglomeruläre Druck ansteigt und ein sich selbst erhaltender Prozess in Gang kommt, der die Progression der Nephropathie weiter beschleunigt. Eine effektive antihypertensive Therapie kann in diesen Prozess zwar eingreifen, den natürlichen Verlauf der Nephropathie aber nicht stoppen.
Daraus ergibt sich die Konsequenz, frühzeitig, d.h. bevor die GFR abfällt, zu intervenieren und gezielt nach Patienten mit Mikroalbuminurie zu screenen. Die Effektivität dieser Strategie zeigt sich exemplarisch in der STENO-2-Studie (Gaede et al., New Engl J Med 2003), in der Typ-2-Diabetiker mit Mikroalbuminurie rekrutiert wurden und das ist ein weiterer wichtiger Aspekt der Studie – nicht nur eine intensivierte antihypertensive und antidiabetische, sondern auch eine lipidsenkende Therapie erhielten. STENO-2 und die anschließende Follow-up-Studie (Gaede et al., New Engl J Med 2008) haben deutlich gezeigt, wie wichtig diese multifaktorielle Intervention gerade bei Patienten mit Typ-2-Diabetes und Mikroalbuminurie ist. Das Risiko für kardiovaskuläre Ereignisse und für die Progression der Nephropathie ist bei diesen Patienten hoch, daher lässt sich der Benefit der Intervention schon in relativ kurzer Zeit dokumentieren. Wenn man die Patienten hingegen noch früher (im Stadium der Normoalbuminurie) behandelt, benötigt man wesentlich längere Beobachtungszeiten, um den Effekt der Intervention zu dokumentieren.
Wie ist die Situation bei Typ-1-Diabetes?
Hier sehen wir ebenfalls einen Rückgang der Dialysezahlen. Diese Patienten sind in der Regel auch einfacher zu therapieren, und die Prognose ist besser als bei Typ-2-Diabetes; Schwierigkeiten gibt nur bei einer kleinen Gruppe von Patienten mit sehr schlechter Diabeteseinstellung aufgrund mangelnder Compliance.
Welche Rolle spielt die Blutzuckerkontrolle im Rahmen der multifaktoriellen Intervention? In einer rezenten Metaanalyse von Boussageon et al. (BMJ 2011) blieb die Diabetestherapie auch in mikrovaskulärer Hinsicht hinter den Erwartungen zurück. Wie bewerten Sie die Datenlage?
Die Metaanalyse von Rémy Boussageon et al. ist interessant, weil sie eine Reihe von qualitativ hochwertigen Endpunktstudien inkludiert (Kumamoto Study, UKPDS, ACCORD, ADVANCE, VADT, HOME), allerdings berücksichtigt sie nur die Blutzuckerkontrolle, nicht aber die Blutdruckkontrolle und die Lipidsenkung. Tatsächlich legen die Ergebnisse nahe, dass der Effekt der intensivierten Diabetestherapie nicht so dramatisch ist, wie man vielleicht erwarten würde.
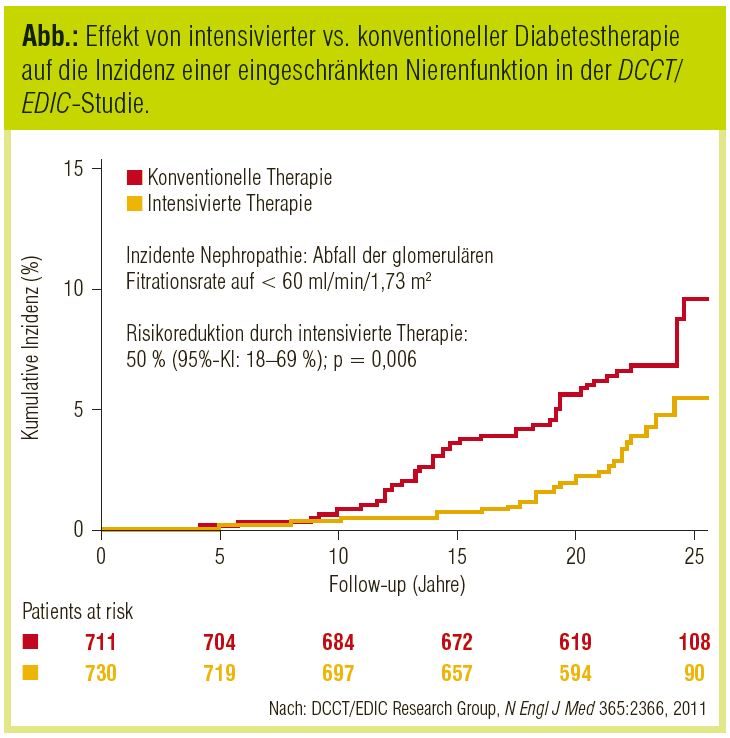
Auf der anderen Seite zeigen rezente Follow-up-Ergebnisse der DCCT-Studie bei Patienten mit Typ-1-Diabetes (DCCT/EDIC Research Group, New Engl J Med 2011), dass eine frühzeitige intensivierte Diabetestherapie im Vergleich zur Standardtherapie das Risiko für GFR-Abnahme und terminales Nierenversagen innerhalb von 22 Jahren um jeweils 50% reduziert (Abb.).
Für den Typ-2-Diabetes ergab die Nachbeobachtung der UKPDS über bis zu 10 Jahre bei Patienten, die während der Studie eine intensivierte Diabetestherapie erhielten, eine Reduktion mikrovaskulärer Endpunkte um 16-24% im Vergleich zur Kontrollgruppe (Holman et al., New Engl J Med 2008). Auch in der ADVANCE-Studie, die schon in der Erstauswertung eine signifikante Abnahme renaler Endpunkte (Neuauftreten oder Verschlechterung der Nephropathie) durch die intensivierte Blutzuckerkontrolle ergeben hat (ADVANCE Collaborative Group, New Engl J Med 2008), zeigen neuere Analysen eine Reduktion der terminalen Nierenerkrankung um ca. 35% (Zoungas et al., EASD Annual Meeting 2011). Die ADVANCE-Studie ist von besonderer Bedeutung, weil die Patienten zum Zeitpunkt der Randomisierung hinsichtlich Alter und Diabetesdauer in etwa den UKPDS-Teilnehmern nach Studienende entsprechen.
Metaanalysen sind also zweifellos wichtig, allerdings müssen wir auch die Resultate der einzelnen Studien für sich betrachten. Und da gibt es gute Evidenz aus großen prospektiven Studien, dass eine gute Diabeteseinstellung auf lange Sicht strukturelle Schäden in den Nieren vermeidet und die renale Prognose verbessert. Noch wichtiger für die Reduktion der Mortalität und der terminalen Niereninsuffizienz sind nach den Ergebnissen der STENO-2-Studie allerdings die Lipidsenkung und die Blutdrucksenkung.
Die Blutdrucksenkung auf der Ebene des RAAS gilt als zentrale Therapie der diabetischen Nephropathie. Ist das Potenzial der RAAS-Blockade mit ACE-Hemmern und ARB ausgeschöpft? Wie bewerten Sie die aktuellen Ergebnisse der ALTITUDE-Studie?
Es gibt sogar Evidenz dafür, dass ACE-Hemmer die Nephropathie noch günstiger beeinflussen als ARB. Vor allem aber weisen einige Studien darauf hin, dass die so genannte duale RAAS-Blockade, wie sie in ONTARGET (Telmisartan plus Ramipril) und in ALTITUDE (Aliskiren plus ACEHemmer oder ARB) untersucht wurde, bei Pa
tienten mit reduzierter GFR im Vergleich zur Monotherapie keinen Nutzen hat, aber die Komplikationsrate erhöht (ONTARGET Investigators, N Engl J Med 2008; Parving et al. Nephrol Dial Transplant 2009). Dagegen könnten Patienten mit Mikroalbuminurie, aber noch intakter Nierenfunktion von der Kombinationstherapie profitieren, wie wir das z. B. in der CALMStudie (Lisinopril plus Candesartan) gesehen haben (Mogensen et al., BMJ 2000; Tab.).
Die in ALTITUDE beobachteten Effekte der intensivierten Therapie (renale Komplikationen, nichtfatale Insulte, Hyperkaliämie, Hypotension) sind aus heutiger Sicht nicht zwingend eine Folge der Renin-Hemmung. Offenbar ist es so, dass eine zu starke RAAS-Hemmung bei Patienten mit overter Nephropathie mehr schadet als nützt. Schließlich erfüllt das RAAS wichtige physiologische Funktionen und hilft uns beispielsweise, in Stresssituationen besser zu überleben. Für Aliskiren ist die Lage nach dem Abbruch der ALTITUDE- Studie aber nicht einfacher geworden – auch weil aus den Gruppen der ACE-Hemmer und der ARB zahlreiche erprobte und auch billigere Alternativen für die Behandlung der inzipienten, aber auch der fortgeschrittenen Nephropathie zur Verfügung stehen.
Die Daten sollten uns aber darin bestärken, frühzeitig zu intervenieren, bevor es zum GFR-Abfall kommt.
Was können wir von neuen Therapieansätzen (BardoxolonMethyl, AGE-Antagonisten, PKC-Inhibitoren, Inhibitoren des Transforming Growth Factor β etc.) erwarten?
Der Nutzen von Bardoxolon ist noch nicht abzusehen. Bis jetzt sind nur kleinere Studien publiziert, eine größere Phase-III-Studie (BEACON; NCT01351675) läuft noch. In einer rezenten Studie (Pergola et al., Am J Nephrol 2011) bei 20 Patienten mit Typ-2-Diabetes und moderater bis schwerer Nephropathie kam es unter Therapie mit Bardoxolon zu einem signifikanten Anstieg der GFR. Das war für mich unerwartet und ist nicht notwendigerweise gut für die Patienten, weil es auf einen Druckanstieg in den Glomeruli hinweisen könnte. In einer Phase-II-Studie (BEAM) mit 227 Patienten stieg die GFR ebenfalls an und blieb über einen Zeitraum von 52 Wochen stabil (Pergola et al., New Engl J Med 2011). Endpunktstudien mit längeren Beobachtungszeiten wären aber von großem Interesse.
Skeptisch bin ich auch bei den anderen Wirkprinzipien, die Sie angesprochen haben: AGE-Antagonisten konnten in klinischen Studien bisher keine relevanten klinischen Erfolge aufweisen und waren zum Teil mit erheblichen Nebenwirkungen assoziiert. Ähnlich ist die Situation bei der Proteinkinase C und bei den Wachstumsfaktoren. Nephropathie ist eine schwerwiegende und mit heutigen Mitteln oft nur unzureichend behandelbare Erkrankung; daher ist zu begrüßen, dass intensiv nach neuen Therapieoptionen gesucht wird. Möglicherweise greifen die neuen Moleküle aber in Prozesse ein, die für die Pathogenese der Nephropathie nicht entscheidend sind. Beispielsweise spielen antiinflammatorische Effekte, wie sie von Bardoxolon-Methyl adressiert werden, im natürlichen Verlauf der diabetischen Nephropathie zwar eine Rolle, aber sie sind sicher nicht die primäre Ursache der Nierenschädigung. Ähnliches gilt für die anderen Wirkprinzipien, die in diesem Zusammenhang diskutiert werden.
Ihr Resümee aus der aktuellen Datenlage?
Ich glaube, die größte Aussicht auf Erfolg hat nach wie vor das Screening nach renalen Risikopatienten, damit wir diese frühzeitig identifizieren und behandeln können. Viele europäische Länder, darunter Österreich und die skandinavischen Staaten, gehen diesen Weg im Gegensatz etwa zu den USA, wo das Albuminurie-Screening deutlich geringeren Stellenwert hat. Die Patienten, die am meisten von der Intervention profitieren, sind aber jene mit beginnender Mikroalbuminurie, aber noch normaler GFR. Auf diese sollten wir unser Hauptaugenmerk legen. Eine generelle Therapie von Diabetespatienten ohne Proteinurie halte ich nicht für zielführend.
Außerdem lässt sich nicht abstreiten, dass Nephropathie bei Diabetikern praktisch immer als Folge einer langjährigen schlechten Blutzuckereinstellung aufritt. Im Rahmen des metabolischen Syndroms bei Patienten mit Typ-2-Diabetes kommen Bluthochdruck und Dyslipidämie erschwerend dazu – aus diesem Grund benötigen diese Patienten auch eine multifaktorielle Therapie. Die Basis der diabetischen Nephropathie ist aber die Hyperglykämie.
| Tab.: Mittlere Reduktion von Blutdruck und Albumin-Kreatinin-Ratio unter Therapie mit Lisinopril und/oder Candesartan bei Patienten mit Typ-2-Diabetes, Hypertonie und Mikroalbuminurie über 24 Wochen in der CALM-Studie |
|||||
|---|---|---|---|---|---|
| adjustierte mittlere Differenz* | |||||
| Candesartan | Lisinopril | Kombination | Kombination vs. Candesartan | Kombination vs. Lisinopril | |
| Diastolischer Blutdruck (mm Hg) |
10,4 (7,7-13,1); p < 0,001 |
10,7 (8,0-13,5); p < 0,001 |
16,3 (13,6-18,9); p < 0,001 |
5,9 (2,1-9,7); p = 0,003 |
5,6 (1,7-9,4); p = 0,005 |
| Systolischer Blutdruck (mm Hg) |
14,1 (8,9-19,2); p < 0,001 |
16,7 (11,4-21,9); p < 0,001 |
25,3 (20,3-30,3); p < 0,001 |
11,2 (4,1-18,4); p = 0,002 |
8,6 (1,4-15,9); p = 0,02 |
| Albumin-Kreatinin-Ratio (%) |
24 (0-43); p = 0,05 |
39 (20-54); p < 0,001 |
50 (36-61); p < 0,001 |
34 (3-55); p = 0,04 |
18 (-20 bis +44); p > 0,20 |
| * adjustiert für Zentrum, Art der Behandlung, Baseline-Wert, Gewicht und Veränderung des diastolischen Blutdrucks | |||||
| Nach: Mogensen et al., bmJ 321:1440, 2000 | |||||