Update – Kardio- und nephroprotektives Potenzial der Lipidtherapie
Patienten mit chronischen Nierenerkrankungen im Prädialyse- und Dialysestadium haben zumeist einen gestörten Lipidstoffwechsel. Neben erhöhten Triglyzeridwerten findet sich oft eine Erhöhung des Gesamtcholesterins und der LDL-Werte sowie ein erniedrigtes HDL-Cholesterin. Häufig ist das Lipoprotein(a) erhöht, und das LDL liegt in oxydierter, atherogener Form vor. Wohl auch deswegen haben diese Patienten abhängig vom Stadium der Erkrankung ein bis zu 400% gesteigertes Herz-Kreislauf-Risiko. Die Diagnose Diabetes erhöht dieses nochmals um rund 50%. Die pathologischen Lipidwerte steigern aber nicht nur das kardiale Risiko, sondern werden auch mit einer beschleunigten Progression der chronischen Nierenerkrankung in Zusammenhang gebracht.
Einfluss der Lipidsenkung auf das kardiovaskuläre Risiko
Patienten im Prädialysestadium. Bis vor Kurzem gab es keine klinische Endpunktstudie, die sich gezielt mit dem Effekt einer Statintherapie bei Patienten mit chronischer Niereninsuffizienz in unterschiedlichen Prädialysestadien auseinandergesetzt hat. Es standen bisher lediglich Daten aus Subgruppenanalysen der großen Statinstudien zur Verfügung (Shepherd et al., J Am Coll Cardiol 2008; Ridker et al., J Am Coll Cardiol 2010). Da eine fortgeschrittene Nierenfunktionsstörung bei den meisten dieser Studien jedoch als Ausschlusskriterium galt, hatten die inkludierten Patienten zumeist nur eine gering eingeschränkte Nierenfunktion (Kreatinin-Clearance > 50 ml/min). Dabei konnte gezeigt werden, dass das kardiovaskuläre Risiko bei einer ausreichenden Lipidsenkung zumindest im gleichen Ausmaß reduziert werden kann wie bei Patienten ohne Nierenerkrankung. Bei Patienten mit leicht eingeschränkter Nierenfunktion (Stadien 1 bis 3; Tab. 1) hat daher schon bisher eine Lipidtherapie mit Statinen als sehr effektiv und sicher gegolten.
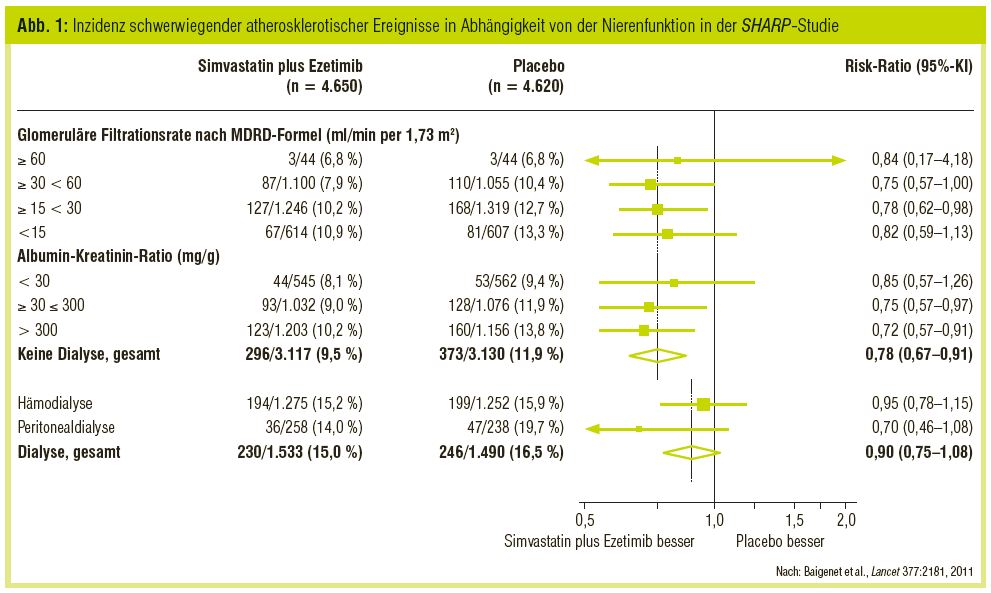
Bis vor wenigen Monaten bestand jedoch keine ausreichende Information über den Einsatz von Statinen bei Patienten mit chronischer Niereninsuffizienz in den Stadien 4 und 5 (Prädialyse). Mit großem Interesse wurden daher auch die im Juni 2011 publizierten Ergebnisse der SHARP-Studie (Baigenet et al., Lancet 2011) erwartet, in die (neben 3.000 Dialysepatienten) rund 6.000 Patienten in unterschiedlichen Prädialysestadien eingeschlossen waren; davon waren 2.150 Patienten im Stadium 3, 2.565 im Stadium 4 und 1.221 Patienten im Stadium 5 (Prädialyse) der chronischen Niereninsuffizienz. In dieser Studie wurde die Kombinationstherapie mit Simvastatin 20 mg plus Ezetimib 10 mg gegen Placebo über fünf Jahre untersucht. Unter der Therapie wurden die LDL-Werte um rund 32% auf Zielwerte von 85 mg/dl gesenkt. Dabei wurde die kardiovaskuläre Ereignisrate gegenüber Placebo im Stadium 3 um 25%, im Stadium 4 um 22% und im Stadium 5 um 18% reduziert (Abb. 1). Statistisch waren diese Ergebnisse im Stadium 3 und 4 signifikant und im Stadium 5 war ein eindeutiger Trend nachweisbar. Keinen Einfluss hatte die bei diesen Patienten gut tolerierte Therapie auf die Progression der Nierenerkrankung sowie die Albumin-/Proteinurie. Die Ursache, dass bei Patienten im Stadium 5 (Prädialyse) lediglich ein Trend und keine statistische Signifikanz gefunden wurde, liegt möglicherweise in der relativ geringen Patientenzahl. Sehr wahrscheinlich ist aber auch, dass im fortgeschrittenen Stadium der Niereninsuffizienz neben den klassischen kardiovaskulären Risikofaktoren zusätzlich auch eigene, urämiespezifische Faktoren das kardiale Risiko entscheidend mit beeinflussen.
In Zusammenschau der derzeit publizierten Daten bei Patienten mit chronischer Niereninsuffizienz in den Prädialysestadien der Erkrankung ist heute eine lipidsenkende Therapie mit Statinen bzw. Statin/Ezetimib bei gegebener Indikation indiziert. Aufgrund des sehr hohen kardiovaskulären Risikos dieser Patienten haben im Jahr 2011 die Europäische Fachgesellschaft für Kardiologie (ESC) sowie die Europäische Atherosklerosegesellschaft (EAS) in einer neuen Guideline Patienten mit chronischer Nierenerkrankung (glomeruläre Filtrationsrate < 60 ml/Minute) als kardiovaskuläre Höchstrisikopatienten eingestuft (ESC/EAS Task Force for the management of dyslipidaemias, Eur Heart J 2011). Der LDL-Zielwert für diese Patienten wurde mit < 70 mg/dl festgesetzt (Tab. 2). Die vorgestellten rezenten Studienergebnisse untermauern diese Empfehlung.
| Tab. 1: Einteilung der chronischen Niereninsuffizienz | ||
|---|---|---|
| Stadium | Glomeruläre Filtrationsrate (ml/min) | |
| 1 | > 89 | + pathologischer Harnbefund* |
| 2 | 60-89 | + pathologischer Harnbefund* |
| 3 | 30-59 | |
| 4 | 15-29 | |
| 5 | Prädialyse: < 15 | |
| * persistierende Mikroalbuminurie, Albuminurie, Proteinurie, Hämaturie | ||
| Nach: National Kidney Foundation, am J Kidney Dis 39(2 suppl 1):S1, 2002 | ||
| Tab. 2: Primäre Lipidzielwerte bei Patienten mit hohem bzw. sehr hohem kardiovaskulärem Risiko (ESC/EAS-Guidelines 2011 |
|---|
|
| Nach: ESC/EAS Task Force for the management of dyslipidaemias, eur Heart J 32:1769, 2011 |
Dialysepatienten. Bisher waren die Ergebnisse einer Statintherapie bei Dialysepatienten aus 2 Studien bekannt: 4D-Studie (Die Deutsche Diabetes Dialyse Studie) (Wanner et al., New Engl J Med 2005) inkludierte 1.255 Dialysepatienten mit Typ-2-Diabetes, die mit Atorvastatin 20 mg versus Placebo behandelt wurden. Trotz einer LDL-Senkung um 42% auf Zielwerte von median 72 mg/dl zeigte sich über 5 Jahre keine Beeinflussung des kardiovaskulären Risikos bei diesen Patienten. In der AURORA-Studie (Fellström et al., New Engl J Med 2009) wurde bei 2.800 Dialysepatienten Rosuvastatin 10 mg versus Placebo untersucht. Trotz einer ausgeprägten LDL-Senkung um 43% auf einen durchschnittlichen Zielwert von 58 mg/dl LDL-Cholesterin zeigte sich auch in dieser Studie über 4 Jahre keine Besserung des kardiovaskulären Risikos durch die Statintherapie.
Die bereits erwähnte SHARP-Studie hat neben den Prädialyse-Patienten auch bei 3.023 Dialysepatienten die Therapie mit Simvastatin 20 mg plus Ezetimib 10 mg gegen Placebo über 5 Jahre getestet. Die LDL-Senkung war im Durchschnitt 23 mg/dl und der LDL-Zielwert 80 mg/dl. Wie bei den beiden Vorstudien konnte auch in dieser Studie keine signifikante Reduktion atherosklerotischer Ereignisse erreicht werden (Abb. 1).
Warum Dialysepatienten von einer lipidsenkenden Therapie nicht unmittelbar profitieren, wird vielfach diskutiert. Vermutlich ist eine veränderte Pathophysiologie für die Entstehung kardiovaskulärer Erkrankungen bei Patienten im Dialysestadium verantwortlich (Yamamota et al., Curr Opin Nephrol Hypertens 2009). Bei Dialysepatienten werden Herz-Kreislauf-Ereignisse häufig nicht durch die Ruptur eines lipidreichen Plaques, sondern durch andere Ursachen ausgelöst. Gefäßverschlüsse entstehen bei diesen Patienten häufig durch Kalzifizierung im Rahmen des sekundären Hyperparathyreoidismus. Rund 60% der kardiovaskulären Todesfälle bei Dialysepatienten werden durch Herzrhythmusstörungen verursacht. Diese werden nicht nur durch eine kardiale Ischämie, sondern auch durch die bei diesen Patienten häufige Linksventrikelhypertrophie und andere urämiespezifische Myokardveränderungen sowie durch Störungen des Elektrolythaushaltes induziert (Cheung et al., Kidney Int 2004).
Aufgrund der vorliegenden Daten aus drei großen Endpunktstudien bei Dialysepatienten (4D, AURORA, SHARP) kann für eine generelle lipidsenkende Therapie keine Evidenz nachgewiesen werden. Sie stellt damit bei diesen Patienten auch, trotz des hohen kardiovaskulären Risikos, keine routinemäßige Standardtherapie dar. Weiters muss jedoch im Einzelfall durch den behandelnden Nephrologen überprüft werden, ob ein individueller Patient, wie z.B. nach einem rezent durchgemachten Myokardinfarkt, von einer Statintherapie profitieren könnte.
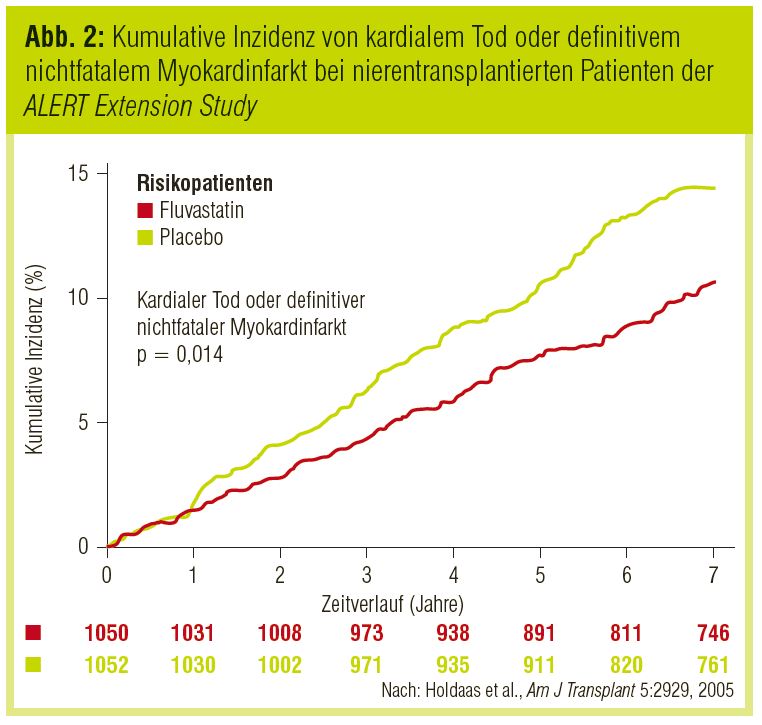
Patienten nach Nierentransplantation. Hier liegen Daten der bereits vor über 8 Jahren publizierten ALERT-Studie (Holdaas et al., Lancet 2003) vor. Dabei wurde der Effekt von 40 mg Fluvastatin bei Patienten nach Nierentransplantation gezeigt. Bei über 2.100 Patienten wurde das LDL-Cholesterin um 32% auf im Durchschnitt 105 mg/dl gesenkt. Obwohl hinsichtlich des kombinierten primären Studienendpunkts (kardialer Tod, nichtfataler Myokardinfarkt, koronare Intervention) lediglich ein günstiger Trend nachweisbar war, traten im Vergleich zu Placebo signifikant weniger kardiovaskuläre Todesfälle und Myokardinfarkte auf. In einer Nachbeobachtungsphase (ALERT Extension Study; Holdaas et al., Am J Transplant 2005) setzte sich der günstige Effekt weiter fort (Abb. 2). Trotzdem muss bei transplantierten Patienten auf die mögliche Interaktion mit der immunsuppressiven Therapie geachtet werden. Auch die Einhaltung der allgemeinen Vorsichtsmaßnahmen (niedrige initiale Statindosis, Vorsicht bei der Gabe von Makrolidantibiotika, Fibraten, Nikotinsäure etc.) trägt zur Therapiesicherheit bei.
Einfluss der Lipidsenkung auf die Progression der Nierenerkrankung
Lipidstoffwechselstörungen mit hohem LDL- und vermindertem HDL-Cholesterin werden, vor allem bei schon manifester chronischer Nephropathie, mit einer beschleunigten Progression der Erkrankung in Zusammenhang gebracht. Experimentelle Studien zeigen eine Zunahme der glomerulären Schädigung mit Proliferation der Mesangiumzellen, Stimulation und vermehrter Apoptose der Podozyten sowie einer Aktivierung der Endothelzellen (Amann et al., Nephrol Dial Transplant 2011).
Post-hoc-Analysen aus großen klinischen Studien wie der Helsinki Heart Study, der Physicians Health Initiative und der ARIC-Studie beschreiben einen wenn auch teilweise sehr geringen negativen Einfluss einer Hyperlipidämie auf die Nierenfunktion (Schaeffner et al., J Am Soc Nephrol 2003; Munter et al., Kidney Int 2000). In anderen Studien konnte dieser Einfluss nicht nachgewiesen werden (Kshirsagar et al., Am J Kidney Dis 2005). Daraus leitet sich die Frage ab, ob eine Statintherapie einen günstigen Einfluss auf die exkretorische Nierenfunktion und/oder die renale Eiweißausscheidung hat.
Effekt der Lipidsenkung auf Albuminurie und Proteinurie. Eine Proteinurie verschlechtert nicht nur das kardiovaskuläre Langzeitrisiko, sondern beschleunigt auch die Progression chronischer Nierenerkrankungen. Die klinische Datenlage zu einer möglichen günstigen Beeinflussung durch eine Statintherapie ist jedoch derzeit nicht konklusiv. In zwei Metaanalysen war bei insgesamt 633 Patienten ein günstiger Effekt nachweisbar (Douglas et al., Ann Intern Med 2006; Strippoli et al., BMJ 2008). In einer der beiden Analysen wurde eine 48%-Reduktion der Albuminausscheidung unter Statinen bei Patienten bei Mikroalbuminurie und Makroalbuminurie gezeigt. In der zweiten Metaanalyse war eine Reduktion der Proteinurie um 730 mg pro Tag nachweisbar. Allerdings hatte eine große Zahl der inkludierten Patienten mit renalem Eiweißverlust keine Standardtherapie mit einem ACE-Hemmer oder Angiotensinrezeptorblocker.
Im Gegensatz zu den Ergebnissen dieser beiden Metaanalysen konnte die PREVENDIT-Studie (Asselbergs et al., Cir culation 2004) bei 864 normotensiven Patienten mit Mikroalbuminurie keinen Effekt auf den Eiweißverlust unter Pravastatin zeigen, unabhängig davon, ob Patienten mit dem ACE-Hemmer Fosinopril behandelt worden waren oder nicht. Die ESPLANADE-Studie (Ruggenenti et al., Clin J Am Soc Nephrol 2010) hat den Effekt von Fluvastatin gegen Placebo auf die Proteinurie (> 500 mg/Tag) bei 186 Patienten getestet. Die Patienten hatten gleichzeitig eine duale Hemmung des Renin-Angiotensin-Aldosteron-Systems (RAAS) und waren normotensiv. Auch bei dieser Patientengruppe konnte kein Einfluss auf die Proteinurie unter Fluvastatin nachgewiesen werden.
Somit stehen die Aussagen von zwei randomisierten Studien den Ergebnissen aus den zwei Metaanalysen ohne Standardtherapie mit einem RAAS-Hemmer gegenüber. Der Effekt von Statinen auf den renalen Eiweißverlust ist daher derzeit nicht gesichert. Effekt der Lipidsenkung auf die exkretorische Nierenfunktion. Auch zum diskutierten nephroprotektiven Effekt von Statinen liegen derzeit widersprüchliche Daten vor. In einer Subanalyse der TNT-Studie (Shepherd et al., Clin J Am Soc Nephrol 2007) wurde der Effekt von 10 mg im Vergleich zu 80 mg Atorvastatin auf die Nierenfunktion von Patienten mit koronarer Herzkrankheit ohne bekannte Nierenerkrankung untersucht. Dabei zeigte die Statintherapie einen günstigen Effekt auf die Nierenfunktion. Die mittlere glomeruläre Filtrationsrate besserte sich sogar (in der Gruppe mit 80 mg Atorvastatin um 5,2 ml/min und in der Gruppe mit 10 mg Atorvastatin um 3,5 ml/min über 5 Jahre). Im Gegensatz dazu konnte in der bereits angeführten PREVENDIT-Studie bei Patienten mit Albuminurie und nahezu erhaltener exkretorischer Nierenfunktion kein positiver
Effekt einer Statintherapie auf die Nierenfunktion gezeigt werden. In einer rezenten Metaanalyse (11 Studien mit 548 Patienten und unterschiedlich eingeschränkter Nierenfunktion) zeigte sich kein Einfluss von Statinen auf den Verlauf der Nierenfunktion (Navaneethan et al., Cochrane Database Syst Rev 2009). Auch in der bereits angeführten SHARP-Studie war bei den 6.247 Patienten mit eingeschränkter Nierenfunktion im Prädialysestadium trotz guter Lipidsenkung mit Simvastatin/Ezetimib kein Einfluss auf die Progression der exkretorischen Nierenfunktion oder die Albuminurie zu beobachten.
Resümee
Aufgrund der vorliegenden, nicht konklusiven Datenlage ist derzeit eine Statintherapie zur primären Nephroprotektion nicht indiziert. Zur Progressionsverzögerung sind Maßnahmen wie eine effektive Blutdrucksenkung und Verabreichung eines RAAS-Hemmers eindeutig vorrangig. Trotzdem hat die Lipidsenkung im Prädialysestadium ihren fixen Stellenwert. Neben dem möglichen günstigen Effekt auf die Nierenfunktion hat die Statintherapie einen erwiesen Vorteil für das kardiovaskuläre Risiko dieser Patienten gezeigt. Entsprechend dem sehr hohen Risiko chronisch nierenkranker Patienten wird ein LDL-Cholesterinwert unter 70 mg/dl empfohlen. Im Gegensatz dazu konnte bei Dialysepatienten kein günstiger Effekt auf die kardiovaskuläre Prognose gezeigt werden. Der Einsatz von Statinen bei diesen Patienten wird daher auch nicht allgemein empfohlen, sondern bleibt Einzelentscheidungen vorbehalten.