Update – Nephroprotektives Potenzial der Blutdrucktherapie
Der natürliche Verlauf chronischer Nierenerkrankungen (CKD) ist durch einen schleichenden, graduellen Verlust der Nierenfunktion gekennzeichnet, an dessen Ende die Notwendigkeit einer Nierenersatztherapie steht. Für das Fortschreiten der Niereninsuffizienz ist das Zusammenspiel vieler Faktoren verantwortlich. Unter ihnen nimmt die Hypertonie eine besondere Stellung ein. Sie ist nicht nur Auslöser einer hypertensiven/vaskulären Nephropathie, sondern oft entscheidender Progressionsfaktor bei Nierenerkrankungen anderer Genese. Besonders glomeruläre Erkrankungen, die mit einer Proteinurie einhergehen, verschlechtern sich unter dem Einfluss hypertensiver Blutdruckwerte rasch.
Weltweit sind Hypertonie und Diabetes mellitus in den letzten zwei Jahrzehnten hauptverantwortlich für den Anstieg der Zahl terminal niereninsuffizienter Patienten. Abbildung 1 zeigt die Prävalenz von dialysepflichtigen Patienten in Österreich seit den 1960er-Jahren bis zum Jahr 2010. Da der Verlust der Nierenfunktion nicht nur eine teure Nierenersatztherapie erforderlich macht, sondern auch mit beachtlicher Komorbidität sowie einer dramatisch erhöhten Rate von kardiovaskulären Ereignissen und Mortalität verknüpft ist, sind Strategien zur Nephroprotektion dringend erforderlich. Vor allem durch Blutdrucksenkung konnten in den letzten Jahren Erfolge bei der Progressionsverzögerung von Nierenerkrankungen und bei der Reduktion kardiovaskulärer Ereignisse erreicht werden. Vielfach wird die Bedeutung einer konsequenten Hypertoniebehandlung bei renalen Patienten aber unterschätzt und eine Normalisierung erhöhter Blutdruckwerte nicht mit Nachdruck angestrebt.
Pathophysiologie des Nierenfunktionsverlustes
Zu traditionellen pathophysiologischen Mechanismen, die zu einer Blutdruckerhöhung bei renalen Patienten führen, zählen die Vermehrung des extrazellulären Volumens bzw. eine übermäßige Aktivierung des Renin-Angiotensin-Aldosteron-Systems (RAAS). Auch die Bedeutung einer erhöhten sympathischen Aktivität, der Verminderung vasodilatierender Substanzen oder einer vermehrten Endothelinproduktion wurde mittlerweile nachgewiesen. Strukturelle Veränderungen (z.B. Mediahypertrophie und Intimaverdickung, Ablagerungen von hyalinartigem Material in der Wand der Arteriolen, Einengungen der intrarenalen Gefäße mit renaler Ischämie) spielen ebenso eine bedeutende Rolle. Hohe systemische Blutdruckwerte und/oder eine fehlende renale Autoregulation aufgrund vorgeschädigter Nieren führen zum Anstieg des intraglomerulären Druckes, zu Schädigungen der glomerulären Kapillaren und Mesangiumzellen und unter dem Einfluss einer vermehrten Produktion von Angiotensin II zur glomerulären Sklerose. Als zusätzlicher Faktor beschleunigt eine Proteinurie das Fortschreiten der Niereninsuffizienz, wobei hier, neben mesangialen Veränderungen, auch tubuläre Schädigungen und die Expression proinflammatorischer Zytokine eine Rolle spielen. Das Ausmaß der Proteinurie korreliert eng mit der Geschwindigkeit des renalen Funktionsverlustes.
Hypertonie und Niere
Der Grad der Hypertonie korreliert mit der Schwere der Nierenerkrankung, ist aber gleichzeitig mitbestimmend für die Geschwindigkeit des Fortschreitens der Erkrankung. Eine frühe Metaanalyse von Bakris et al., die Studien zur Blutdrucksenkung in Hinblick auf die erreichte Blutdruckkontrolle analysierte, fand eine enge Beziehung zwischen der Blutdruckkontrolle und der Änderung der Nierenfunktion. Eine bessere Blutdrucksenkung resultierte in einer Verzögerung des renalen Funktionsverlustes.
Blutdruckzielwerte bei renalen Patienten
Eine Blutdrucksenkung auf unter 140 mmHg systolisch ist, wie in der RENAAL-Studie gezeigt, besonders bei hohen Ausgangswerten nephroprotektiv (Tab. 1). Diese und andere Studienergebnisse spiegeln sich in den letzten Guidelines internationaler Fachgesellschaften wider, die bei chronisch niereninsuffizienten Patienten Zielwerte von unter 130/80 mmHg, bei gleichzeitig bestehender Proteinurie sogar von unter 125/75 mmHg, empfehlen. Ob es ähnlich wie für kardiovaskuläre Ereignisse auch für renale Endpunkte eine J-Kurve des Blutdrucks gibt, ist nicht endgültig geklärt.
In einer Post-hoc-Analyse des IDNT-Trial waren selbst im normotonen Bereich tiefere Werte mit einem besseren renalen Überleben assoziiert. Zum Teil bedingt durch das Studiendesign (z.B. kurzer Beobachtungszeitraum), konnte allerdings nicht in allen Studien gezeigt werden, dass das renale Überleben durch eine strikte Blutdruckkontrolle signifikant beeinflusst wird, so z.B. in der ABCD-Studie oder der REIN-2-Extension-Studie. Im 5 Jahre dauernden ESCAPE-Trial zeigte sich bei Kindern mit CKD-Stadium 24 in 24-Stunden-Messungen ein Vorteil für niedrignormale Blutdruckwerte im Vergleich zu einer konventionellen Blutdruckkontrolle (Abb. 2). Möglicherweise können bei Erwachsenen tiefe Blutdruckwerte, die das renale Überleben positiv beeinflussen würden, aufgrund von kardiovaskulären Limitationen nicht angestrebt werden. Besonders bei Vorliegen koronarer Probleme scheint eine aggressive Blutdrucksenkung auf unter 130 mmHg systolisch mehr Risiken als Vorteile zu bringen. Es ist daher eine differenzierte Zielvorgabe beim Einzelpatienten in Anhängigkeiten von bestehenden Begleiterkrankungen angezeigt.
Beinahe alle Hypertoniestudien bei renaler Insuffizienz stützen sich auf Blutdruckwerte, die durch Arztmessungen erhoben wurden. Mittlerweile ist aber bekannt, dass die 24-Stunden-Blutdruckmessung ein besserer Prädiktor für nicht tödliche und tödliche kardiovaskuläre Ereignisse ist. Auch das Tag-Nacht-Verhältnis des Blutdrucks ist für die Risikoeinschätzung wichtig. In einigen Studien wurde postuliert, dass Non-dipping einen Risikofaktor für einen schnelleren Verlust der Nierenfunktion darstellt. Die endgültige Antwort auf diese Frage bleibt vorerst unbeantwortet und könnte nur in großen prospektiven Studien geklärt werden.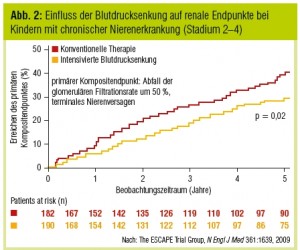
| Tab. 1: Einfluss der initialen systolischen Blutdruckwerte auf renale Prognose und Mortalität in der reNaaL-Studie (gepoolte Daten der Behandlungsgruppen) | ||||
|---|---|---|---|---|
| SBP (mmHG) |
Patienten | Ereignisse (%) | HR (95%-KI) | p-Wert |
| Primärer Endpunkt | ||||
| < 130 | 169 | 60 (35,5) | 1,00 (Referenz) | … |
| 130-139 | 209 | 66 (31,6) | 0,84 (0,59-1,20) | 0,34 |
| 140-159 | 610 | 267 (43,8) | 1,28 (0,97-1,69) | 0,08 |
| 160-197 | 373 | 206 (55,2) | 1,82 (1,36-2,42) | < 0,001 |
| ≥ 180 | 152 | 87 (57,2) | 1,85 (1,33-2,57) | < 0,001 |
| Terminale Nierenerkrankung |
||||
| < 130 | 169 | 26 (15,4) | 1,00 (Referenz) | … |
| 130-139 | 209 | 33 (15,8) | 0,97 (0,581,63) | 0,92 |
| 140-159 | 610 | 127 (20,8) | 1,37 (0,902,10) | 0,14 |
| 160179 | 373 | 112 (30,0) | 2,13 (1,393,27) | < 0,001 |
| ≥ 180 | 152 | 43 (28,3) | 2,02 (1,243,29) | 0,005 |
| Terminale Nierenerkrankung oder Tod | ||||
| < 130 | 169 | 43 (25,4) | 1,00 (Referenz) | … |
| 130-139 | 209 | 56 (26,8) | 1,00 (0,671,49) | 0,99 |
| 140-159 | 610 | 211 (34,6) | 1,38 (0,991,91) | 0,06 |
| 160179 | 373 | 171 (45,8) | 1,96 (1,402,74) | < 0,001 |
| ≥ 180 | 152 | 74 (48,7) | 2,10 (1,443,06) | < 0,001 |
| Primärer Endpunkt: Verdopplung des Serumkreatinins, terminale Nierenerkrankung oder Tod; HR = Hazard Ratio; SBP = systolischer Blutdruck | ||||
| Nach: Bakris et al., Arch Intern Med 163:1555, 2003 | ||||
Rolle der Proteinurie
Viele renale Erkrankungen sind durch das Auftreten einer Proteinurie charakterisiert. Die Reduktion der Proteinurie stellt neben der Kontrolle der arteriellen Hypertonie ein unabhängiges Therapieziel bei nephrologischen Patienten dar. Im MDRD-Trial konnte pro 1 Gramm Proteinuriereduktion innerhalb von 4 Monaten der GFR-Verlust um 1 ml/min/Jahr gesenkt werden. Ähnliches zeigten die Ergebnisse der HOPE-Studie, in welcher in der mit ACE-Hemmer therapierten Studiengruppe nach einem Jahr pro Gramm reduzierter Eiweißausscheidung eine um 2 ml/min verbesserte GFR nachweisbar war. Dass eine Blutdrucksenkung imstande ist, die Proteinurie positiv zu beeinflussen, wurde schon mehrmals nachgewiesen (MDRD-, AASK-, ABCD-Studie). Gerade proteinurische Patienten profitieren am stärksten von einer aggressiven Blutdrucksenkung. Dies dürfte im Besonderen für Patienten mit afrikanischen Wurzeln zutreffen, die in der AASK-Studie vor allem dann, wenn die Proteinausscheidung größer als 0,2 g pro Tag war, durch eine starke Blutdrucksenkung (mean arterial pressure, MAP < 90 mmHg) renal am besten geschützt waren. Die klinische Konsequenz aus diesen Erkenntnissen ist, dass proteinurische Patienten besonders gut antihypertensiv eingestellt werden müssen, da sie durch normotone Werten am besten vor einem Fortschreiten der chronischen Niereninsuffizienz geschützt sind.
Therapeutische Implikationen
In den unterschiedlichen therapeutischen Konzepten zur Nephroprotektion haben Blutdruckkontrolle und Proteinuriereduktion einen herausragenden Stellenwert. Während unterschiedliche Antihypertensiva ähnlich stark blutdrucksenkend wirken, sind sie unterschiedlich gut geeignet, auch eine Proteinurie zu senken. Besonders gut untersucht in Hinblick auf diesen dualen (blutdruck- und proteinuriesenkenden) Wirkmechanismus sind Substanzen, die in das RAAS eingreifen, wie ACE-Hemmer, Angiotensinrezeptorblocker (ARB) und zuletzt auch direkte Reninhemmer. Sie weisen im Vergleich zu anderen Substanzklassen Vorteile in Hinblick auf das renale Überleben auf. In Studien mit kurzer Beobachtungszeit lassen sich diese positiven Effekte nachweisen. Ob diese Effekte auch über einen langen Zeitraum anhalten, ist derzeit Thema kritischer wissenschaftlicher Diskussionen. Zweifel an einem generellen Erfolg einer Langzeittherapie begründen sich auf Beobachtungen, dass unter RAAS-Hemmer-Therapie ein Rebound der Proteinurie, teilweise auf Ausgangswerte, beobachtet werden kann. Erklärt wird dieser Wiederanstieg durch ein Aldosteron-Escape-Phänomen, das unter chronischer ACE-Hemmer-Therapie bei etwa 40% der behandelten Patienten auftritt. Hier kann die additive Gabe eines Aldosteronantagonisten (sofern nicht durch die Niereninsuffizienz kontraindiziert) positive Wirkungen bringen.
Auch eine Aktivierung alternativer Wege der Angiotensin-II-Bildung (z.B. über Cathepsin G, Chymasen) wurde als Ursache für die nachlassende Wirkung von ACE-Hemmern in der Langzeittherapie diskutiert. Um dies zu verhindern, wurde das Konzept der dualen RAAS-Blockade entwickelt. Zumindest Surrogatendpunkte wie Blutdrucksenkung und Proteinuriesenkung wurden in Kurzzeitstudien positiv beeinflusst. Klinische Endpunktstudien waren allerdings nicht erfolgreich. Sowohl in der ONTARGET-Studie (ACE-Hemmer und ARB) als auch in der soeben vorzeitig abgebrochenen ALTITUDE-Studie (Renininhibitor und ARB oder ACE-Hemmer) brachte die Kombinationstherapie keine therapeutischen Vorteile. In beiden Studien war keine Protektion, sondern eine Häufung kardiovaskulärer und/oder renaler Komplikationen zu beobachten. Aus diesem Grund wird wohl die duale RAAS-Hemmung bei kardiovaskulären Risikopatienten, aber auch bei Patienten mit chronischer Niereninsuffizienz in Zukunft nicht mehr eingesetzt werden. Ob unter engmaschiger Kontrolle für eine Subgruppe (z.B. proteinurische Patienten) doch Vorteile bestehen, wird sicherlich in Post-hoc-Analysen der erwähnten Studien (falls von den Fallzahlen überhaupt möglich) untersucht werden. Als zusätzliches Therapiekonzept bei renalen Patienten rückt in den letzten Jahren auch die Modulation des sympathischen Nervensystems wieder mehr ins Zentrum des Interesses. Für Sympatholytika wurden neben antihypertensiven auch antiproteinurische Effekte gezeigt. Allerdings fehlen für diese Substanzklassen Endpunktstudien, die aufgrund der Tatsache, dass sympatholytische Medikamente bereits als Generika verfügbar sind, wohl weder in naher noch in ferner Zukunft durchgeführt werden. Ob die renale Sympathikusdenervierung, die vorerst nur bei therapieresistenten Hypertonikern Anwendung findet und als junge Methode natürlich einer kritischen Langzeitbegutachtung bedarf, in der Zukunft eine unterstützende Therapieoption für Nierenpatienten darstellen wird, bleibt abzuwarten.
Literatur beim Verfasser






















































































