Neue Therapieoptionen bei diabetischer Nephropathie
Diabetische Nephropathie ist heutzutage die häufigste Ursache des chronischen Nierenversagens – bis zu 40% der Neuzugänge zur Dialyse leiden an diabetischer Nephropathie. In den letzten Jahren konnten neue Medikamente nicht nur tierexperimentell, sondern auch in Phase-II- und Phase-III-Studien erprobt werden. Die molekulare Basis der diabetischen Nephropathie wird nur teilweise verstanden, sowohl hämodynamische Faktoren als auch metabolische Prozesse spielen eine entscheidende Rolle. Der Angriffspunkt an Stoffwechselprozessen und Hämodynamik der Niere wird durch verschiedene Medikamente ermöglicht, manche Hoffnungen in zuletzt durchgeführten Studien haben sich jedoch nicht erfüllt, so z.B. die Reninhemmung durch Aliskiren in Kombination mit Angiotensin-II-Blockade in der ALTITUDE-Studie (NCT 00549757) sowie Beeinflussung der Membranpermeabilität durch Sulodexid in der Sun-MACRO-Studie (Packham et al., J Am Soc Nephrol 2012) – beide Studien wurden vorzeitig abgebrochen. Eine neue viel versprechende Substanz (Bardoxolon-Methyl) wird zurzeit in der großen BEACON-Studie (NCT01351675) geprüft und an anderer Stelle in DIABETES FORUM diskutiert (siehe Beitrag “Bardoxolon-Methyl: Prinzip, Evidenz, möglicher Stellenwert”).
Aufgrund der weltweit drastisch steigenden Zahl von Patienten mit Typ-1- und Typ-2-Diabetes ist das vermehrte Auftreten diabetischer Nephropathie in den letzten Jahren nicht nur für die steigende Zahl an Patienten mit Nierenersatztherapie (Hämodialyse oder Peritonealdialyse) und Transplantation mitverantwortlich, Morbidität und Mortalität von Patienten mit diabetischer Nephropathie sind schon im Stadium der Mikroalbuminurie und Proteinurie deutlich erhöht. Mit steigendem Kreatinin und fallender glomerulärer Filtrationsrate (eGFR) nehmen diese klinischen Endpunktparameter weiter drastisch zu. Medikamente zur Progressionshemmung hätten daher einen großen Stellenwert für das Gesundheitswesen. Diesbezüglich sollen die wichtigsten klinischen Entwicklungen dargestellt werden.
Advanced glycosylation endproduct Inhibitors
Die erfolgreiche Verhinderung der Bildung von advanced glycosylation endproducts (AGE) wird seit Jahrzehnten im Tierexperiment beforscht. In der zuletzt publizierten ACTIONI-Studie (Bolton et al., Am J Nephrol 2004) bei 690 Patienten mit Typ-1-Diabetes zeigte sich kein zusätzlicher Nutzen bei manifester diabetischer Nephropathie, jedoch multiple Nebenwirkungen (Anämie, Leberinsuffizienz, Glomerulonephritis) des AGE-Inhibitors Pimagedin (Aminoguanidin), sodass die geplante Studie bei Typ-2-Diabetes (ACTIONII; Freedman et al., Control Clin Trials 1999) abgebrochen wurde. Die im Tierexperiment erfolgreiche Substanz hat die Hoffnungen nicht erfüllt.
ALT-946, ein stärkerer AGE-Inhibitor als Aminoguanidin, war im Tierexperiment erfolgreich (Wilkinson-Berka et al., Diabetes 2002), klinische Studien fehlen aber. Eine Phase-II-Studie mit Pyridoxamin (Pyridoxin) an einer kleinen Gruppe von 214 Patienten mit Typ-1- oder Typ- 2-Diabetes zeigte einen Trend zur Besserung der Nephropathie ohne massive Nebenwirkungen (Williams et al., Am J Nephrol 2007). Pyridoxamin ist eine der 3 Formen von Pyridoxin (Vitamin B6). Die Patienten wurden randomisiert mit oder ohne begleitende Blockade des Renin-Angiotensin-Aldosteron-Systems (RAAS) untersucht. In der rezentesten Studie (Lewis et al., J Am Soc Nephrol 2012) mit 317 Patienten, placebokontrolliert über ein Jahr, konnten jedoch für keinen einzigen Endpunkt (Proteinurie, Kreatininanstieg) signifikante Unterschiede gezeigt werden.
Im Tierexperiment konnte auch für Thiamin und Benfotiamin (ein Vitamin-B1-Derivat) durch Reduktion der AGE sowie der Proteinkinase C ein Effekt gezeigt werden, klinische Studien stehen für diese Substanzen aus. AGE-Crosslink-Breaker wurden bis dato nur im Tiermodell mit ermutigenden Ergebnissen untersucht. Beispielhaft seien hier ALT-711 (Alagebrium; Coughlan et al., Endocrinology 2007) sowie TRC4186 angeführt (Joshi et al., J Cardiovasc Pharmacol 2009).
Eine weitere Gruppe sind Antagonisten von AGE-Rezeptoren (RAGE), die sowohl AGE-verursachte Gefäßschäden als auch Proteinurie beeinflussen können (Jensen et al., Horm Metabol Res 2005). Hier könnte noch größeres klinisches Potenzial liegen.
Proteinkinase-C-Inhibitoren
Die β1-Isoform der Proteinkinase C (PKC-β1) wird durch Hyperglykämie aktiviert und führt zu renaler Hypertrophie, Gewebeschädigung und Fibrose. Ruboxistaurin-Mesylat führt zu spezifischer Hemmung der PKC-β1. In Tiermodellen diabetischer und hypertensiver Nephropathie schwächte Ruboxistaurin die Wirkungen von aktivierter PKC-β1 ab, normalisierte die glomeruläre Hyperfiltration und reduzierte Proteinurie, Glomerulosklerose sowie tubulointerstitielle Fibrose. Bei den ersten Anwendungen bei Patienten mit diabetischer Nephropathie kam es zu keinen nennenswerten Nebenwirkungen (Tuttle et al., Diabetes Care 2005), jedoch war die placebokontrollierte Studie aufgrund der Dauer und der kleinen Patientenzahl (n = 123) nur bedingt aussagekräftig. Größere Studien sind in Planung, um ein genaueres Wirk- und Nebenwirkungsprofil bei diabetischer Nephropathie zu charakterisieren.
Ruboxistaurin (Arxxant®) wurde bei der US Food and Drug Administration (FDA) zur Marktzulassung in der Therapie fortgeschrittener diabetischer Retinopathie 2006 eingereicht, weitere Studien wurden jedoch angefordert.
Aldosereduktasehemmer und Sorbitolreduktaseinhibitoren
Beide Substanzklassen werden seit Jahrzehnten experimentell und am Menschen untersucht und waren im Tierexperiment, insbesondere bei diabetischer Neuropathie, in der Primär- und Sekundärprophylaxe erfolgreich, jedoch traten beim Menschen oft massive Nebenwirkungen (Lebertoxizität) auf. Die bis dato untersuchten Substanzen Sorbinil und Tolrestat wurden deswegen vom Markt genommen. Klinische Daten des nicht mehr verwendeten Zopolrestat zur Nephropathie stehen aus. Eine neue Substanz, Ranirestat, befindet sich zurzeit in einer Phase-III-Studie zur Neuropathie, Daten zur Nephropathie fehlen.
Anfängliche Theorien zur Pathophysiologie gingen hauptsächlich von einer Schädigung der Zelle über den Polyol-Signal weg durch Kumulierung von Sorbitol aus. Wichtiger erscheinen heute bei Hyperglykämie und Glukoseabbau im Polyolsignalweg die Bildung freier Sauerstoffradikale, PKCAktivierung und AGE-Bildung. So gesehen würden Aldosereduktasehemmer diese Bildung sehr früh beeinflussen.
Endothelinrezeptorantagonisten
Unter den bekannten Endothelinrezeptorblockern (Ambrisentan, Atrasentan, Avosentan, Clazosentan, Darusentan, Sitaxentan, Bosentan) hat bisher nur Bosentan (Tracleer®) bei pulmonaler Hypertension die Marktzulassung erreicht.
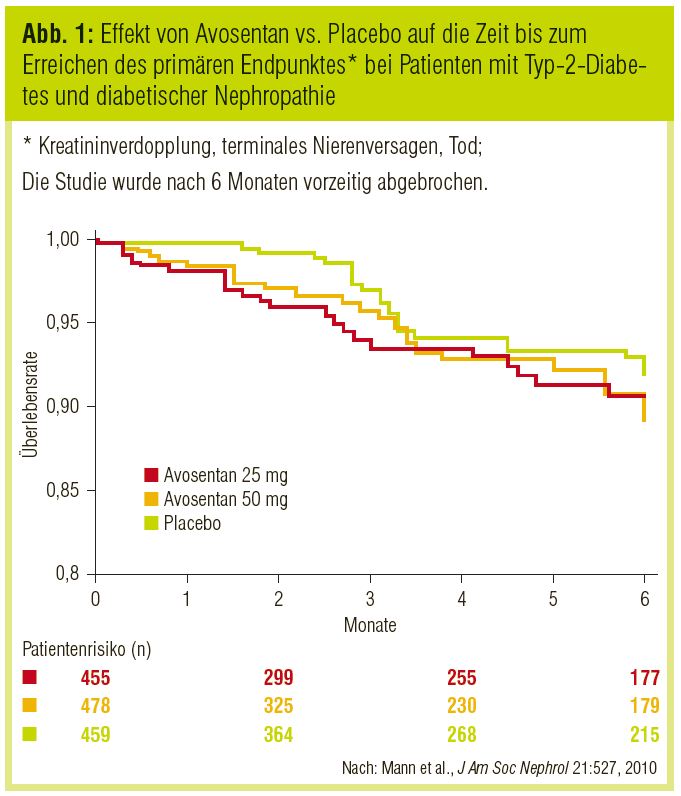
Eine Erfolg versprechende placebokontrollierte Phase-III-Studie bei Typ-2-Diabetes und Nephropathie mit SPP301/ Avosentan (ASCEND) wurde im Juli 2005 begonnen, im Dezember 2006 nach Rekrutierung von 1.392 Patienten mit eGFR-Stadium 3 bis 4 aber gestoppt. Grund war verstärkte Flüssigkeitsretention und Herzinsuffizienz in der Verumgruppe. In der Studie mit dem oralen Endothelinantagonisten in der Dosierung 25 oder 50 mg einmal täglich, additiv zur Therapie mit ACE-Hemmern/Angiotensinrezeptorblockern (ARB), war bei höherer Dosierung eine Reduktion der Albumin-Kreatinin-Ratio um bis zu 49% zu beobachten (Mann et al., J Am Soc Nephrol 2010). Aufgrund des kurzen Beobachtungszeitraums konnte ein Unterschied in der Progression der renalen Insuffizienz nicht demonstriert werden (Abb. 1).
Die erste Studie mit Avosentan in Kombination mit ACE-Hemmer oder Angiotensinrezeptorblocker bei 286 Patienten (mehrheitlich mit Typ-2-Diabetes) wurde von Wenzel et al. (J Am Soc Nephrol 2009) publiziert. In dieser Studie führte Avosentan dosisabhängig zu einer Reduktion der Proteinurie um 1630% im Vergleich zu den Ausgangsbefunden.
Blockade des Transforming Growth Factor β
Pirfenidon ist ein potentes antifibrotisches Molekül, dessen Hauptwirkung sich aus der Blockade des Transforming Growth Factor β (TGF-β), dem wichtigsten Zytokin in der renalen Fibrogenese, ergibt. Weiters besteht eine Anti-TNF-Aktivität sowie eine Hemmung der NADPH-Oxidase. Primäre klinische Erfahrungen mit Pirfenidon, vermarktet unter dem Namen Esbriet®, bestehen in der Therapie der idiopathischen Lungenfibrose. Die ersten vielversprechenden Daten wurden bei fokaler segmentaler Glomerulosklerose publiziert (Cho et al., Clin J Am Soc Nephrol 2007). In einer rezenten US-amerikanischen Studie (Sharma et al., J Am Soc Nephrol 2011) erhielten 77 Patienten mit Typ-1- oder Typ-2-Diabetes und manifester diabetischer Nephropathie randomisiert 2.400 mg oder 1.200 mg Pirfenidon oder Placebo zur Therapie mit einem ACE-Hemmer oder ARB. Die eGFR betrug bei Einschluss 2075 ml/min. Im Therapiezeitraum von einem Jahr kam es in der Gruppe mit 1.200 mg Pirfenidon zu einer Verbesserung der eGFR um 3,3 ml/min, in der Placebogruppe und unter 2.400 mg Pirfenidon zu einem Abfall um 2,2 ml/min bzw. 1,9 ml/min. Die Albumin-Kreatinin-Ratio war am Studienende in allen 3 Gruppen unverändert.
Nebenwirkungen (gastrointestinale Symptome, Photosensivität und Müdigkeit) waren dosisabhängig, hatten jedoch auch hohe Drop-out-Raten der Patienten zur Folge. Bei der unter 1.200 mg Pirfenidon demonstrierten Verbesserung sind weitere Studien mit größeren Patientenzahlen sinnvoll.
Ähnliche Ansatzpunkte betreffend Fibrose ermöglichen potenziell auch die Blockade des Connective Tissue Growth Factor (CTGF) sowie des Vascular Endothelial Growth Factor (VEGF). In einer Phase-I-Studie mit Antikörpern gegen CTGF konnte eine Reduktion der Mikroalbuminurie gezeigt werden (Adler et al., J Am Soc Nephrol 2007). Experimentelle Daten zur Beeinflussung von VEGF und Einfluss auf Proteinurie sind noch widersprüchlich und bedürfen weiterer Studien.
Vitamin-D-Analoga
Ein Ansatzpunkt einer hoch dosierten Vitamin-D-Gabe besteht tierexperimentell in einem Einfluss auf die Reninbiosynthese und das RAAS. Insbesondere in Kombination mit einem ARB wurde dieser Effekt der Reduktion von Glomerulosklerose und Entwicklung von Proteinurie verstärkt. In der rezenten VITAL-Studie mit Paricalcitol (Zemplar®) 2 μg/Tag bei 281 Patienten mit Typ-2-Diabetes, placebokontrolliert zusätzlich zur RAAS-Blockade, konnte eine Reduktion der Proteinurie um bis zu 28% gezeigt werden (de Zeuuw, Lancet 2010).
Pentoxifyllin
In einer rezenten Metaanalyse von McCormick et al. (Am J Kidney Dis 2008) konnte ein Effekt von Pentoxifyllin (Trental®) auf die Reduktion der Proteinurie bei diabetischer Nephropathie gezeigt werden. Die Studien waren jedoch meist zu klein oder von kurzer Dauer. Der Effekt von Pentoxifyllin dürfte sowohl durch rheologische als auch antiinflammatorische Regulation bedingt sein, in vivo wirkt die Substanz zudem als Phosphodiesteraseinhibitor. In der laufenden randomisierten spanischen PREDIAN-Studie (Navarro-González et al., J Diabetes Complications 2011) bei Patienten mit Typ-2-Diabetes im KDOQI-Stadium 3 bis 4 sollen die offenen Fragen beantwortet werden.
Klinisch etablierte Substanzen
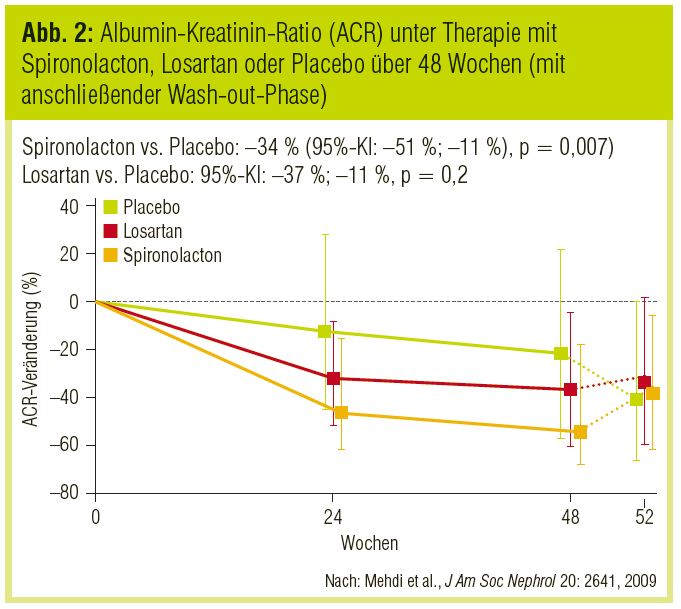
Auch die zusätzliche Aldosteronblockade ist effektiv: In verschiedenen kleinen Studien (z.B. Saklayen et al., J Investig Med 2008; Mehdi et al., J Am Soc Nephrol 2009; Abb. 2) konnte der positive Effekt einer zusätzlichen Gabe der Aldosteronantagonisten Spironolacton (Aldactone®) und Eplerenon (Inspra®) additiv zu ACE-Hemmern oder ARB auf die Reduktion der Proteinurie gezeigt werden. Das Risiko der Hyperkaliämie war in den Studien evident. In einer Metaanalyse von Sarafidis et al. (Am J Kidney Dis 2010) konnte schließlich auch der Effekt von PPARγ-Agonisten (z.B. Pioglitazon/Actos®) auf die Proteinurie bei Diabetes demonstriert werden. Der exakte Mechanismus ist unklar.
Ausblick
Trotz aller Bemühungen zu optimaler Blutzucker- und Hochdruckeinstellung entwickeln viele diabetische Patienten eine Nierenschädigung; dies lässt auch auf eine genetische Disposition schließen und erklärt die Bemühungen, nach therapeutischen Angriffspunkten für die Progressionshemmung der Nephropathie zu suchen. Unabhängig davon eröffnen sich bei fehlender Toxizität (!) und entsprechendem (genetischem?) Risikoprofil auch Möglichkeiten, neue Substanzen schon vor der häufigen Entwicklung einer diabetischen Nephropathie und kardiovaskulären Begleitproblematik in der Primärprophylaxe einzusetzen. Auch für die Therapie anderer (insbesondere mit Proteinurie einhergehender) Nierenerkrankungen ergeben sich, optimistisch gesehen, neue Anwendungen für die Zukunft.