Lupusnephritis: Update zur Klassifikation und Therapie
Die systemische Lupus erythematodes (SLE) ist eine komplexe, chronische und lebensbedrohliche Autoimmunerkrankung, die prinzipiell alle Organe, inklusive die Nieren betreffen kann. Die Lupusnephritis (LN) stellt die häufigste Organmanifestation des SLE dar (ca. 50 % aller SLE-Patienten) und beeinflusst die Lupus-bedingte Morbidität, Mortalität und Lebensqualität wesentlich (Almaani S. et al., 2017). Die klinischen Verläufe der Nierenbeteiligung sind unterschiedlich und können bei gleichem klinischen Bild mit verschiedenen Glomerulonephritiden korreliert sein. Sowohl der klinische Verlauf als auch die histopathologischen Veränderungen können bei einem Patienten im Verlauf der LN abweichen (Anders H. J. et al., 2016; Haffner D. et al., 2007).
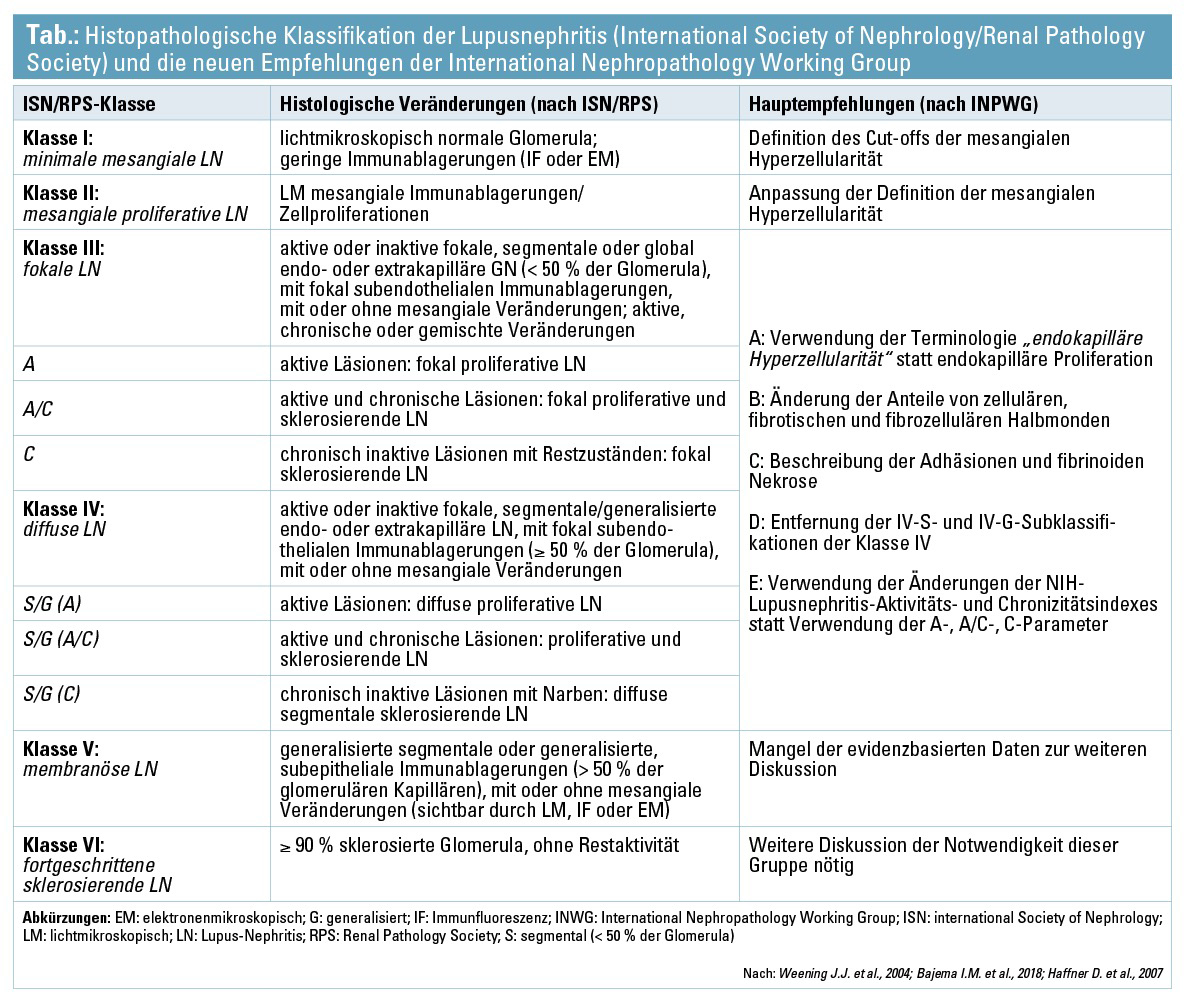
Die Planung der Diagnostik und Therapie der LN erfordert eine enge Zusammenarbeit zwischen Pathologen und Nephrologen. Eine Nierenbiopsie bei SLE-Patienten mit renaler Symptomatik (glomeruläre Hämaturie, Proteinurie) ist vor Beginn der Induktionstherapie erforderlich. Die histopathologische (lichtmikroskopische, immunhistologische und ultrastrukturelle) Diagnostik von Nierenbiopsien, die Angabe einer international anerkannten Klassifikation der LN sowie die Angabe des semiquantitativen glomerulären Aktivitätsindex und tubulointerstitiellen Chronizitätsindex können zur Diagnosesicherung, Abschätzung der Prognose und zu Therapieentscheidungen wesentlich beitragen. Pathophysiologisch betrifft die Erkrankung hauptsätzlich die Glomerula, die prä- und postglomerulären Gefäße und das Interstitium, die exakte Nierenbeteiligung wird jedoch nach der Einteilung der International Society of Nephrology und Renal Pathology Society (ISN/RPS) (Weening J. J. et al., 2004) klassifiziert (Tab.). Die Therapieempfehlungen laut den derzeit geltenden internationalen Leitlinien basieren auf dieser histopathologischen Klassifizierung. Trotz dieser Verfügbarkeit liegt die Remissionsrate nur bei 50–70 %. Bei 10–20 % der Patienten ist die Entwicklung einer terminalen Niereninsuffizienz (ESRD) in 5 Jahren nach der Diagnosestellung zu beobachten (Feng Y. et al., 2017). Diese schlechte Prognose und die negativen Resultate vieler klinischen Studien mit verschiedenen immunsuppressiven Therapien stellen eine enorme Herausforderung zum Einsatz von therapeutischen Strategien dar. Daraus ergibt sich die Notwendigkeit einer Überarbeitung der histopathologischen Klassifizierung sowie eine Adaptierung und Erneuerung der aktuellen Therapiestrategien.
Histopathologische Klassifizierung: Verbesserung erforderlich
Die Histopathologie anhand der ISN/RPS-Klassifizierung wurde vor kurzem in einem Konsensuspapier der International Nephropathology Working Group (INPWG) überarbeitet und veröffentlicht (Bajema I. M. et al., 2018). Die Arbeitsgruppe besteht aus mehreren internationalen renommierten Pathologen, die im Jahr 2016 im Rahmen eines Expertmeetings an der Universität Leiden ihre Empfehlungen diskutiert und formuliert haben. Ziel dieser Arbeit ist die Verbesserung und Ergänzung der Definitionen der histopathologischen Läsionen der LN sowie die Änderung des bestehenden Klassifikationssystems, um die Therapie und die Prognose verbessern zu können. Bei der Publikation handelt es sich grundsätzlich um ein Empfehlungsstatement zu weiteren Diskussionen zu den derzeit bestehenden Fragestellungen der ISN/RPS-Klassifikation. Weiterhin wird die Arbeit als Basis für künftige Studien empfohlen, damit die fehlenden Evidenzen untersucht und die neuen Definitionen bestätigt werden können. Die Änderungen wurden für alle Klassen diskutiert und zudem die glomerulären, tubulointerstitiellen und vaskulären Veränderungen getrennt erörtert. Kurz zusammengefasst: Neue Definitionen wurden zur mesangialen Hyperzellularität sowie für zelluläre, fibrozelluläre und fibrotische Halbmonde empfohlen und die Terminologie der endokapillären Proliferation in endokapilläre Hyperzellularität umformuliert. Die meisten Empfehlungen wurden zu den Klassen III und IV abgegeben. Unter anderem wurden die Subklassen IV-S und IV-G gelöscht, die aktiven und chronischen Benennungen mit Aktivitätsindexes und Chronizitätsindexes ersetzt und die fibrinoide Nekrose als neu spezifisch deskriptiver Faktor etabliert. Im Falle der Klassen V und VI müssen noch evidenzbasierte Daten gesammelt und weiter diskutiert werden. Auch wurden die tubulointerstitiellen Läsionen diskutiert. Die Empfehlungen der INPWG zu ISN/RPS-Definitionen und -Klassifikation sind in der Tabelle zusammengefasst.
Neue Therapiestrategien – die Zeit der Off-Label-Therapien
Traditionelle Therapie der LN: Die größten internationalen Leitlinien zur Therapie der LN sind jene der American College of Rheumatology (ACR) (Hahn B. H. et al., 2012), der Kidney Disease: Improving Global Outcomes (KDIGO clinical practice guideline for glomerulonephritis, 2012) und ein gemeinsames Dokument der European League Against Rheumatism und European Renal Association–European Dialysis and Transplant Association (EULAR/ERA-EDTA) (Bertsias G. K. et al., 2012).
Als Induktionstherapie der LN bei Klasse III–V (ggf. auch bei Klasse II) stehen eine aggressive, immunsuppressive Therapie mittels Mycophenolat-Mofetil (MMF) (und Mycophenolsäure) in äquivalenter Dosis oder niedrig dosiertes intravenöses Cyclophosphamid (CYC) in Kombination mit Glukokortikoiden zur Verfügung, entsprechend dem besten Nutzen-Risiko-Verhältnis. Bei LN Klasse I und VI besteht derzeit keine Indikation zu einer immunsuppressiven Therapie. Zur Erhaltungstherapie werden am häufigsten Azathioprin (AZA) oder MMF mit niedrig dosierten Glukokortikoiden verwendet (Yap D. Y. et al., 2018). Die Therapiemöglichkeiten haben sich in den letzten Jahrzehnten deutlich erweitert, sie ermöglichen die Wahl einer individualisierten Therapiestrategie, jedoch sind aufgrund der oben bereits diskutierten Erfolgsraten neue Therapien und das Verständnis der genauen Pathogenesis der LN unbedingt notwendig.
Calcineurin-Inhibitoren: Neben der Optimierung der Initialtherapie müssen zukünftige Therapiestrategien auf die Verbesserung der Immunsuppression im Langzeitverlauf abzielen. Die Calcineurin-Inhibitoren (CNI) spielen, neben ihrer Rolle in der Modifikation der T-Zell-Antwort, eine bedeutende Rolle bei der Verhinderung von Podozytenschaden (und damit Proteinurie) durch Stabilisierung der Podozytenstruktur.
Eine chinesische Studie untersuchte die Wirksamkeit einer Multitarget-Therapie mit Tacrolimus, MMF und Kortikosteroiden (Tacrolimus: 2–3 mg/Tag; MMF: 0,5–0,75 g/Tag; Prednison: 10 mg/Tag) als Erhaltungstherapie und inkludierte insgesamt 206 Patienten aus 19 Zentren. Davon erhielten 90 Patienten eine traditionelle Erhaltungstherapie (nach CYC-Induktionstherapie) mittels AZA (2 mg/kg pro Tag) und Kortikosteroid (10 mg/Tag). Im Vergleich zur traditionellen Therapie war die renale Remissionsrate durch die Multitarget-Therapie gleich, obwohl eine signifikante Reduktion (44,4 % versus 16,4 % für die Multitarget-Therapie) der unerwünschten Ereignisse mit reduzierter Abhebungsrate erreicht werden konnte. Es besteht jedoch kein Zweifel, dass die Effektivität und das Sicherheitsprofil der Multitarget-Therapie mit Tacrolimus als Erhaltungstherapie bei LN Patienten bewiesen wurde (Zhang H. et al., 2017).
Eine neue Substanz, Voclosporin, ist ein modifiziertes Cyclosporin-Molekül, das in vitro deutlich potenter ist als Cyclosporin A, und zusätzlich weist es deutlich bessere pharmakokinetische/pharmakodynamische Eigenschaften mit verbesserter Calcineurin-Inhibition auf. Laufende klinische Studien zeigten eine gute Verträglichkeit und eine sehr gute Effektivität bei Patienten nach Nierentransplantation (Busque S. et al., 2011). Eine große randomisierte, kontrollierte multizentrische Studie (AURA-LV), welche 265 Patienten mit LN inkludierte, untersuchte die Effektivität einer Induktionstherapie mit niedrig dosiertem und hoch dosiertem Voclosporin. Vergleichend zur Referenz (MMF + Steroidtherapie) konnte durch die Voclosporin-Therapie d
ie Rate der kompletten Remissionen gesteigert werden, wobei allerdings die Häufigkeit der unerwünschten Ereignisse erhöht war (Rovin B. H. et al., 2019). Mit Voclosporin konnte ein schneller Therapieerfolg verzeichnet werden (48 Wochen), jedoch war die Mortalitätsrate (in der niedrig dosierten Voclosporin-Gruppe) erhöht, sodass der künftige Stellenwert dieses Medikaments zur Behandlung bei LN fraglich ist.
B-Zell-Depletionstherapie – Suche nach den richtigen Patienten: Neben den immunsuppressiven Substanzen werden Antikörper, die bereits bei anderen Indikationen zugelassen sind, jetzt auch bei LN-Patienten eingesetzt. Hierzu zählen unter anderem Rituximab (RTX) und Ofatumumab (beide Anti-CD20-Antikörper). Hintergrund sind mehrere Mausmodelle, bei denen B-Zellen depletiert wurden und die keine Nephritis entwickelten, obwohl die Injektion von Antikörper zu Immunkomplex-Ablagerungen führte. Überraschendweise wurde in Mausmodellen mit B-Zellen ohne Antikörper-Produktion die Entwicklung einer Nephritis beobachtet. Daher wird es vermutet, dass die B-Zellen als Antigen-präsentierende Zellen funktionieren, die bei der T-Zell-Aktivierung und Zytokin-Produktion deutlich mitwirken (Almaani S. et al., 2019).
RTX depletiert über Bindung an das CD20-Oberflächenmolekül B-Zellen, nicht jedoch Plasmazellen. Die erste große Studie, die die Effektivität der RTX-Therapie untersuchte, war die LUNAR-Studie (Rovin B. H. et al., 2012). Obwohl die Studie negative Ergebnisse hinsichtlich der primären klinischen Endpunkte zeigte, konnten in dieser Analyse mögliche Zielwerte der B-Zell-Depletion identifiziert werden. Es konnte unter anderem gezeigt werden, dass bei den Patienten mit einer kompletten peripheren B-Zell-Depletion (0 Zellen/µl peripheres Blut) eine gänzliche Remission (Albumin-Kreatinin-Ratio < 0,5 und normales Serumkreatinin) bei 47 % der Patienten (versus 13 % bei inkompletter B-Zell-Depletion) nach 78 Wochen erreicht werden konnte (Gomez Mendez L. M. et al., 2018).
In der RITUXILUP-Studie, die 50 LN-Patienten einschloss, konnte bei 52 % eine komplette Remission und bei 32 % eine partiale Remission (nach 52 Wochen) mit einmaliger RTX-Gabe (+ Methylprednisolon) am 1. und 15. Therapietag als Induktionstherapie und mit MMF als Erhaltungstherapie erreicht werden. Die Häufigkeit von unerwünschten Ereignissen waren selten (insgesamt 18 %, davon 10 % wegen Infektkomplikationen) (Condon M. B. et al., 2013). Eine kleine Studie (n = 16 Patienten) aus England mit 7-Jahren Follow-up-Zeit zeigte ähnliche Ergebnisse: Nach RTX -Gabe benötigten die Patienten im Verlauf im Vergleich zu der Kontrollgruppe eine deutlich geringere kumulative Steroiddosis. Dennoch war diese beträchtliche Dosisreduktion nicht mit einem schlechteren Sicherheitsprofil und Remissionsrate assoziiert (Gracia-Tello B. et al., 2017).
Von Rocatello und Kollegen wurden die Daten der ersten Studie mit Rituximab als Induktionstherapie ohne Erhaltungstherapie mit 12 Patienten veröffentlicht (Rocatello D. et al., 2017). Alle Patienten hatten eine schwere LN (Klasse III–V) und wurden mit 375 mg/m2 RTX am 1., 8., 15. und 22. Tag und zwei weiteren dosisgleichen RTX-Zyklen 1 und 2 Monate später behandelt. Zusätzlich erhielten die Patienten 2-mal 750 mg CYC (4. und 17. Tag) und 3-mal intravenöses Methylprednisolon (15 mg/kg, am Tag 1, 4 und 8) in Kombination mit 50 mg oralem Kortison für 2 Wochen, danach mit schnellem Schema auf 5 mg in 3 Monaten getapert. Über eine Studiendauer von durchschnittlich 44,5 Monaten wurden die positiven Änderungen von BSG, Komplementfaktor C4 und Proteinurie sowie gute Remissionsraten (Rückfall bei 3 Patienten nach 36, 42 und 72 Monaten) beobachtet. Interessant ist, dass die Durchflusszytometrie-Analysen bei einem „Responder“-Patienten mit kompletter Remission die Steigerung des Anteiles der T-reg-Zellpopulation über 9 Monate gezeigt haben. Bei den Patienten mit schnellerer Remission war eine längere B-Zell-Repopulationszeit zu beobachten. Eine innovative neue Studie von Masoud und Kollegen mit 16 Patienten untersuchte die Effektivität von Ofatumumab bei den Patienten mit einer RTX-Allergie (Masoud S. et al., 2018). Während der Beobachtungszeit traten keine allergischen Reaktionen auf und es konnten gute serologische und klinische Ergebnisse erreicht werden.
Insgesamt kann behauptet werden, dass die Verwendung von RTX mit einem deutlich niedrigeren Kortikosteroid-Bedarf in Begleitung mit einem guten Sicherheits- und Remissionsprofil in Verbindung steht.
RESÜMEE: Fortschritte in der Diagnostik und in der Behandlung der LN sind erreicht, aber weitere Schritte wie die Überarbeitung und Harmonisierung der pathologischen Klassifizierung stellen die Grundvoraussetzung für die bessere Auswertung von neuen Studienprotokollen beziehungsweise neuen Substanzen dar. Trotz fehlender Zulassung besteht inzwischen neue Evidenz, dass die Kombination von CNIs mit den Referenzsubstanzen sowie die B-Zell-Depletionstherapie bei geringerer Steroiddosis eine wirksame Alternative zu den Referenztherapien darstellen könnten.