Nierentransplantation: Hot Topics zu Risk Profiling und klinischer Transplantation
Der Artikel ist eine Zusammenfassung von ausgewählten Vorträgen, die im Rahmen der Jahrestagungen der European Renal Association–European Dialysis and Transplant Association und der American Society of Nephrology präsentiert wurden und ein aktuelles Update für Probleme aus dem Gebiet der Nierentransplantation darstellen.
Das metabolische Risiko
Dabei wurden die Themen Diabetes mellitus, Übergewicht und metabolisches Syndrom angesprochen. Bei Transplantat-Empfängern standen hyperglykämische Phasen im Fokus, die vor allem am Nachmittag auftreten und nicht durch Nüchtern-Blutzucker-Messungen allein identifiziert werden können. Eine Blutzuckermessung wird auch am Nachmittag zwischen 16 und 18 Uhr empfohlen. Empfänger, die nach der Transplantation Diabetes entwickeln, hatten oft bereits vorher einen okkulten, unentdeckten Diabetes. Betroffen sind etwa 8 % der Kandidaten. Auch das in Wien stattgefundene internationale Konsensus-Meeting über Post-Transplant-Diabetes mellitus (PTDM) wurde angesprochen, in dem empfohlen wurde, den Begriffen NODAT (New Onset Diabetes After Transplantation) nicht mehr zu verwenden.1
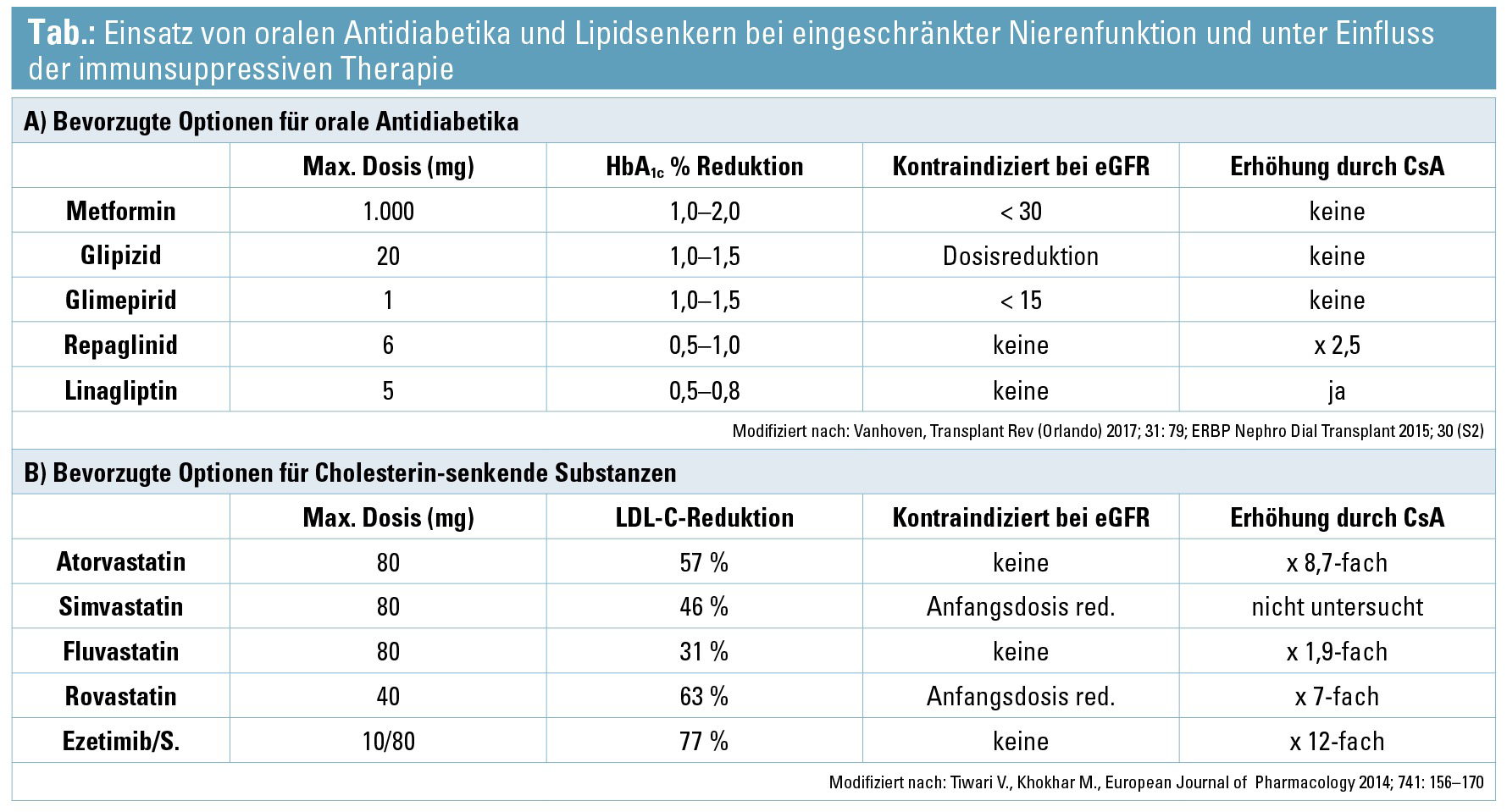
Weitere Themen waren Optionen zum Einsatz von oralen Antidiabetika und Lipidsenkern bei eingeschränkter Nierenfunktion und unter Einfluss der immunsuppressiven Therapie (Tab.).
Risiko durch Übergewicht
Die Strategien für Gewichtsreduktion bei übergewichtigen Transplantat-Kandidaten inkludiert die üblichen Empfehlungen, die von Lifestyle-Änderungen über Medikamente bis hin zu operativen Eingriffen reichen. Diätetische Maßnahmen haben nur eine eingeschränkte Bedeutung, nachdem Dialysepatienten ohnedies eine ganze Reihe von Ernährungsvorschriften einhalten müssen wegen des Risikos der Hyperkaliämie und einer Hyperphosphatämie. Eine größere Bedeutung hat die körperliche Bewegung, wobei sportliche Aktivität im immer älter werdenden Kollektiv der Dialysepatienten auch nur in beschränktem Ausmaße möglich ist. Als denkbare Möglichkeiten wurde auch eine Behandlung mit Liraglutid zur Gewichtsabnahme angeführt. Ein längeres Thema war die Empfehlung für operative Maßnahmen (Sleeve Gastrectomy). In einer Studie von Kim et al.2 wurden Patienten mit laparoskopischer Sleeve Gastrectomy (LSC) vor Transplantation mit einer Kontrollgruppe verglichen. Bei der späteren Transplantation traten chirurgische Komplikationen in 5 % der Kontrollgruppe auf, hingegen keine in der LSC-Gruppe. In dieser war auch DGF (Delayed Graft Function) signifikant niedriger, ebenso die Häufigkeit einer neuerlichen renalen Dysfunktion.
Andererseits wurde auch auf die Risiken einer zu raschen Gewichtsabnahme hingewiesen, wo bei mehr als 5 kg bereits ein 20 % erhöhtes Mortalitätsrisiko bestand. Wesentlich dürfte die Geschwindigkeit des Gewichtsverlustes sein. Jede Gewichtsabnahme muss unter sorgfältiger Beobachtung und diätologischer Beratung stattfinden, um Malnutrition oder Verlust an Muskelmasse zu verhindern.
Eine Studie von Krishnan et al.3 hat den Nutzen einer Transplantation versus Dialyse-Fortsetzung in verschiedenen BMI-Kategorien verglichen. Das Mortalitätsrisiko steigt bei einem BMI < 18,5 und > 35 deutlich an, ist aber unabhängig vom Dialyse- oder Transplantations-Status, d. h. sowohl massiv untergewichtige als auch massiv übergewichtige Patienten profitieren in gleichem Ausmaß von einer Transplantation wie Normalgewichtige, sodass ein Ausschluss solcher Patienten von der Transplantation nicht gerechtfertigt ist.
Kardiovaskuläres Risiko, Transplantatfunktion und Bluthochdruck
Das kardiovaskuläre Risiko ist bei Dialysepatienten und nach Transplantation signifikant höher im Vergleich zur Normalbevölkerung, wobei stattgefundene Abstoßungen noch zu den auch sonst gültigen Risikofaktoren hinzukommen. Deshalb ist ein sorgfältiges Screening von Transplant-Kandidaten unerlässlich. Über die Wertigkeit verschiedener invasiver und nicht-invasiver Untersuchungsmethoden herrscht allerdings weiterhin keine Einigkeit.
Beim Bluthochdruck korreliert der systolische Blutdruck nächtlich gemessen oder als 24-h-Wert nicht nur mit der kardiovaskulären Mortalität und Morbidität, sondern auch mit der Langzeit-Transplantatfunktion. Insbesondere sogenannte „Reverse-Dipper“, also Patienten mit nächtlichem RR-Anstieg haben signifikant schlechtere Ergebnisse. Umgekehrt haben Lee et al.4 gezeigt, dass durch therapeutische Senkung des nächtlichen Blutdrucks die Transplantatfunktion gebessert werden kann.
Immunsuppressive Initial- und Erhaltungstherapie
Die Verbesserung der Langzeitergebnisse ist weiterhin das wichtigste Ziel, das nur durch Kontrolle von immunologischen Empfängerreaktionen und durch Reduktion der CNI-induzierten Nephrotoxizität erreicht werden kann. Mit Belatacept steht ein in der Erhaltungstherapie gut untersuchter Hemmer der Kostimulation zur Verfügung, der ein deutliches Einsparen von Calcineurin-Hemmern (CNI) erlaubt und somit eine Verbesserung der renalen Transplantatfunktion. Ein rasches und komplettes Absetzten von CNIs ist allerdings mit einer deutlichen Zunahme von Abstoßungen vergesellschaftet, sodass diese Strategie nur für Patienten mit extrem niedrigem immunologischen Risiko in Frage kommt. Positiv ist aber, dass die De-novo-Bildung von Donor-spezifischen Anti-HLA-AK durch Belatacept reduziert werden konnte.5
Neben den konventionellen Schemata werden immer auch neue Substanzen getestet. ASKP 1240 ist ein humaner monoklonaler Anti-CD40-Antikörper, der in einem Protokoll mit Basiliximab und Steroiden gegen Tacrolimus oder Mycophenolat verglichen wird (NTC01780844). Primärer Endpunkt ist die Inzidenz von bioptisch diagnostizierten Abstoßungen. Ein weiterer monoklonaler Anti-CD40-AK (CFZ533) wird gegen Tacrolimus getestet (Cirrus I, NTC03663335). Primärer Endpunkt ist hier die Komposition aus Abstoßung, Tod und Transplantatverlust. Sekundäre Endpunkte sind im ersten Fall die eGFR und das Transplantat- und Patientenüberleben, bei der zweiten Studie die eGFR und das Sicherheitsprofil definiert durch Nebenwirkungen.
Antikörper-mediierte Abstoßungen
Ein stets aktuelles Thema ist die chonische, meist später auftretende ABMR (Antibody-mediated Rejection) als Ursache für Transplantatschädigung und -verlust. Zitiert wurde die österreichische Studie über die Effektivität von Bortezomib von Farzad Eskandary und Heinz Regele6. In einem randomisierten Placebo-kontrollierten Protokoll wurde untersucht, ob eine Behandlung mit dem Proteosom-Inhibitor ein Absinken der GFR und die Bildung von Donor-spezifischen AK verhindert. Obwohl das Ergebnis keine Effektivität, sondern nur eine gesteigerte Toxizität gezeigt hat, wurde die exzellent publizierte Studie als erste randomisierte Untersuchung zu dieser Fragestellung hervorgehoben. Weitere getestete Substanzen bei ABMR waren Eculicumab, ein monoklonaler AK zur Blockade des Komplementsystems, und ein C1-Esterase-Inhibitor, wobei sich bei beiden Pilotstudien vorerst nur ein Trend für Wirksamkeit abgezeichnet hat und eine abschließende Beurteilung noch ausständig ist.
Desensibilisierung von hochsensibilisierten Kandidaten auf der Warteliste
Transplant-Kandidaten mit präformierten Anti-HLA-AK, meist verursacht durch frühere Transplantationen oder Transfusionen, akkumulieren auf den Wartelisten, weil für sie wegen der Immunisierung zahlreiche Spenderorgane nicht verwendet werden können. Desensibilisierungsprotokolle sind deshalb ein ewiges Thema, um auch für dieses Patientenkollektiv geeignete Organe zu erhalten. Berichtet wurde über den Einsatz von IdeS (Imlifidase), eine Substanz, die humane IgG spaltet und somit Anti-HLA-AK unwirksam machen soll. In zwei Untersuchungen von Jordan et al.7 und Lonze et al.8 wurden derartige Patienten desensibilisiert und auf diese Weise transplantierbar gemacht. Die präliminären Daten zeigten gute Ergebnisse, wobei die Frage nach der Nachhaltigkeit solcher Maßnahmen überprüft werden muss. In den beschri
ebenen Publikationen werden keine schwerwiegenden Nebenwirkungen beschrieben, dennoch bleibt abzuwarten, ob durch größere Studien die Effektivität und die Sicherheit bestätigt werden können.
Transplant Therapeutics Consortium (TTC)
Das TTC wurde 2017 von der AST und der ASTS neu gegründet mit dem Ziel, durch die Zusammenarbeit von „Key Stakeholdern“ die Entwicklung neuer Substanzen für die Transplantation zu beschleunigen. Das Konsortium kooperiert mit der FDA, der „Transplantation Society“, dem Terasaki Research Institute sowie dem NIH und wird gefördert von der biopharmazeutischen Industrie.
CONCLUSIO: Bei beiden Kongressen wurden alte Probleme aufgerollt und teilweise neue Konzepte angeboten. Das erhöhte metabolische und kardiovaskuläre Risiko und die langsam schleichende Transplantatfunktionsverschlechterung standen dabei erwartungsgemäß im Fokus. Beide Probleme können sowohl durch Stoffwechselstörungen, durch die immunologische Konstellation und durch medikamentöse Nebenwirkungen bedingt sein. Das Angebot an Behandlungsmöglichkeiten, die zum Durchbruch führen könnten, ist noch immer limitiert, doch fällt auf, dass heute neue Optionen systematischer und mit höherer wissenschaftlicher Qualität untersucht werden als früher und deshalb Aussagen zum Nutzen präziser geworden sind.